תעוקת לב
 | |
| תחום |
קרדיולוגיה |
|---|---|
| טיפול |
|
| קישורים ומאגרי מידע | |
| eMedicine | article/150215 |
| DiseasesDB | 8695 |
| MeSH | D000787 |
| סיווגים | |
| ICD-10 | I20 |
| ICD-11 |
BA40 |
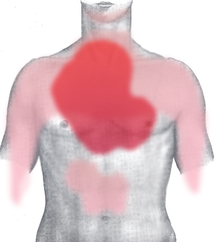
תעוקת לב או תעוקת חזה (בלועזית: "אנגינה פקטוריס") היא תסמין לבבי המאפיין מחלת עורקים כלילית ומתבטא בכאבים בחזה הנובעים ממחסור באספקת חמצן לשריר הלב, לרוב בעקבות ירידה בזרימת הדם בעורק הכלילי. תעוקת חזה מוגדרת כתחושת לחץ בחזה שלעיתים מקרין גם אל היד השמאלית, ללסת ולבטן עקב מאמץ. בתעוקת חזה יציבה יש כאבים כאלו במשך מספר דקות ובתעוקת חזה בלתי יציבה, אף יותר מזה.
הכאב נגרם משום שלא מגיע מספיק דם עם חמצן וחומרי מזון לשריר-הלב בשל היצרות באחד העורקים הכליליים או בגלל מאמץ יתר של שריר הלב. טרשת העורקים היא הגורם המאובחן להיצרות במרבית המקרים. גורמים אפשריים נוספים להופעת התעוקה, אשר גם משפיעים על חומרתה, הם הרעלת חד-תחמוצת-פחמן, היפוגליקמיה[1], עומס גופני ואף עומס נפשי ("תסמונת הלב השבור")[2], גורמים זיהומיים (למשל חיידק הליקובקטר[3], נגיפים[4] וייתכן גם זיהומים סביב שיניים[5]), כמו גם אנמיה, צריכת סמים ושימוש בתרופות מסוימות.
הטיפול המקובל בתעוקת לב כולל שינוי הרגלי חיים, שמירה על ערכים תקינים של כולסטרול, לחץ דם וסוכר (אצל חולים בסוכרת למשל), וכן טיפול בתעוקה עצמה החל מתרופות שמטרתן הרחבת כלי דם (ניטרטים) והורדת העומס על הלב (חוסמי בטא, חוסמי תעלות סידן) ועד לצנתור לב ובמידת הצורך- ניתוח מעקפים.
גורמי הסיכון העיקריים להתפתחות מחלת לב איסכמית ובפרט תעוקת לב כוללים בין היתר עישון, יתר לחץ דם וסוכרת.
קליניקה[עריכת קוד מקור | עריכה]
החולה הטיפוסי הסובל מתעוקת לב הוא לרוב גבר מעל 50 או אישה מעל גיל 60, המתלוננים על אפיזודות של חוסר נוחות בחזה, בדרך כלל מדובר בתעוקה קצרה המבטאת איסכמיה (אי אספקת חמצן) חולפת של שריר הלב. לרוב לא מדובר בכאב ממש, אלא מתוארת תחושת חנק, לחץ בחזה, אי נוחות וכבדות, ורק לעיתים נדירות מדובר בכאב של ממש. כאשר מבקשים מן המטופל לתאר את מיקום התחושה הוא לרוב מצביע מעל עצם החזה בסימן אגרוף הבא לבטא את הלחץ עצמו (קרוי גם "הסימן ע"ש לוין"). התעוקה עצמה אורכת בין 2-5 דקות ולעיתים מקרינה לכתף, ללסת, לגב ולרום הבטן. חוסר הנוחות האמור מתגבר במאמץ, בקור, לאחר ארוחה כבדה או בעת התרגשות, אם כי לעיתים חוסר הנוחות מופיע בעת מנוחה או בלילה למשל (אנגינה דקוביטוס).
מרבית מהחולים יודעים לציין החל מאיזו רמת פעילות תתרחש התעוקה (למשל "לאחר עליה במדרגות לבית"). חולים אלו סובלים כאמור מתעוקת לב יציבה. עם זאת יש חולים שהתעוקה משתנה אצלם ויש קושי בהערכת הסף ממנו והלאה תיווצר תעוקה. חולים אלו יכולים לתאר למשל תעוקה אפילו במאמץ קל בבוקר, אם כי בצהריים הם מסוגלים לבצע מאמץ גופני גדול בהרבה ללא תעוקה. התעוקה עצמה לרוב חולפת בתוך 1-5 דקות, בין אם הפעילות הגופנית מופסקת או שהחולה נח ונוטל תרופה (לרוב, ניטרוגליצרין המרחיב את כלי הדם). אצל נשים, וגם אצל חולי סוכרת, ההסתמנות הקלינית היא לעיתים שונה והתיאור הרלוונטי הוא "angina equivalent"- כלומר, תסמינים של עייפות, בחילות, קוצר נשימה, מיקום לא טיפוסי של הכאב וכן הלאה. נשים מהוות אתגר נוסף מאחר שאצלן יש לעיתים תסמינים קליניים של תעוקה, אולם ללא הוכחה של חסימת העורקים הכליליים הגדולים (הסיבה לתעוקה במקרים כאלו יכולה להיות למשל מחלה של כלי דם קטנים יותר, והעברת תחושת כאב לא תקינה של הלב).
הכאב הוא ביטוי קליני לתופעה של איסכמיה בשריר הלב, אשר נגרם ממחלת לב איסכמית שבה, כתוצאה מהתהוות של טרשת עורקים במרבית מן המקרים, יש היצרות של כלי הדם המספק דם לאותו אזור בשריר הלב, כך שבשעת עליה בביקוש לחמצן אין יכולת לספק דרישה זו.
היסטוריה רפואית ובדיקה גופנית[עריכת קוד מקור | עריכה]
חולה אשר יש חשד לגביו כי הוא סובל תעוקת לב, צריך להישאל בין היתר, את השאלות הבאות:
- האם התעוקה מתרחשת בתדירות גבוהה יותר לאחר מאמץ או האם מעירה את החולה משינה.
- האם יש סיפור של שבץ, או מחלת עורקים פריפרית (הבאה לידי ביטוי למשל בצליעה לסירוגין).
- האם יש סיפור משפחתי- גבר מדרגת קרבה ראשונה למטופל, אשר סבל ממחלת לב איסכמית מתחת לגיל 55, או אישה מתחת לגיל 65.
- האם המטופל סובל ממחלות נוספות כגון- סוכרת, היפרליפידמיה, יתר לחץ דם, וכן האם החולה מעשן.
בבדיקה הגופנית, במידה והחולה לא חש תעוקה תוך כדי, קשה להתרשם ממצאים גופניים אולם יש להעריך קיומה של טרשת עורקים באזורים שונים כגון אוושות על פני הקרוטידים, דופק מופחת בגפיים תחתונות ואנאוריזמה של האאורטה הבטנית. לעיתים ניתן להתרשם מהגדלה של הלב ומאוושה לבבית. קיימת חשיבות לשלילת פתולוגיות אחרות כגון היצרות מסתם אבי העורקים, אי-ספיקת מסתם אבי העורקים, יתר לחץ דם ריאתי וקרדיומיופתיה היפרטרופית מאחר שמחלות אלו כשלעצמן גורמות לתעוקה לבבית גם בהיעדר מחלת לב איסכמית. בדיקה גופנית תוך כדי התקף אנגינוטי יכולה להועיל באבחנה היות שתעוקת לב יכולה להביא לקול לב שלישי או רביעי (קולות לב) וממצאים נוספים.
סוגים של תעוקת לב[עריכת קוד מקור | עריכה]
קיימות שלוש צורות של אנגינה פקטוריס-
- תעוקת לב יציבה או טיפוסית – זוהי תעוקת הלב הקלאסית, אשר מופיעה במאמץ. רבדים טרשתיים חוסמים את העורקים הכליליים בלב ומפריעים לזרימה, וכאלה עולה צריכת החמצן, לרוב במאמץ, הזרימה המוגבלת דרך העורק לא מספיקה. סימן אבחנתי חשוב בזמן ההתקף, הוא ירידת המקטע ST בבדיקת אק"ג (המקטע אשר במהלכו שרויים כל שריר הלב בדה-פולריזציה)- אשר חולף יחד עם היעלמות הכאב.
- תעוקת לב על שם פרינצמטאל (Printzmetal angina) או תעוקה מעווית כלי הדם (vasospastic angina): זוהי צורה של תעוקת לב אשר מופיעה בזמן מנוחה ונגרמת על ידי כיווץ של עורק כלילי (לרוב במקום שכבר עבר היצרות בעבר) ולא כתוצאה ממאמץ יתר אם כי עלולה להחמיר במאמץ יתר. במקרים אלו באק"ג ניתן לראות עלייה של מקטע ST. בין הגורמים לתעוקת חזה על שם פרינצמטל - עישון ונטילת אספירין[6].
- תעוקת לב לא יציבה היא מצב, שיכול להופיע אצל חולה אשר קודם לכן סבל מתעוקת לב יציבה, אך יכול להתרחש ללא תנאי מקדים זה. ההתקפים בתעוקת לב זו מתרחשים בתדירות הולכת וגוברת. משך הכאב ארוך יותר וחומרתו קשה יותר. הכאב מופיע לאחר מאמץ קטן או אפילו בזמן מנוחה. בחולים מסוימים עלולה תעוקת לב זו להתקדם לאוטם ואף למוות פתאומי. תעוקה זו משלבת בין היתר רבדים טרשתיים, הופעת קרישי דם ועווית של העורק הכלילי. למעשה, הגורם העיקרי בהתהוות מחלה זו הוא הפחתה בזרימת הדם הכלילית כתוצאה מהתלכדות טסיות דם והתהוות רובד טרשתי.
בדיקות דם[עריכת קוד מקור | עריכה]
אף שהאבחנה של תעוקת לב יכולה להיעשות גם על סמך הריאיון הרפואי והבדיקה הגופנית בלבד, ניתן לקחת בדיקות נוספות אשר יאששו את האבחנה:
- מדידת רמת השומנים בדם
- גלוקוז והמוגלובין A1C
- רמות חלבון מגיב C (C-RP) – חלבון העולה במצבי דלקת ונמצא כגורם סיכון בלתי תלוי למחלת לב איסכמית.
בדיקות אק"ג, הדמיה וצנתור לבבי[עריכת קוד מקור | עריכה]
בדיקת אק"ג יכולה להיות תקינה אצל חולים עם תעוקת לב, אולם לעיתים ניתן לראות שינויים במקטע ST ובגל T, וכן סימנים להיפרטרופיה של חדר שמאל ולהפרעות קצב והולכה אשר מאפיינים מחלת לב איסכמית. כל הסימנים הללו יכולים להופיע גם במחלות לבביות אחרות (כלומר, אינם ספציפיים), אולם כאשר סימנים אלו מופיעים בזמן התקף תעוקתי ועוברים לאחריו (למשל, שינויים בגל T ובמקטע ST) הם יותר ספציפיים לתעוקת לב.
מאחר שהקליניקה בתעוקת לב לרוב מתרחשת בזמן מאמץ, המבחן היעיל לאבחון מחלה זו הוא בביצוע אק"ג במאמץ, כלומר ביצוע ארגומטריה, לרוב על גבי מסילה. מבחן המאמץ מסתיים כאשר יש תלונות גופניות (כגון תעוקה, סחרחורת, עייפות קשה, קוצר נשימה חריף) או תיעוד תוך כדי באק"ג על צניחה של מקטע ST ביותר מ-2 מ"מ או התפתחות של טכיקרדיה חדרית. במקרה שהמטופל לא מסוגל לבצע פעילות גופנית, ניתן לבצע הדמיה של הלב על ידי מיפוי גרעיני, אקוקרדיוגרפיה, דימות תהודה מגנטית ללב או טומוגרפיית פליטת פוזיטרונים ללב.
מבחן "חיובי" של אק"ג במאמץ הוא מבחן שבמהלכו מתועדת ירידה במקטע ST של לפחות 1 מ"מ הנמשך מעל 0.08 שניות. לעיתים המבחן חיובי למרות שאין תעוקת לב, ולעיתים המבחן שלילי על אף קיומה של התעוקה (חיובי כוזב ושלילי כוזב, בהתאמה). עם זאת, נמצא כי גברים מעל גיל 50 המתייצגים עם תלונה טיפוסית של תעוקת לב, ואשר פיתחו תעוקת לב במהלך הבדיקה, סובלים בכ-98% מן המקרים ממחלת לב כלילית. התוויות נגד לביצוע מבחן מאמץ כוללות תסמינים של תעוקת לב במנוחה ב-48 השעות האחרונות, קצב לא סדיר של שריר הלב, דלקת חריפה של שריר הלב, אי-ספיקת לב לא מאוזנת, היצרות חריפה של מסתם אבי העורקים, יתר לחץ דם ריאתי קשה ואנדוקרדיטיס זיהומית.
דימות נוסף של שריר הלב יכול להיעשות באמצעות ביצוע מיפוי תלוים של הלב וכן באמצעות אקוקרדיוגרפיה ואמצעי דימות אחרים. מבחן מאמץ על ידי מיפוי לב הוא מבחן בו מודגמים האזורים האיסכמיים בשריר הלב לאחר מאמץ. המאמץ יכול להיעשות גם בצורה תרופתית על ידי מתן תרופות המביאות לעלייה בדרישת הלב לחמצן כגון דיפירידמול או דובוטמין. באותו האופן, ניתן לבצע גם בדיקת אקוקרדיוגרפיה במאמץ (תרופתי או גופני). במידת הצורך ובהינתן התוויות מסוימות, ניתן לבצע צנתור לב.
פרוגנוזה[עריכת קוד מקור | עריכה]
הפרוגנוזה הצפויה לחולי תעוקת לב תלויה במידת החומרה של המחלה. קיימים סימנים במהלך בדיקות ההדמיה המרמזים על סיכון גבוה לאירועים כליליים עתידיים. סימנים אלו כוללים חוסר יכולת להתעמל במשך 6 דקות (מוגדר כ-שלב 2 בפרוטוקול ברוס), מבחן מאמץ חיובי לפני השלמת שלב 2 כאמור או צניחת ST משמעותית או ארוכה (הנמשכת מעל 5 דקות), התפתחות של הפרעת קצב חדרית תוך כדי מבחן מאמץ, התהוות אזורים גדולים של איסכמיה במיפוי לבבי וירידה במקטע הפליטה במהלך ביצוע אקוקרדיוגרפיה. צנתור לב המדגים עליה בלחץ החדרי בסוף הדיאסטולה ועליה בנפח החדרי, כמו גם ירידה במקטע הפליטה, מצביעים כולם על בעיה בתפקוד החדר השמאלי ועל פרוגנוזה שאינה טובה.
טיפול[עריכת קוד מקור | עריכה]
הטיפול בתעוקת לב מתחלק לשינוי באורחות חיים (ביצוע פעילות גופנית מותאמת, הפסקת עישון ודיאטה), מניעה או הפחתה של גורמי סיכון (למשל טיפול בדיסליפידמיה, הורדת לחץ דם וכדומה) וטיפול בתסמינים עצמם.
מטרת הטיפול בתסמינים היא להגביר את אספקת החמצן לשריר הלב (על ידי חומרים מרחיבי כלי דם כמו ניטרטים למשל, או על ידי ניתוח מעקפים, צנתור וכו'), או לחלופין, להוריד את דרישת החמצן של שריר הלב על ידי הורדת פעילות הלב, כגון מתן חוסמי בטא וחוסמי תעלות סידן. גורם מרכזי המשפיע על דרישות החמצן הוא המכפלה הכפולה: המכפלה של קצב הלב בלחץ הדם הסיסטולי, ומטרת הטיפול היא להוריד מכפלה זו.
ניטרטים – תרופות אשר משמשות הן לכאב חריף והן לטיפול מונע. ניטרוגליצרין הוא תרופה ניטרטית המקובלת בטיפול במקרים של תעוקת לב. הניטרטים משחררים חנקן חמצני אשר מרחיב כלי דם, מביאים לפתיחה של תעלות אשלגן (גורם להיפרפולריזציה והרפיה) ובנוסף מעכבים את כניסת הסידן לתאים. ניטרטים מביאים להרחבה מהירה וחדה של כלי הדם, ולכן הם מועדפים בטיפול חריף. ההשפעות הקליניות של שימוש בניטרטים הן הרפיה בוורידים ובעורקיקים, אשר מביאים לירידה בלחץ הדם, בעומס שלפני הלב ובעומס שאחריו. כתוצאה מכך דרישות החמצן יורדות. תופעות הלוואי הן טכיקרדיה רפלקסיבית כתוצאה מהירידה בלחץ הדם ואפקט אינוטרופי חיובי, כלומר הגברת יכולת ההתכווצות. תופעות לוואי נוספות הן תת-לחץ דם תנוחתי וכאב ראש. ישנה התוויית נגד לשילוב ניטרטים יחד עם מתן ויאגרה, עקב הסכנה להורדת לחץ דם משמעותית. דוגמאות לניטרטים: ניטרוגליצרין, איזוסורביד דיניטראט ואיזוסורביד מונוניטרט.
חוסמי תעלות סידן תלויות מתח – תרופות מקבוצה זו חוסמות את תעלת הסידן מסוג L-type. כתוצאה מכך, חלה ירידה בכניסת הסידן לשריר, ולכן עוצמת ההתכווצות בלב תרד, ואילו כלי הדם יתרחבו. לרוב נהוג לטפל בחוסמי תעלות סידן במקרים של טיפול ממושך בתעוקת לב קלאסית או מעווית כלי הדם, מצבים של יתר לחץ דם כרוני ולאחר אוטם של שריר הלב. לא נהוג לתת תרופות מסוג זה במקרים חריפים, והן עלולות להיות מסוכנות במקרים של אי-ספיקת לב. מאחר שחוסמי בטא הראו עלייה בתוחלת החיים לאחר אוטם לבבי וחוסמי תעלות סידן לא הדגימו עלייה כאמור, מועדף הטיפול בחוסמי בטא אצל מטופלים עם תעוקת לב ותפקוד פגוע של החדר השמאלי. עם זאת, חוסמי תעלות סידן ניתנים במצבים שבהם אין תגובה מספקת לחוסמי בטא וניטרטים, באי סבילות לתופעות הלוואי של חוסמי בטא (עייפות, דיכאון וירידה בתפקוד המיני), סיפור של אסתמה או מחלת ריאות חסימתית, בעיות הולכה משמעותיות, תעוקת לב מעווית כלי הדם או מחלת כלי דם עורקיים היקפיים.
חוסמי בטא – תרופות אלו מסוגלות להוריד את צריכת החמצן של שריר הלב באמצעות ירידה בפעילותו. חוסמי בטא לא פועלים בדרך של הרחבת כלי דם, אלא על ידי הורדת קצב הלב. משתמשים בהם לאחר אירוע של אוטם שריר הלב, וטיפול בתעוקת חזה לא יציבה. התרופות לא מיועדות לשימוש בתעוקה מעווית כלי הדם. שילוב של חוסמי בטא יחד עם ניטרטים מוביל להורדת לחץ דם (על ידי הניטרטים) ולביטול הטכיקרדיה הרפלקסיבית (על ידי חוסמי בטא).
פותחי תעלות אשלגן – תרופות אלו פותחות תעלת אשלגן ומסייעות במקרים של תעוקת לב כתוצאה מההרפיה הנגרמת לשריר.
טיפול בתעוקת לב על ידי נוגדי קרישה: תעוקת לב נגרמת לרוב כתוצאה מחסימה של עורק על ידי רובד טרשתי, שעליו עלול להתפתח קריש דם, ומכאן שחלק מהתרופות לטיפול הן תרופות אנטי-תרומבוטיות, ומטרתן להמס את הקריש שנוצר בעורקים ולשחזר את זרימת הדם:
- אספירין – חומר המעכב התלכדות טסיות דם, על ידי עיכוב ייצור של פרוסטגלנדינים. אספירין משמש לטיפול כרוני בחולי תעוקת לב, וגם לטיפול באוטם חריף של שריר הלב או כמעקב לאחר ניתוחי מעקפים. טיפול באספירין על בסיס יומי הראה ירידה באירועים כליליים אצל מטופלים הסובלים מתעוקה כרונית ואצל מטופלים לאחר אוטם לבבי, כמו גם אצל גברים מעל גיל 50, ללא תסמינים כלשהם.
- קלופידוגרל – תרופה מקבוצת נוגדי התלכדות הטסיות אשר פועלת על הרצפטור P2Y12 ADP ומונעת התלכדות של טסיות. קלופידוגרל הראתה תוצאות דומות לאלו של מתן אספירין, וניתן לתת קלופידוגרל לחולים הסובלים מתופעות לוואי הקשורות בנטילת אספירין, כגון אלרגיה, דימום מדרכי העיכול או דיספפסיה (חוסר נוחות בטנית). כיום מקובל לתת טיפול משולב של קלופידוגרל ואספירין למשך שנה אצל חולים שעברו צנתור אשר כלל השמת תומכן, אולם לא נמצא יתרון ממתן משולב של אספירין וקלופידוגרל אצל חולים אשר סובלים מתעוקת לב כרונית יציבה.
טיפול על ידי מעכבי ACE הוכח כיעיל אצל חולים עם מחלת לב איסכמית הנמצאים בסיכון גבוה, למשל כאלו הסובלים גם מסוכרת, בעיה בתפקוד החדר השמאלי או בעיה בשליטה על לחץ הדם או על רמות הכולסטרול (תחת טיפול בסטטינים ותרופות להורדת לחץ דם). עם זאת, לא הוכח כי מתן תרופות אלו לחולים ללא סיכון מוגבר אכן מפחיתה אירועים כליליים.
אצל חולים הממשיכים להציג תסמיני תעוקה, ולא מגיבים לטיפול המקובל, ניתן לשקול מתן טיפולים חדשים כגון רנולזין, אשר פועלת ככל הנראה על ידי חסימה של תעלות סידן מסוג late inward. ישנה התוויית נגד למתן תרופה זו במצבים של בעיות תפקוד של הכבד או אצל חולים הנוטלים תרופות אשר מאריכות את מקטע QT.
טיפול על ידי צנתור[עריכת קוד מקור | עריכה]
טיפול על ידי צנתור כלילי נשקל במצבים בהם התסמינים לא נעלמים, יש בעיה בתפקוד החדר השמאלי, אין תגובה טובה לתרופות או שיש איסכמיה חריפה. הצנתור נעשה באמצעות החדרת צנתר המלווה בבלון ובהנחת תומכן כדי לפתוח את העורק החסום. ההחלטה בין ניתוח מעקפים לבין צנתור קשורה למידת החסימה ומיקומה, וכן מספר כלי הדם המעורבים. כיום נהוג כי חולים אשר מציגים חסימה של שלושה כלי דם לפחות, או חסימה של העורק הכלילי השמאלי הראשי, במיוחד חולים הסובלים בנוסף מסוכרת וכן מתפקוד לקוי של החדר השמאלי, הם חולים המועמדים לניתוח מעקפים, בעוד שחולים המציגים תמונה קלה יותר יכולים לעבור צנתור לבבי. חשוב לציין כי אצל חולים הסובלים מתעוקת לב יציבה, לא הוכח כי טיפול באמצעות צנתור הראה עדיפות על פני טיפול אופטימלי תרופתי, כלומר לא מפחית את שיעור המוות או האוטם הלבבי. זאת לעומת חולים עם תעוקת לב לא יציבה, אשר צנתור אצלם הדגים שיפור בתוצאה הכוללת. עד כה דווחה הצלחה בפתיחת העורקים החסומים בכ-95% מן המקרים, אולם חסימה מחודשת מתרחשת בתוך חצי שנה אצל כ-20% מהמקרים (ותסמינים תעוקתיים יהיו אצל כ־10%). כיום השימוש בתומכנים המשחררים תרופה (drug eluting stent) הביא לירידה של מתחת ל-10% בסיכון להיצרות מחודשת של העורקים (restenosis). על מנת להפחית את הסיכון להיווצרות קריש על גבי התומכן מומלץ טיפול באספירין במשך לפחות שנה לאחר הצנתור.
מנגנון התכווצות שריר הלב[עריכת קוד מקור | עריכה]
לאחר יצירה של פוטנציאל פעולה בשריר, נכנס אליו סידן דרך תעלות סידן תלויות מתח. הסידן אשר נכנס לא מביא לכיווץ שריר הלב, אולם הוא נקשר לרצפטור שעל דופן הרשתית הסרקופלזמית, ובפרט הקולטן לריאנודין. הקישור לקולטן מביא לפתיחת המאגר ולשחרור של רמות סידן גבוהות לציטופלזמה של תא השריר. הסידן נקשר לטרופונין, וחלה אינטראקציה בין מיוזין לאקטין אשר מביאה לכיווץ השריר. ישנם מספר גורמי בקרה על רמות הסידן בשריר: ריבוי של סידן עלול להביא להפרעות קצב, ולכן קיימים מספר גורמים מווסתים אשר משפיעים על כמות הסידן: משאבת הסידן, משחלף נתרן/סידן, משאבת SERCA אשר מכניסה סידן בחזרה למאגרים, וחלבון בשם פוספולמבן (phospholamban) אשר עושה את הפעולה ההפוכה של SERCA – מעכב את פעילותה כדי לאפשר נוכחות של סידן במהלך הסיסטולה (התכווצות ארוכה). הגברת עוצמת הכיווץ מתבצעת על ידי המערכת הסימפתטית, אשר מביאה לקישור של נוראדרנלין ואדרנלין לקולטנים שלהם ולעלייה ברמות הסידן בציטופלזמה (ומניעת חזרתו למאגרים). מכאן, שעל מנת להקטין את עוצמת הכיווץ יש לתת תרופות אשר חוסמות את הקולטנים הסימפתטיים (חוסמי בטא) או לחלופין תרופות אשר מעכבות את תעלות הסידן. כדי ליצור הרפיה של כלי הדם, ניתן להשתמש בניטרטים או בניטריטים אשר מרחיבים את כלי הדם.
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- תעוקת לב, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ E. Duh, M. Feinglos, Hypoglycemia-induced angina pectoris in a patient with diabetes mellitus, Annals of Internal Medicine 121, 1994-12-15, עמ' 945–946
- ^ Birke Schneider, Anastasios Athanasiadis, Claudia Stöllberger, Wolfgang Pistner, Gender differences in the manifestation of tako-tsubo cardiomyopathy, International Journal of Cardiology 166, 2013-07-01, עמ' 584–588 doi: 10.1016/j.ijcard.2011.11.027
- ^ Benjamin Longo-Mbenza, Jacqueline Nkondi Nsenga, Etienne Mokondjimobe, Thierry Gombet, Helicobacter pylori infection is identified as a cardiovascular risk factor in Central Africans, Vascular Health and Risk Management 6, 2012, עמ' 455–461 doi: 10.2147/VHRM.S28680
- ^ Cristina Chimenti, Patrizio Sale, Romina Verardo, Stefania Cicalini, High prevalence of intramural coronary infection in patients with drug-resistant cardiac syndrome X: comparison with chronic stable angina and normal controls, Heart (British Cardiac Society) 96, December 2010, עמ' 1926–1931 doi: 10.1136/hrt.2010.196626
- ^ Jae-Hong Lee, Jin-Young Oh, Tae-Mi Youk, Seong-Nyum Jeong, Association between periodontal disease and non-communicable diseases: A 12-year longitudinal health-examinee cohort study in South Korea, Medicine 96, June 2017, עמ' e7398 doi: 10.1097/MD.0000000000007398
- ^ Kathryn Buchanan Keller, Louis Lemberg, Prinzmetal's angina, American Journal of Critical Care: An Official Publication, American Association of Critical-Care Nurses 13, July 2004, עמ' 350–354
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
