אצטאלדהיד
 | |
| מולקולת אצטאלדהיד | |
 | |
| שם סיסטמטי | Ethanal |
|---|---|
| שמות נוספים | Ethyl aldehyde ,Acetic aldehyde |
| כתיב כימי |
C₂H₄O |
| מסה מולרית | 44.05 גרם/מול |
| מראה | נוזל שקוף |
| מספר CAS | 75-07-0 |
| צפיפות | 0.784 גרם/סמ"ק |
| מצב צבירה | נוזל |
| מסיסות | מסיס במים |
| ממסים | אתנול, אצטון, בנזן, טולואן, קסילן, טרפנטין |
| טמפרטורת היתוך |
123.37- °C -149.78 K |
| טמפרטורת רתיחה |
20.2 °C 293.35 K |
| מקדם שבירה | 1.3316 |
| חומציות | 13.57 |
| נקודת הבזק |
39- °C -234.15 K |
| אנתלפיית התהוות סטנדרטית | −166 קילוג'ול למול |
| LD50 | 1930 מ"ג לק"ג |
| NFPA 704 | |
אצטאלדהיד (במונחון IUPAC: Ethanal, אֶתַנַל) הוא תרכובת כימית שנוסחתה C2H4O,זהו אלדהיד חשוב הנפוץ בטבע ומיוצר בכמויות גדולות בתעשייה. אצטאלדהיד מיוצר בצמחים, מצוי במזונות כלחם, קפה ופירות. אצטאלדהיד הוא תוצר של חמצון חלקי של אתנול בכבד על ידי האנזים אלכוהול דהידרוגנז ועליית ריכוזו בדם היא מהגורמים לחמרמורת.
ייצור[עריכת קוד מקור | עריכה]
דרך הייצור העיקרית של אצטאלדהיד היא בתהליך Wacker חמצון אתן בקטליזה הומוגנית של פלדיום ונחושת
המעגל הקטליטי שבו נוצר אצטאלדהיד ומשתחזרים הזרזים
לייצור בקנה מידה קטן יותר משתמשים גם בחמצון חלקי של אתנול בקטליזה של כסף בתהליך אקסותרמי בטמפרטרות של 500-650°C
בעבר יוצר החומר על ידי דהידרוגנציה (הוצאת מימן) מאתנול בתהליך אנדותרמי
היסטוריה[עריכת קוד מקור | עריכה]
הצעה ראשונה לייצור אצטאלדהיד מאצטילן מיוחסת לפרסום של קושצרוף (Kuscheroff) משנת 1884[1]. בשנת 1898 הציע הוגו ארדמן שיטה לייצור תעשייתי של אצטאלדהיד מאצטילן על ידי העברת האצטילן דרך חומצה גופרתית רותחת בריכוז של כ-45% מעורבב בחומצת כספית. לשיטה זאת הייתה נצילות נמוכה של כ-5%. נתן גרינשטיין זיהה שיש קשר הפוך בין הטמפרטורה הרצויה בתהליך לבין ריכוז החומצה, כאשר ככל שהריכוז יותר גבוה יש להשתמש בטמפרטורה נמוכה יותר. בתחילת 1910 הוא הגיש פטנט בו הציע להעביר את האצטילן דרך חומצה גופרתית בריכוז של כ-45%, אך בטמפרטורה נמוכה של 15–25 מעלות צלזיוס ובלחץ גבוה מהלחץ האטמוספירי, או דרך חומצה זרחתית בריכוז של כ-25%, בו מעורב זרז של מלח כספית, במקום החומצה הגפרתית[2]. חברת Chemische Fabrik Griesheim-Elektron קיבלה את הבעלות על הפטנט וניסתה לייצר אצטאלדהיד בהתאם, אך נתקלה בקשיים רבים וייצור המוני על פי השיטה של גרינשטיין החלה בשנת 1916 ונמשכה כ-50 שנה[1].
כימיה[עריכת קוד מקור | עריכה]
אצטאלדהיד עובר תגובת טאוטמריזציה לתת ויניל אלכוהול
קבוע שיווי המשקל לתגובה הוא 6x10-7 ושינוי האנתלפיה H = 42.7Kj/mol∆ ב-298K כך שבתנאים אלו רק אחוז קטן מאוד מהחומר נמצא בצורת האנול (ויניל אלכוהול). לתגובה יש אנרגיית שפעול גבוהה כך שאינה מתרחשת בטמפרטורת החדר, ניתן לבצע אותה בקטליזה פוטוכימית או בנוכחות חומצות כ HClO4 או H2SO4.

בשל גודלה הקטן של המולקולה וזמינותה כמונומר יבש (בניגוד לפורמלין) משמש החומר כאלקטרופיל בתגובות סינתיזה אורגנית. אצטאלדהיד מגיב עם ציאניד ואמוניה לקבלת חומצת האמינו אלאנין
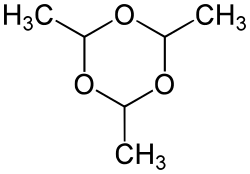
3 מולקולות אצטאלדהיד יכולות להדחס לקבלת פראלדהיד (Paraldehyde) - מולקולה טבעתית המכילה קשרי פחמן-חמצן יחידים
שימושים[עריכת קוד מקור | עריכה]
בעבר שימש אצטאלדהיד בעיקר כחומר גלם לייצור חומצה אצטית. יישום זה נמצא בירידה כי ניתן להפיק את החומצה ביעילות גבוהה יותר ממתנול. אצטאלדהיד הוא חומר מוצא חשוב לנגזרות של פירידין. משתנן ואצטאלדהיד מייצרים שרפים שימושיים. מאנהידריד אצטי ואמטאלדהיד מייצרים אתילדיאן דיאצטט ממנו מפיקים ויניל אצטט - המונומר לייצור פוליויניל אצטט.
בטיחות[עריכת קוד מקור | עריכה]
אצטאלדהיד רעיל בריכוזים גבוהים, חשוד כמסרטן וגורם לגירוי בעיניים ובריריות דרכי הנשימה. רמת החשיפה המרבית המותרת לעובדים היא 25ppm. חשיפה לריכוזים שמעל 1,000ppm מתבטאת בבחילה, הקאה וכאבי ראש.
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- גיליון בטיחות חומרים של אצטאלדהיד
- נתונים כימיים נוספים על אצטאלדהיד
- אצטאלדהיד, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ 1 2 Bruno Waeser, The atmospheric nitrogen industry, 1926, page 38
- ^ פטנט ארצות הברית 1044169, תאריך הגשה: 23 בינואר 1911, אתר גוגל פטנטים



![{\displaystyle C_{2}H_{4}+[PdCl_{4}]^{2-}+H_{2}O\Rightarrow CH_{3}CHO+Pd+2HCl+2Cl^{-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47ac104f35c1d9d44a0c54acb6a4606001dce628)
![{\displaystyle 2CuCl_{2}+Pd+2Cl^{-}\Rightarrow 2CuCl+[PdCl_{4}]^{2-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b040c4e6b99d5cb58a70e8f90eb66ba35e9e6555)



