בדיקת ביופסיה של בלוטת הזקיף
בדיקת ביופסיה של בלוטת הזקיף (קשרית הזקיף) הלימפתית בבית השחי בקרב חולות בסרטן השד היא החלק מההליך הניתוחי של ניתוח כריתת שד. מטרתה העיקרית של בדיקה זו היא זיהוי של הבלוטות הראשונות בשרשרת הריכוז הלימפטי של בית השחי, במטרה לקבוע את שלב המחלה (staging) כמדד המשפיע על הפרוגנוזה של המטופלת[1] וכקריטריון להמשך טיפול.
ההחלטה על היקף ניתוח הוצאת הבלוטות בתלוי בין היתר בהמצאות תאים סרטניים בבלוטת הזקיף. אם נמצאו תאים סרטניים יכרתו גם קשריות הלימפה הבאות לפי שיקול דעתו של הרופא.[2] כאשר לא נמצאים תאים סרטניים בקשרית הזקיף, הסיכוי שימצאו תאים סרטניים קשריות אחרות בסביבתה הוא זניח. במקרה של העדר תאים סרטניים בקשרית הזקיף הטיפול צפוי להיות יותר שמרני עם סיכויי הצלחה גבוהים יותר כתוצאה מאי כריתה של קשריות לימפה מרובות.[3]
קשרית הזקיף[עריכת קוד מקור | עריכה]

קשרית הזקיף(אנ') מכונה גם בלוטת הזקיף, היא כינוי לקשרית או קשרי הלימפה הראשונים אליהם יתנקזו תאים סרטניים במקרה של גידול.[4] הקשרית היא חלק ממערכת הלימפה, המהווה גורם משמעותי בהגנה על הגוף מפני גורמים מסכנים ופועלת כרשת של צינורות וקשרים במקביל למערכת הדם לאורך הגוף כולו.
קשרי הלימפה אחראיים על סינון הנוזל הלימפתי והם מצויים באזורים שונים של הגוף.
בספרות הם מכונים לעיתים בלוטות לימפה, אולם בניגוד לבלוטה כהגדרתה הקשרים אינם מפרישים חומרים אלא מהווים מעין מסננת.
במקרה של סרטן השד קשרית הזקיף תמצא בדרך כלל באזור בתי השחי של המטופלת (בהתאמה לצד בו נמצא הגידול).
תהליך התפשטות הגידול[עריכת קוד מקור | עריכה]
במרבית המקרים של סרטן השד כאשר התאים הסרטניים ניתקים מהגידול הראשוני באזור השד, הם נעים לתוך המערכת הלימפתית כחלק מתהליך שליחת הגרורות. ברוב המקרים, החדירה של התאים הסרטניים לקשרית הזקיף מתרחשת לפני החדירה שלהם למערכת הדם ומשם לאיברים נוספים. זאת ככל הנראה מפני שלכלי הדם יש שכבת ממברנה בזאלית עבה יותר, אותה התאים מתקשים יותר לחדור. מחקרים נוספים מרמזים על כך שסביבת קשרי הלימפה מהווה קרקע נוחה להתרבות התאים הסרטניים והשתרשותם.[5]
הליך הניתוח[עריכת קוד מקור | עריכה]
בשלב הראשון של כל ניתוח לסרטן שד מוקדם תוסר בלוטת הזקיף ותשלח לבדיקת פתולוג אשר יכול להעריך בזמן אמת המצאות של תאים סרטניים בבלוטה ע״י בדיקת חתך קפוא או ציטולוגיה.
על מנת לאתר את מיקומן המדויק של בלוטות הזקיף, נעשה שימוש בשתי שיטות מקובלות לצורך מיפוי:
שימוש בצבע - הזרקת צבע (Lymphozorin, Isosulfan blue) לאזור שסביב הגידול. לאחר כ-15–20 דקות, הצבע יתנקז אל בלוטות הזקיף, והמנתח יוכל לזהות את הבלוטות ולהסירן.
הזרקה של חומר רדיו אקטיבי (קולואיד מסומן בטכנציום) - מוזרק כשעתיים עד 24 שעות לפני תחילת הניתוח. המנתח יבדוק באמצעות מונה גייגר מאין נפלטת הכמות הגבוהה ביותר של קרינה. אזור הקרינה המרבי יעיד לרוב על הימצאותה של בלוטת הזקיף.

כיום, הגישה המקובלת היא שימוש בשתי השיטות בו זמנית במטרה להגדיל את שיעור הזיהוי של בלוטות הזקיף ולמזער את הפגיעה במטופלת (פולשניות הניתוח).
קיימת גם הגישה הסלקטיבית בה יוזרק בשלב הראשון החומר הרדיואקטיבי, ובחדר ניתוח רק אם הקריאות הרדיואקטיביות אינן טובות - הוספת חומר צבע. יתרון שיטה זו בהפחתת החשיפה של המטופלת לתופעות של אלרגיות כתוצאה מהזרקת הצבע ושדה ניתוח נקי וברור יותר.
מונה גייגר[עריכת קוד מקור | עריכה]
גלאי המורכב משפופרת גלילית (מכונה Probe) אשר במרכזה עובר תיל דק מאוד המשמש כאנודה (הדק טעון חיובית אשר מושך חלקיקים טעונים שלילית), דפנות השפופרת מצופים מתכת ומשמשים כקתודה (הדק טעון שלילית אשר מושך חלקיקים טעונים חיובית).[6]
האנודה מצויה במתח חיובי גבוה (500V) ביחס לקתודה. השפופרת עצמה מכילה גז אציל כמו ארגון או תערובת של ארגון וגז מתאן בלחץ נמוך.
עקרון הפעולה של השפופרת: חלקיק של קרינה גרעינית חודר לשפופרת, פוגע באטומי הגז שבה ומיינן את אטומי הגז. בשפופרת נוצר יון חיובי הנע אל הקתודה, ואלקטרון שלילי שנתלש מהאטום ונע אל האנודה.
השדה החשמלי בסביבת התיל הדק הוא חזק ולכן האלקטרון מאיץ בדרכו אל האנודה ובדרך מיינן אטומים נוספים (יינון משני), כל האלקטרונים החופשיים נמשכים אל האנודה ובהגיעם אליה נוצר פולס של זרם חשמלי.[7]
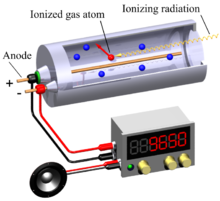
כל פולס מציין את הגעתו של חלקיק קרינה אחד אל הגלאי.
מערכת אלקטרונית המחוברת לגלאי, מזהה את הפולס ומונה את מספר החלקיקים.
תהליך המדידה של תנועת האלקטרונים ואיסופם על ידי האנודה הוא מהיר מאוד כך שניתן למדוד עד 500 חלקיקים בשנייה מבלי שתהיה חפיפה בין הפולסים שנגרמו מחלקיקים שונים. אם לא יתבצע יינון משני (בתוך המיכל) הפולס של הזרם החשמלי יהיה חלש מידי ולא יורגש על ידי המערכת.
יעילות הגלאי במקרה של קרינת α או β היא בקירוב 100% מכיוון שכאשר חלקיקים אלו עוברים בגז הם גורמים בסבירות גבוהה ליינון ולכן נמנים על ידי הגלאי. במקרה של קרינת γ, הפוטונים עלולים לעבור דרך הגז מבלי ליינן את האטומים ולמעשה לא יורגשו על ידי הגלאי, רק חלק קטן מן הפוטונים מבצע אינטראקציה עם הגלאי וגורם ליינון. יעילות הגלאי עבור קרינת γ היא בסביבות 1%.[8]
המשך הטיפול וסיכונים אפשריים[עריכת קוד מקור | עריכה]
לאחר בדיקת בלוטת הזקיף ימשיך המנתח להוצאת הגידול המרכזי ולכריתת שד חלקית או מלאה.
המנתח ייטה להמליץ על כריתת שד מלאה כשהגידול הוא רב מוקדי (נמצא בכמה מוקדים שונים), ואילו על כריתה חלקית עם טיפול משלים של הקרנה במקרה ומדובר בגידול קטן עם גבולות ברורים או לפי בקשת המטופלת.
הסיכונים האפשריים כוללים כמו בכל ניתוח דימום או זיהום. בנוסף במקרים נדירים קיימת סכנה לרגישות לחומר הניגוד או הצבע.
אם הייתה כריתת קשריות לימפה נוספות תיתכן פגיעה בעצבים תחושתיים או מוטוריים באותו אזור וכן ללימפאדמה בעתיד, הסבירות לפגיעה עולה ככל שייכרתו יותר קשריות.
ראו גם[עריכת קוד מקור | עריכה]
קישורים חיצוניים[עריכת קוד מקור | עריכה]
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ International (Ludwig) Breast Cancer Study Group. Prognostic importance of occult axillary lymph node micrometastases from breast cancers, lancet 1990;335: 1565-8
- ^ A E Giuliano, D M Kirgan, J M Guenther, D L Morton, Lymphatic mapping and sentinel lymphadenectomy for breast cancer., Annals of Surgery 220, 1994-09, עמ' 391–401
- ^ Sentinel Lymph Node Biopsy - National Cancer Institute, www.cancer.gov, 2019-08-16 (באנגלית)
- ^ J. J. Albertini, G. H. Lyman, C. Cox, T. Yeatman, Lymphatic mapping and sentinel node biopsy in the patient with breast cancer, JAMA 276, 1996-12-11, עמ' 1818–1822
- ^ Ethel R. Pereira, Dennis Jones, Keehoon Jung, Timothy P. Padera, The lymph node microenvironment and its role in the progression of metastatic cancer, Seminars in Cell & Developmental Biology, Blood-Brain Barrier in Health and Disease & Lymphatic vessels in health and disease 38, 2015-02-01, עמ' 98–105 doi: 10.1016/j.semcdb.2015.01.008
- ^ Ernest Rutherford and H Geiger, An electrical method of counting the number of α-particles from radio-active substances, Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character 81, 1908-08-27, עמ' 141–161 doi: 10.1098/rspa.1908.0065
- ^ Encyclopedic dictionary of condensed matter physics. Volume 1, A-M, 1st ed, Amsterdam: Elsevier, 2004, ISBN 978-0-08-054523-3
- ^ Knoll, Glenn F., Radiation detection and measurement, 3rd ed, New York: Wiley, 2000, ISBN 0-471-07338-5
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
