ציטראט סינתאז
| CS | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| מזהים | |||||||||||||||||||||||||
| שמות נוספים | CS, citrate synthase | ||||||||||||||||||||||||
| מזהים חיצוניים | OMIM: 118950 MGI: 88529 HomoloGene: 56073 GeneCards: CS | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| אורתולוגים | |||||||||||||||||||||||||
| מינים | אדם | עכבר | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ensembl | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (mRNA) | |||||||||||||||||||||||||
| RefSeq (חלבון) | |||||||||||||||||||||||||
| מיקום (UCSC) | Chr 12: 56.27 – 56.3 Mb | Chr 10: 128.17 – 128.2 Mb | |||||||||||||||||||||||
| חיפוש PubMed | [3] | [4] | |||||||||||||||||||||||
| ויקינתונים | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
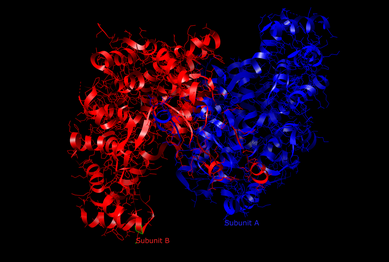
ציטראט סינתאז (Citrate synthase; E.C. 2.3.3.1)[5] הוא אנזים המצוי כמעט בכל התאים החיים,[6] ומתפקד כאנזים קובע קצב בשלב הראשון של מעגל קרבס. מסלול ביוכימי זה הוא אחד מהמסלולים המרכזיים של תהליך הנשימה התאית, ומשמש ליצירת מולקולות מחוזרות שמשמשות בשרשרת מעבר האלקטרונים של הזרחון החמצוני להפקת כמות גדולה של ATP. בנוסף, מסלול זה הוא מקור לתוצרי ביניים (מטבוליטים) לביוסינתיזה.[7] ציטראט סינתאז ממוקם בתאים אוקריוטיים במטריקס של המיטוכונדריה, אך הוא מקודד על ידי דנ"א גרעיני ולא על ידי הדנ"א המיטוכונדריאלי. סינתזת האנזים מתרחשת על ידי ריבוזומים ציטופלזמיים ולאחר מכן הוא מועבר למטריקס של המיטוכונדריה. אצל בני אדם, האנזים מקודד מהגן gltA המצוי בכרומוזום 12.[8]
קיימים 2 סוגים של ציטראט סינתאז: ציטראט סינתאז המצוי אצל בעלי חיים, צמחים, פטריות, ארכיאה וחיידקים גראם-חיוביים, היוצר דימר של 2 תתי יחידות זהות בעלות מסה מולקולרית כוללת של kDa 100; לעומתו, ציטראט סינתאז המצוי אצל אצות וחיידקים גראם-שליליים הוא גדול בהרבה ומורכב מ-6 תתי יחידות זהות (כל אחת kDa 50).[9]
מבנה[עריכת קוד מקור | עריכה]
ציטראט סינתאז המופק מלב חזיר והנחקר ביותר מורכב מ-437 חומצות אמינו, המאורגנים ל-2 תת-יחידות, אשר כל אחת מהן מורכבת מ-20 סלילי אלפא. כל תת-יחידה מורכבת מ-2 דומיינים, גדול וקטן; כמו כן, לכל תת-יחידה יש אתר פעיל עם אתר קשירה אחד לאוקסלואצטט או לאצטיל קואנזים A, המצוי ב"חריץ" שבין שני הדומיינים. סלילי האלפא מסומנים באותיות A עד T, כאשר הדומיין הגדול של כל תת-יחידה מורכב מסלילי האלפא A-M ו-S-T, ואילו תת-הדומיין הקטן של כל תת-יחידה מורכב מסלילי האלפא N-R.[10]
| הרכב חומצות האמינו בציטראט סינתאז (ב-%)[11] | |||
|---|---|---|---|
| חומצת אמינו | חזיר | יונה | עש |
| ליזין | 5.9 | 6.7 | 8.9 |
| היסטידין | 3.3 | 2.6 | 2.6 |
| ארגינין | 4.3 | 5 | 3.7 |
| אספרטט | 9.3 | 10.2 | 9.8 |
| תראונין | 5.5 | 4.9 | 4.9 |
| סרין | 6.5 | 5.1 | 5.5 |
| גלוטמט | 10 | 10 | 10.6 |
| פרולין | 5.7 | 4.9 | 6 |
| גליצין | 8 | 8.5 | 8 |
| אלנין | 8.4 | 9.9 | 8.1 |
| ואלין | 6.4 | 7.5 | 7.8 |
| מתיונין | 3.4 | 3.3 | 2.2 |
| איזולאוצין | 4.4 | 6 | 4.6 |
| לאוצין | 11.9 | 9.3 | 10.2 |
| טירוזין | 4.2 | 2.7 | 3.6 |
| פנילאלנין | 3 | 3.4 | 3.5 |
סלילי האלפא מורכבים מלמעלה מ-75% משיירי חומצות האמינו באנזים, ומדידה באמצעות דיכרואיות מעגלית (CD) מצביעה על כך שהם מהווים בין 40% ל-60% מהמבנים השניוניים של האנזים;[10] למעשה, ציטראט סינתאז הוא האנזים הראשון שנתגלה ולו מבנה שניוני המורכב כמעט רק מסלילי אלפא.[12] יתר חומצות האמינו מרכיבות מבנים בלתי רגילים מוארכים אחרים, מלבד 13 שיירים המרכיבים משטח בטא קטן המקשר בין סליל אלפא C לאחד מהמבנים המוארכים וממוקם בפני השטח של החלבון. ארבעה זוגות אנטי-מקבילים של סלילי אלפא מחברים בין 2 תתי היחידות, ויוצרים מעין "סנדוויץ'" של 8 סלילי אלפא מפותלים, המזכיר משטח בטא.[10]
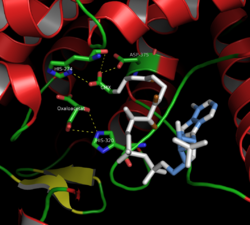
בחריץ שבין 2 תתי היחידות נמצא האתר הפעיל של האנזים, ובו 2 אתרי קשירה - האחד לציטראט או לאוקסלואצטט והשני לקואנזים A. האתר הפעיל מורכב מ-3 שיירים החיוניים לפעילותו (2 שיירי היסטידין ושייר אספרטט אחד; "שלשה קטליטית") - His274 בדומיין הגדול, ו-His320 ו-Asp375 בדומיין הקטן, להם סלקטיביות גבוהה באינטראקציות עם סובסטרטים. נמצא כי כאשר השייר His274 הוחלף בחומצות אמינו אחרות, האנזים היה בכל זאת פעיל, אם כי חל צמצום של כפי אלף בפעילותו. לעומת זאת, כאשר הוחלף השייר Asp375 בכל חומצת אמינו אחרת מלבד חומצה גלוטמית, האנזים לא היה פעיל כלל.[13]
ציטראט סינתאז מסוגל לעבור שינויים קונפורמציונליים גדולים, ומוגדר כ"דוגמה קלאסית" למודל ההתאמה המושרית של קושלנד.[14] האנזים מגיב לקשירה של הסובסטרטים ושל קואנזים A בתנועה של הדומיינים ובשינוי בארגון של חלק מהשיריים הפנימיים. למעשה, האנזים יכול לנוע בין 2 צורות עיקריות - סגור ופתוח. בצורה הסגורה, השיירים הקטליטיים שבאתר הפעיל המשמשות כליגנדים שקועים בתוך החריץ שבין הדומיינים, באופן שמצד אחד הוא אידיאלי לפעילות הקטליטית של האנזים (שכן מאפשר סביבה מבודדת מממס בעלת ספציפיות גבוהה) ומצד שני באופן שאינו מאפשר כניסה/שחרור של הסובסטרטים שלהם. בצורה הפתוחה, לעומת זאת, המולקולה נמצאת במצב המאפשר קשירה של סובסטרטים. צורה שלישית באה לידי ביטוי לאחר קשירת האוקסלואצטט; בצורה זו האתר הפעיל אינו לחלוטין במצב הסגור, מאחר שהשיירים Arg329, His320 ו-Asp375 נעים בין 0.8 ל-1.3 אנגסטרום מעמדותיהם, באופן המאפשר את שלב ההידרוליזה בזמן המתאים לאחר שלב הדחיסה (ראו בפרק המנגנון).[15]
בעת השינוי הקונפורמציוני בין הצורה הפתוחה לסגורה מתרחשת תנועת סיבוב (רוטציה) של 19° על ידי הדומיין הקטן ביחס לדומיין הגדול, באופן שהדומיין הקטן של תת-יחידה אחת יוצר אינטראקציה עם הדומיין הגדול של תת-היחידה השנייה, וכן חלים שינויים באריזה של השיירים בפנים הדומיין הקטן.[16] קוטיה ולאסק הציעו מנגנון של סדרת תנועות מוכוונות בין סלילי אלפא סמוכים כהסבר לשינוי הקונפורמציוני באנזים.[17]
אצל הארכיאון התרמופילי Pyrococcus furiosus בעל הטמפרטורה האופטימלית של 100°, הליבה מכילה כמות גדולה של איזולאוצין כך שנוצרים צברים, לעומת ליבת החלבון אצל ציטראט סינתאז המופק מחזיר; בנוסף, מספר החללים הפנימיים (internal cavities) במצב הפתוח של האנזים אצל Pyrococcus furiosus נמוך יותר, וכן הלולאות המחברות בין חלק מסלילי האלפא קצרות יותר בחלק מהמקרים. עוד נמצא שוני מהותי באופן הקיפול של הקצה הקרבוקסילי של המונומר האחד על פני השטח של המונומר השני, לעומת האנזים שהופק מהחזיר. מסתבר שמאפיינים אלו תורמים לקומפקטיות של החלבון ולקישור הדוק יותר של תת-היחידות, דבר המאפשר לציטראט סינתאז בארכיאון זה להישאר פעיל ומקופל גם בטמפרטורות גבוהות. לעומת זאת, אופן הקשירה באתר הפעיל היה בעל מאפיינים דומים אצל 2 האנזימים, ומעבר לכך - חלה גם אקוויוולנטיות מבנית של השיירים הקטליטיים באתר הפעיל ומיקומם אף היה זהה, דבר המעיד על מנגנון קשירה זהה.[18]
מנגנון[עריכת קוד מקור | עריכה]

|

|
|
| מימין לשמאל: חומצה ציטרית, אוקסלואצטט ואצטיל קואנזים A. | ||

ציטראט סינתאז הוא בין האנזימים הספורים היכולים ליצור באופן ישיר קשר פחמן-פחמן בהיעדרם של יוני מתכת המשמשים כקו-פקטורים.[19]
ציטראט סינתאז מקטלז את תגובת הדחיסה של שייר האצטט בעל 2 הפחמנים ממולקולת האצטיל קואנזים A עם מולקולת אוקסלואצטט בעלת 4 פחמנים, ליצירת ציטראט בעל 6 פחמנים. משוואת התגובה היא:
הסביבה של הציטראט והאוקסלואצטט (בתוך האנזים) ראויה לציון, משום שהם מוקפים לחלוטין (ובשלושה ממדים) במולקולות פולריות וטעונות. הסובסטרט, בין אם זה אוקסלואצטט או ציטראט, יוצר קשרי מימן או גשרי מלח עם שלושה שיירי ארגינין (329, 401 ו-421) ועם שני שיירי היסטידין (238 ו-320). גם His274 נוכח, ויוצר קשר מימן עם מולקולת חמצן (O-3) של הציטראט. אמנם המטען המדויק בו מוקף הסובסטרט אינו ידוע, אך ברור כי על הסובסטרט להיות מוקף במטען חיובי גדול כך שהאזור שמסביב לפחמן מס' 3 (C-3) של ציטראט או אוקסלואצטט יהיה פולרי במיוחד; דבר זה יגרום למטען חלקי חיובי על פחמן מס' 3, ולרגישות למתקפה נוקליאופילית (ראו בהמשך).[20]
באשר לקואנזים A, קיימים באנזים 3 שיירי ארגינין (164, 324 ו-64) המשמשים כליגנדים עבור שלוש קבוצות הפוספט שלו; ראויה לציון גם כן העובדה, שלבד מאינטראקציות ספציפיות אלו - יתר האינטראקציות בין קואנזים A לציטראט סינתאז נעשות כולן על ידי קשרי מימן בין קואנזים A לשרשרת המרכזית של האנזים ולא על ידי שיירים צדדיים, דבר שאינו נפוץ. מלבד אטום הגופרית המרכיב את קבוצת התיול שלו, אף חלק מקואנזים A לא יוצר קשר עם הסובסטרטים האחרים במהלך הריאקציה.[21]
השיירים המופיעים בשלשה הקטליטית מקטלזים את יצירת הציטראט מאצטיל CoA ומאוקסלואצטט דרך תגובת דחיסה אלדולית.[22] ניתן לחלק את הריאקציה ל-3 שלבים:[23]
- אנוליזיציה
- תגובת דחיסה
- הידרוליזה
בשלב הראשון מתרחשת תגובת אנוליזציה, במהלכה נוצר תוצר ביניים אנול, המכיל קשר כפול בין פחמן אלפא לפחמן בטא (במקום הקשר הכפול של קבוצת הקרבוניל) וכן קבוצת אלכוהול (OHׂׂ). בשלב זה השייר His274 מתפקד כחומצה (קרי: מוסר פרוטון) ואילו השייר Asp375 מתפקד כבסיס (קרי: מקבל פרוטון); אטום החמצן שבקבוצת הקרבוניל של האצטיל קואנזים A עובר פרוטונציה (הוספת פרוטון) על ידי שייר ההיסטידין, בו בזמן שקבוצת המתיל של האצטיל קואנזים A עוברת דה-פרוטונציה (שחרור פרוטון) על ידי שייר האספרטט. באופן זה נוצר תוצר הביניים אנול, שכן המתקפה של האספרטט יוצרת קשר כפול בין פחמן אלפא לפחמן בטא, ואילו הפרוטונוציה שעבר אטום החמצן של הקרובניל יצרה קבוצת הידרוקסיל (ראו באיור משמאל). האנזים למעשה יוצר בשלב זה תוצר ביניים נייטרלי (), מבלי לבזבז אנרגיה וליצור תוצר ביניים בעל מטען כמו אנולט למשל. הגאומטריה של שלב זה מסייעת לכך, שכן מעבר הפרוטון משייר ההיסטידין לאטום החמצן של הקרבוניל מתרחש בקו ישר באמצעות האורביטלים הבלתי קושרים של אטום החמצן ללא הפרעה של קשרי פאי של קבוצות אחרות במולקולה. בנוסף, קשר ה-C-H המשתתף בריאקציה עם שייר האספרטט (תורם את הפרוטון ויוצר קשר כפול) מסודר בצורה אופטימלית באופן שהוא כמעט אנכי לקבוצת האצטיל; כך, כאשר הקשר נשבר, זוג האלקטרונים שנותר על קבוצת האצטיל יכול להיות מצומד לענן אלקטרוני הפאי של הקרבוניל וכך נוצר קשר כפול בין פחמן האלפא לפחמן הבטא.[23]
בשלב השני מתרחשת תגובת דחיסה, ובמהלכה נוצר תוצר הביניים ציטרואיל קואנזים A. בשלב זה השייר His320 הוא המשמש כחומצה, כך שאטום החמצן שבקבוצת הקרבוניל של האוקסלואצטט עובר פרוטונוציה על ידו. כמו בשלב הראשון, גם כאן אטום החמצן נמצא בעמדה מדויקת המאפשרת מעבר בקו ישר של הפרוטון אל האורביטלים הבלתי קושרים שלו. השייר His274 משמש הפעם כבסיס, וחנקן האפסילון שלו תוקף את קבוצת ההידרוקסיל של אצטיל קואנזים A ולוקח בחזרה את הפרוטון שתרם בשלב האנוליזציה באופן שנוצר אנולט; האנולט יוצר התקפה נוקלאופילית על הפחמן הקרבונילי של האוקסלואצטט, אשר בתורו גורם לדה-פרוטונוציה של חנקן האפסילון של His320 (שכאמור משמש בשלב זה כחומצה). כתוצאה מתגובת הסיפוח הנוקליאופילית נוצר תוצר הביניים ציטרואיל קואנזים A.[23]
בשלב השלישי והאחרון של הריאקציה מתרחשת הידרוליזה של קבוצת התיאו-אסטר של ציטרואיל קואנזים A, אם כי הכימיה של שלב זה לא נתבררה די צרכה. על פי שיטה אחת, מולקולת מים עוברת דה-פרוטונציה על ידי מולקולה אחרת המשמשת כבסיס וזהותה לא ברורה, וזוג אלקטרונים בלתי קושרים של אחד מאטומי החמצן של המים יוצר התקפה נוקליאופילית על הפחמן הקרבונילי של ציטרואיל קואנזים A. בה בעת, חנקן האפסילון של His274 תוקף את קבוצת ההידרוקסיל של ציטרואיל קואנזים A ולוקח הפרוטון. מתקבל תוצר ביניים טטראהדרלי, ולבסוף פליטה של מולקולת S-CoA שעוברת פרוטונוציה לאחר מכן והופכת ל-SH-CoA (הצורה הרגילה של קואנזים A, עם קבוצת תיול); האנזים משחרר את התוצר הסופי - ציטראט (שלב 4 בסכימה), ושב למצבו הסגור. שיטה אחרת גורסת כי בשלב זה משתתף השייר Asp375, אשר יוצר קשר אנהידרידי שגורם לשחרור הקואנזים A, ולאחריו מתרחשת הידרוליזה של הקשר האנהידרידי לשחרור ציטראט[24]
על אף שהשלבים האינדיבידואליים בריאקציה בכללותה שונים מאוד אחד מהשני, הקונפורמציה של האנזים זהה בכולן. כלומר, בקונפורמציה אחת בלבד מבצע ציטראט סינתאז קטליזה של כל השלבים השונים בריאקציה, באופן שנדרשים שינויים מינוריים במיקומם של מספר אטומים, רובם של הסובסטרט.[25]
רגולציה ומעכבים[עריכת קוד מקור | עריכה]
נגזרות אדנין[עריכת קוד מקור | עריכה]
ציטראט סינתאז מעוכב כאשר קיימים יחסים גדולים של ATP:ADP ו-NADH:+NAD.
אלפא קטוגלוטראט[עריכת קוד מקור | עריכה]
אלפא קטוגלוטראט בריכוזים גבוהים משמש כמעכב תחרותי לאוקסלואצטט ומעכב לא תחרותי לאצטיל קואנזים A.
בסוף שנות ה-60 גילו חוקרים מאוניברסיטת לסטר כי אלפא קטוגלוטראט מהווה מעכב של ציטראט סינתאז אצל משפחת ה-Enterobacteriaceae המשתייכת לקבוצת החיידקים הגראם-שליליים. אצל חיידקים אחרים, הן גראם שליליים והן חיידקים גראם-חיוביים, וכן אצל אורגניזמים עילאיים יותר, לא מצאו החוקרים כי אלפא קטוגלוטראט מעכב. מניתוח התוצאות הם הסיקו כי כל האורגניזמים בהם לא נמצא עיכוב זה, הם אווירניים, ולעומת זאת כל החיידקים בהם נמצא כי אלפא קטוגלטראט מעכב את ציטראט סינתאז הם אל-אווירניים פקולטטיביים (מסוגלים להתקיים הן בנוכחות חמצן והן בהיעדרו). באורגניזמים אלו החיים בתנאים אל-אווירניים ומייצרים אנרגיה (ATP) באמצעות תסיסה, לציטראט סינתאז בכל זאת נודע תפקיד חשוב של ביוסינתיזה, כיוון שאחד התוצרים המתקבלים במעגל קרבס הוא אלפא קטוגלוטקראט. מחקרים קודמים הראו שתחת תנאים אל-אווירניים כעין אלו, המסלול של מעגל קרבס חדל להיות מעגלי ומסתעף לשני סעיפים שונים - בראשון אוקסלואצטט מוביל לאלפא קטוגלטראט דרך תוצרי הביניים ציטראט ואיזוציטראט, ובשני אוקסלואצטט מוביל לסוקצינאט דרך תוצרי הביניים מלאט ופומראט. מכאן הסיקו החוקרים שעיכוב ציטראט סינתאז על ידי אלפא קטוגלטראט בתנאים אלו מהווה למעשה מקרה אופייני של משוב שלילי, בו התוצר הסופי מעכב את האנזים ההתחלתי של המסלול.[26]
בשנים שלאחר מכן נתגלה כי אלפא קטוגלטראט מעכב גם בציטראט סינתאז שהופק מאורגניזמים אחרים, כדוגמת כבד של חולדה, מנגו ומחיידקים מסוג Azotobacter הגראם שליליים והאירוביים; דבר זה כמובן אינו עומד בקנה אחד עם ההשערה הראשונית. קבוצת חוקרים בראשותו של פיטר הוצ'צ'קה מאוניברסיטת קולומביה הבריטית, שחקרו את ציטראט סינתאז המופק מהמין Symplectoteuthis oualaniensis המשתייך לסדרת דיונוני הרחף, גילו כי הוא מעוכב בריכוז גבוה של אלפא קטוגלטראט. הם טענו כי אלפא קטוגלטראט מסמל את ה"תוצר הסופי" של האינטרוול הראשון של מעגל קרבס, וריכוזו מהווה אמת מידה פוטנציאלית חשובה לכמות התוצרים שיתקבלו באינטרוול השני של מעגל קרבס (אלפא קטוגלטראט -> אוקסלואצטט). ה"מידע" הזה, החשוב לבקרת פעילות ציטראט סינתאז, לא היה יכול להתקבל מאף תוצר ביניים אחר הקודם לאלפא קטוגלטראט באינטרוול הראשון של המעגל, מכיוון שאלפא קטוגלטראט הוא הראשון מביניהם שיכול להתקבל גם במסלולים אחרים מלבד מעגל קרבס (למשל דרך גלוטמט ובאמצעות תגובת טרנסאמינציה).[27]
באופן זה ניתן להסביר מדוע אלפא קטוגלטראט מעכב את ציטראט סינתאז הן באורגניזמים בהם מעגל קרבס מתרחש בצורתו הרגילה והן באורגניזמים בהם מעגל קרבס הוא ליניארי; וכן להעריך את תפקידו בבקרת ציטראט סינתאז ובכניסת הפחמנים למעגל קרבס.
אפקט יוני[עריכת קוד מקור | עריכה]
אמנם לפעילותו של ציטראט סינתאז לא דרוש יון ספציפי, אך היא מושפעת באופנים שונים הן מיונים חד ערכיים והן מיונים דו ערכיים.
באשר ליונים חד ערכיים, נמצא כי כאשר הללו קיימים בריכוז מסוים אצל צמחים ויונקים מסוימים, וכן אצל חיידקים גראם שליליים וגראם חיוביים, גורמים לאקטיבציה של ציטראט סינתא, ומריכוז זה ומעלה - לעיכוב. KCL, למשל, נמצא גורם לאקטיבציה אצל מינים מסוימים כאשר היה בריכוז של 0 עד 60 מילי-מולר, אך מעבר לכך גרם לעיכוב של ציטראט סינתאז. מחקרים הראו כי ההשפעתם של יונים חד ערכיים לא נובעת מזהות יון זה או אחר אלא מהחוזק היוני שהם יוצרים, וכי הם גורמים לשינויים בזיקה של ציטראט סינתאז לאצטיל קואנזים A; לעומת זאת, מהירות הריאקציה המקסימלית (Vmax) וקבוע מיכאליס-מנטן (Km) עבור אוקסלואצטט נותרים ללא שינוי. שינויים קינטיים אלו מתרחשים בגלל שינויים קונפורמציונליים להם גורם המלח.[28]
קיימת וריאביליות בעמידות של ציטראט סינתאז לריכוזי יונים שונים בין מינים שונים; למשל, כאשר חוקרים מאוניברסיטת טקסס השוו בין שושנת ים מהמין Bunodosoma cavernata האוסמורגלוטורית ובין פראון מהמין Litopenaeus setiferus שאינו אוסמורגולטורי, נמצא כי לציטראט סינתאז של שושנת הים עמידות גדולה בהרבה למלחים מאשר זו של הפראון; החוקרים קישרו את התוצאות המסקרנות הללו ליכולת התנועה של היצורים - בעוד הפראון הוא נייד ויכול לבחור את הסביבה היונית בה ישהה כך שריכוז המלחים לא יזיק לו, שושנת הים הנה נייחת ובעלת אפשרות מעטה לשנות את הסביבה היונית בה נמצאת, ועל כן העמידות של ציטראט סינתאז למלחים מסייעת לשרידותה.[29]
גם ליונים דו ערכיים קיימת השפעה רבה על ציטראט סינתאז. נמצא כי ריכוזים גבוהים של יוני מנגן (Mn2+), מגנזיום (Mg2+) וסידן (Ca2+) מעכבים את פעילותו של ציטראט סינתאז המופק מלב של חזיר. מחקרים אחרים מצאו כי ציטראט סינתאז של מספר מינים של חיידקים גם כן עוכבו בריכוז גבוה של מגנזיום; ייתכן והעיכוב מתרחש בגלל אינטראקציות הנוצרות בין היונים הדו ערכיים לבין השרשרת הפולי-פוספטית של האצטיל קואנזים A. מאידך, נמצא גם כי ריכוזים נמוכים של יוני מגנזיום דו ערכיים גורמים להמרצה (סטימיולציה) של ציטראט סינתאז במספר מינים שונים שנחקרו, בהם E. coli, שמרים וחזיר, וזאת על אף שלפעילותו, כאמור, לא דרוש אף יון ספציפי. ההסבר לכך הוא שיוני המגנזיום נקשרים לאוקסלואצטט ויוצרים קומפלקס, ודבר זה גורם לפחמן אלפא של האוקסלואצטט להיות יותר אלקטרופילי ועל כן קל יותר חיזור. אם כן, המתקפה הנוקליאופילית על פחמן אלפא של אוקסלואצטט המתרחשת בשלב הדחיסה וגורמת לחיזור של קבוצת הקטו, מסתייעת ביוני המגנזיום.[30]
ביבליוגרפיה[עריכת קוד מקור | עריכה]
- Alter, Gerald M., et al. "Mutation of essential catalytic residues in pig citrate synthase." Biochemistry 29.33 (1990): 7557-7563.
- Chothia, Cyrus, and Arthur M. Lesk. "Helix movements in proteins". Trends in Biochemical Sciences 10.3 (1985): 116-118.
- Cox MM, Nelson DL (2005). Lehninger Principles of Biochemistry (4th ed.). New York: W.H. Freeman. ISBN 978-0-7167-4339-2
- Frey, Perry A., and Adrian D. Hegeman. Enzymatic reaction mechanisms. Oxford University Press, 2007.
- Hochachka, P. W., K. B. Storey, and J. Baldwin. "Squid muscle citrate synthase: control of carbon entry into the Krebs cycle." Comparative Biochemistry and Physiology Part B: Comparative Biochemistry 52.1 (1975): 193-199.
- Remington, S. JAMES. "Structure and mechanism of citrate synthase." Cur Top Cell Reg 33 (2014): 209.
- Russell, Rupert JM, et al. "The crystal structure of citrate synthase from the hyperthermophilic archaeon Pyrococcus furiosus at 1.9 Å resolution." Biochemistry 36.33 (1997): 9983-9994.
- Sarkissian, Igor V., and Dan T. Boatwright. "Regulation by salt and by krebs cycle metabolites of citrate synthase from an osmoregulator, white shrimp, Penaeus setiferus, and from a non-osmoregulator, sea anemone, Bunedosoma cavernata." Comparative Biochemistry and Physiology Part B: Comparative Biochemistry 49.2 (1974): 325-333.
- Srere, P. A. "[1] Citrate synthase:[EC 4.1. 3.7. Citrate oxaloacetate-lyase (CoA-acetylating)]." Methods in enzymology 13 (1969): 3-11.
- Wiegand G, Remington SJ (1986). "Citrate synthase: structure, control, and mechanism". Annual Review of Biophysics and Biophysical Chemistry. 15: 97–117. PMID: 3013232.
- Weitzman, P. D. J., and Patricia Dunmore. "Regulation of citrate synthase activity by α-ketoglutarate. Metabolic and taxonomic significance." FEBS letters 3.4 (1969): 265-267.
- Weitzman, P. D., and MICHAEL J. Danson. "Citrate synthase." Curr Top Cell Regul 10 (1976): 161-204.
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ 1 2 3 GRCh38: Ensembl גרסה 89: ENSG00000062485 - Ensembl, מאי 2017
- ^ 1 2 3 GRCm38: Ensembl גרסה 89: ENSMUSG00000005683 - Ensembl, מאי 2017
- ^ "Human PubMed Reference:".
- ^ "Mouse PubMed Reference:".
- ^ בעבר היו מאמרים בהם כונה ציטראט סינתאז בשם "ציטראט סינתטאז", אך על פי כללי הנומנקלטורה האנזימטית שנתקבלו על ידי האיחוד הבינלאומי לביוכימיה ולביולוגיה מולקולרית, זוהי למעשה שגיאה. בעולם הביוכימיה דהיום רווחת האבחנה בין אנזימי "סינתאז" ל"סינתטאז", כאשר האחרונים הם אלו אשר לפעילותם דרושה האנרגיה המופקת מפירוק של נוקליאוטיד טרי-פוספט (כמו ATP, CTP, TTP, GTP ו-UTP), בעוד הראשונים אינם זקוקים לאנרגיה זו. ראו: Srere (1969), p. 161.
- ^ מלבד ממינים בודדים של חיידקים, בהם למשל Lactobacillus plantarum, Streptococcus haemolysans ובמוטנטים מסוימים של Escherichia coli, וכן מתולעת טפילית מהמין Moniliformis dubius. ראו: Weitzman & Danson (1976), p. 162
- ^ Weitzman & Danson (1976), p. 162
- ^ GRCh38: Ensembl release 89: ENSG00000062485, Ensembl, May 2017
- ^ Wiegand & Remington (1986), p. 98
- ^ 1 2 3 Wiegand & Remington (1986), p. 100
- ^ Srere (1969), p. 10
- ^ Remington (2014), p. 209
- ^ Alter et al (1990), P. 7561
- ^ Wiegand & Remington (1986), p. 115
- ^ Wiegand & Remington (1986), p. 114
- ^ Remington (2014), p. 211-12
- ^ Chothia & Lesk (1985),
- ^ Russell et al. (1997), p. 9992
- ^ Remington (2014), p. 212
- ^ Remington (2014), p. 215
- ^ Remington (2014), p. 217
- ^ Frey & Hegeman (2007), p. 620
- ^ 1 2 3 Remington (2014), p. 221-226
- ^ שימו לב שהשיטות השונות למנגנון שלב זה אינן מופיעות בסכימה המופיעה כאן. לאיורים מפורטים ראו: Remington (2014), p. 225-226
- ^ Remington (2014), p. 227
- ^ Weitzman & Dunmore (1969), p. 265-66
- ^ Hochachka et al. (1975), p. 196
- ^ Weitzman & Danson (1976), p. 169
- ^ Sarkissian & Boatwright (1974), p. 331-32
- ^ Weitzman & Danson (1976), p. 171