איזומר – הבדלי גרסאות
forgot summary: image was reversed. Can someone shrink it please |
מ בוט מוסיף: ur:ہم جزء |
||
| שורה 136: | שורה 136: | ||
[[tr:İzomer]] |
[[tr:İzomer]] |
||
[[uk:Ізомери]] |
[[uk:Ізомери]] |
||
[[ur:ہم جزء]] |
|||
[[vi:Đồng phân]] |
[[vi:Đồng phân]] |
||
[[zh:同分異構]] |
[[zh:同分異構]] |
||
גרסה מ־21:57, 11 ביולי 2011
בכימיה, איזוֹמֵרים הם תרכובות בעלות אותה נוסחה מולקולרית אך בהן סדר האטומים או סידורם המרחבי שונה.
תופעת האיזומריה שכיחה במיוחד בתרכובות אורגניות, זאת לאור מספר האפשרויות העצום בהן אטומי פחמן יכולים להיקשר האחד לשני ולאטומים אחרים.
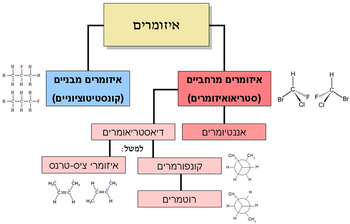
האיזומרים מתחלקים לשני סוגים ראשיים:
- איזומרים מבניים או קונסטיטוציוניים: שני חומרים בהם סדר האטומים שונה. לדוגמה (ראו תמונה משמאל), שרשרת פחמימנית המכילה אטום פלואור אחד: אטום הפלואור יכול להופיע בקצה המולקולה או באמצעה. מתקבלים שני חומרים שונים בעלי נוסחה מולקולרית זהה (בתמונה: הנוסחה C3H7F זהה לשני החומרים). איזומרים מבניים הינם תמיד חומרים שונים לחלוטין, בעלי תכונות פיזיקליות (צבע, נקודת רתיחה וכדומה) וכימיות (יכולת להגיב עם חומרים אחרים) שונות.
- איזומרים מרחביים או סטריאואיזומרים: שני חומרים בהם סדר האטומים זהה, אך הסידור המרחבי שונה.
טאוטומרים

טאוטומרים (Tautomers) הם איזומרים מבניים הנבדלים זה מזה במיקומו של אטום מימן בודד. טאוטומרים נמצאים בדרך-כלל בשיווי משקל כימי בין שתי צורות מרחביות; המעבר בין שתי הצורות המרחביות נקרא טאוטומריה או טאוטומריזם.
אנולים נמצאים בטאוטומריה עם קטונים, תופעה הקרויה טאוטומריית קטו-אנול.
סטריאואיזומרים

סטריאוכימיה, הענף החוקר את הסטריאואיזומרים, הינה מהתחומים החשובים והמרתקים בכימיה. לכיוון, לזווית ולמיקום שבהם נפגשות שתי מולקולות בעת תגובה כימית השפעה מכרעת על הסבירות לקיומה של התגובה, וכן על התוצרים שיתקבלו, והסטריאוכימיה מנסה להתחקות אחר גורמים אלו. במאמר המוקדש לסטריאוכימיה קיים גם פירוט על החשיבות הרבה של הסטריאואיזומרים בביולוגיה. תגובה כימית נקראת סטריאוסלקטיבית אם נוצר במהלכה עודף משמעותי של אחד הסטריאואיזומרים.
כאשר בוחנים את האיזומרים המרחביים השונים, למושג סימטריה תפקיד חשוב. למולקולות סימטריות, אותן ניתן לחצות לשני חלקים זהים, לעולם לא יהיו איזומרים מרחביים. נסתכל על אטום הפחמן, האטום החשוב ביותר בתרכובות אורגניות. פחמן מסוגל ליצור ארבעה קשרים קוולנטיים עם אטומים אחרים. אם לאטום פחמן מסוים קשורים ארבעה אטומים שונים או קבוצות שונות, הרי שבאטום זה לא קיימת סימטריה. אטום הפחמן של דיכלורומתאן, בתמונה משמאל, מהווה דוגמה מנוגדת, כיוון שהוא סימטרי; ניתן להעביר מישור (בין שני אטומים הכלור, למשל) ולחצות את המולקולה לשני חלקים זהים לחלוטין. לדיכלורומתאן, לפיכך, לא יכולים להיות איזומרים מרחביים; אם ננסה לשנות את סדר האטומים (למשל: להחליף בין המיקום של אטום כלור ואטום מימן), תמיד נקבל מולקולות זהות, אותן ניתן להניח האחת על השנייה כך שהן יחפפו לגמרי.
קריטריון חשוב נוסף הינו תמונת הראי של מולקולות. למולקולות אסימטריות יש, כאמור, איזומרים מרחביים. לעתים שני איזומרים כאלו מהווים בבואת ראי האחד של השני, ולעתים לא. מולקולה שלה בבואת ראי, ושהיא ובבואת הראי אינן חופפות האחת את השנייה (בדומה לידיים), מכונה כיראלית (Chiral); מולקולה סימטרית, שבבואת הראי שלה היא למעשה מולקולה זהה (ניתן לחפוף ביניהן), מכונה אכיראלית. בהתאם לכך נחלקים כל האיזומרים המרחביים לשני סוגים:
- אֵנַנְטיוֹמרים (Enantiomers, או איזומרים אופטיים): שני איזומרים המהווים תמונת ראי האחד של השני, ושלא ניתן לחפוף בין שניהם. הידיים האנושיות, כפי שמודגם להלן, הינן דוגמה לאננטיומרים.
- דִיאַסְטֵרֵיאוֹמרים (Diastereomers): שני איזומרים שאינם מהווים תמונת ראי האחד של השני.
אננטיומרים
 ערך מורחב – אננטיומר
ערך מורחב – אננטיומר


מקור המושג אננטיומר ביוונית: Enantios פירושו "הפוך". לאננטיומרים, בניגוד לאיזומרים אחרים, תכונות פיזיקליות זהות: הם רותחים וניתכים באותה הטמפרטורה, יש להם צפיפות זהה, וכן הלאה. מצב זה נובע מכך שהקריטריונים הקובעים את התכונות הפיזיקליות כמו הקשרים הכימיים בין אטומי האננטיומרים, מיקום האטומים, אורכי הקשרים, הזוויות וכן הלאה זהים לגמרי.
למרות זאת האננטיומרים אינם זהים מכיוון שניתן להבדיל בין שני אננטיומרים שונים באמצעות הפעילות האופטית שלהם. כשמקרינים גבישים של אננטיומר באור מקוטב מישורית (אור שעובר דרך מסנן אופטי מיוחד המאפשר רק לקרניים במישור מסוים לעבור), הגבישים מסיטים את האור לכיוון מסוים. פעילות אופטית קיימת רק במולקולות כיראליות. שני אננטיומרים שונים מסיטים את האור באותה הזווית בדיוק, אך בכיוון ההפוך. האננטיומר המסיט את האור עם כיוון השעון מסומן בסימן פלוס (+), ואילו האננטיומר המסיט את האור כנגד כיוון השעון מסומן בסימן מינוס (-).
אננטיומטרים קיימים גם בסוכרים למיניהם, שם הם מסומנים באותיות D וL, כאשר אננטיומר D הוא ברירת המחדל של הטבע ביצור סוכרים. הבדל הבא לידי ביטוי בסוכרים הוא היכולת של הגוף לפרק אותם - בגוף האדם יש אנזים מיוחד המיועד לפירוק סוכרוז D (הלא הוא הסוכר הרגיל בו אנו משתמשים ביום יום) אך אין אנזים לפירוק סוכרוז L. משמעות הדבר היא שסוכרוז L הוא הממתיק האופטימלי שכן יש לו טעם של סוכר, אך משום שהגוף אינו מסוגל לפרקו הוא אינו נכנס למחזור הדם ועל כן הוא חסר ערך קלורי ואינו מסוכן לחולי סוכרת.
איזומרים בביולוגיה
מערכות ביולוגיות מדגימות היטב כיצד אננטיומרים הינם חומרים שונים. להלן כמה דוגמאות:
- התרופה תלידומיד. אחד האננטיומרים מקל על בחילות שחשות נשים בהריון; האננטיומר השני גורם לפגמים מולדים חמורים בתינוקות.
- החומר קארבון (Carvone). אחד האננטיומרים מקנה ריח לפטרוזיליה ושמיר; האננטיומר השני מקנה ריח לסוג של מנטה (Spearmint).
- החומר לימונן (Limonene). אחד האננטיומרים מקנה ריח ללימון; האננטיומר השני מקנה ריח לתפוז.
להרחבה ראו: סטריאוכימיה.
הסיבה לפעילות השונה של האננטיומרים במערכות הביולוגיות היא שגם האנזימים עצמם, האחראיים, למשל, על הקניית תחושת הריח, הינם כיראליים, ובגוף הם מופיעים בדרך-כלל בצורת אחד האננטיומרים בלבד. כך, למשל, אנזים המסיט אור מקוטב עם כיוון השעון מתאים בצורה מושלמת לסובסטרט המסיט אף הוא את האור עם כיוון השעון; התאמתו לאננטיומר השני של הסובסטרט פחותה, והדבר מתבטא בתופעה פיזיולוגית כלשהי, למשל: ההבחנה בין ריח הלימון וריח התפוז.

חומרים כיראליים רבים בטבע מופיעים תמיד בצורת אחד האננטיומרים, ואילו חומרים אחרים מופיעים בשתי הצורות. רוב חומצות האמינו והסוכרים, למשל, מופיעים בצורת אחד האננטיומרים בלבד. הופעתם של חומרים אלו, אבני הבניין של היצורים החיים, כאננטיומר מסוים משפיעה גם ברמת המקרו (הייצור השלם). לקונכיית השבלולים, למשל, מבנה סלילי כיראלי. מסתבר שקונכיות המורכבות מסליל הזורם עם כיוון השעון שכיחות פי 20,000 יותר מקונכיות בהן הסליל זורם כנגד כיוון השעון. זהו אינו צירוף מקרים, אלא תוצאה של סוג האננטיומרים של המולקולות המרכיבות את הקונכיות.
הסיבה לכך שקיימת דומיננטיות בטבע לאננטיומר אחד ולא לשני איננה ידועה. לשאלה זו חשיבות רבה, שכן פתרונה יגלה פרטים חשובים בנוגע לאבולוציה ולהיווצרות החיים על-פני כדור הארץ.
בתא קיימים אנזימים רבים הממירים תרכובות מאיזומר אחד שלהן למשנהו. איזומראז הוא שמם הכולל של אנזימים אלו, ודוגמה לכך ניתן למצוא בתהליך הגליקוליזה, בה מומר גלוקוז 6-פוספט לאיזומר שלו - פרוקטוז 6-פוספט - על ידי האנזים פוספוהקסוז איזומראז. במקרה זה משתנה גם הקבוצה הפונקציונלית, והתרכובת הופכת מאלדהיד (או אלדוזה, במקרה של הסוכר גלוקוז) לקטון (פרוקטוז, קטוזה). מאוחר יותר בתהליך הגליקוליזה מומר הקטון דיהידרוקסיאציטון פוספט לאלדהיד גליצראלדהיד 3-פוספט. כל האיזומרים המוזכרים כאן הינם איזומרים מבניים ולא מרחביים.
קונפיגורציה מוחלטת
לא ניתן לחזות את כיוון הסטת האור של אננטיומרים שונים לפי סדר הופעת האטומים בהם. נבחן, לדוגמה, את האננטיומר הימני של ברומוכלורופלואורומתאן (בתמונה). נניח שאננטיומר זה מסיט את האור עם כיוון השעון; אם משנים אחד ממתמיריו (למשל, נחליף את אטום המימן בקבוצת הידרוקסיל, OH), ייתכן שעתה תסיט המולקולה את האור כנגד כיוון השעון - זאת אף על פי שקונפיגורציית האטומים נותרה ללא שינוי.
לאור זאת המציאו הכימאים שיטה להגדרת הקונפיגורציה המוחלטת של אננטיומרים. הקונפיגורציה מגדירה את סדר המתמירים סביב אטום הפחמן האסימטרי, ואינה קשורה, כאמור, לכיוון הסטת האור המקוטב. אם המתמירים מסודרים סביב אטום הפחמן עם כיוון השעון (בהמשך תוסבר משמעות העניין), המולקולה מסומנת באות R (קיצור של Rectus, "ימין" בלטינית); אם המתמירים מסודרים כנגד כיוון השעון, המולקולה מסומנת באות S (קיצור של Sinister, "שמאל" בלטינית). אם במולקולה קיימים יותר מאטום פחמן אסימטרי אחד, מצוין S או R עבור כל אחד מהם, בתוספת ספרה המציינת את הפחמן הרלוונטי. לצד סימון הקונפיגורציה המוחלטת ניתן לציין גם את כיוון הסטת האור, זאת כזכור בעזרת מינוס או פלוס. לדוגמה: (2R,3S)-(+)ברומוכלורובוטאן. במולקולה זו 2 פחמנים אסימטריים - לאחד קונפיגורציה מוחלטת R (הפחמן השני בשרשרת) ולשני - S (הפחמן השלישי). המולקולה מסיטה את האור עם כיוון השעון.
היטלי פישר
 ערך מורחב – היטל פישר
ערך מורחב – היטל פישר
היטלי פישר, על-שם הכימאי הגרמני הרמן אמיל פישר, זוכה פרס נובל לכימיה בשנת 1902, הינם דרך מופשטת להצגה גרפית של המבנה התלת-ממדי של מולקולות. היטלי פישר מאפשרים לקבוע במהירות את הקונפיגורציה המוחלטת של המולקולה.
דיאסטריאומרים
- קוֹנפוֹרמרים (Conformers): ניתן לעבור ממצב אחד לאחר באמצעות שינוי בזוויות הקשרים שבין האטומים. רוֹטַמֵרים (Rotamers) הינם קומפורמרים בהם ניתן לעבור ממצב אחד לאחר באמצעות סיבוב סביב קשר קוולנטי בודד בין שני אטומי פחמן.
- איזומרי ציס-טרנס (Cis-trans, איזומרים גאומטריים): איזומרים אלו מופיעים בתרכובת בהן קיים קשר קוולנטי כפול בין שני אטומי פחמן, אשר לאף אחד מהם לא קשורים שני מתמירים זהים, ומתמיר מסוג מסוים קשור לשניהם (באלקנים, למשל). האיזומר בו המתמירים המשותפים קשורים לאטומי הפחמן מאותו צד של הקשר הכפול נקרא איזומר הציס, ואילו האיזומר בו המתמירים המשותפים קשורים לאטומי הפחמן מצדדים נגדיים של הקשר הכפול נקרא איזומר הטרנס. קשר כפול, בניגוד לקשר בודד, הינו קשיח, ואינו מאפשר סיבוב. לפיכך, לא ניתן לעבור בין איזומר ציס לאיזומר טרנס ללא שבירת קשרים.
