גרורה – הבדלי גרסאות
אין תקציר עריכה |
הורדת תבנית בעבודה |
||
| שורה 1: | שורה 1: | ||
{{בעבודה אקדמית|מוסד=אוניברסיטת תל אביב|קורס=ויקי-רפואה|יעד=02 בדצמבר 2013}} |
|||
[[קובץ:Hirnmetastase MRT-T1 KM.jpg|ממוזער|150x150px|'''גרורה '''של סרטן הריאות במוח (מסומנת בחץ שחור)]] |
[[קובץ:Hirnmetastase MRT-T1 KM.jpg|ממוזער|150x150px|'''גרורה '''של סרטן הריאות במוח (מסומנת בחץ שחור)]] |
||
גרסה מ־20:29, 18 בדצמבר 2013

גרורה (באנגלית: Metastasis) היא גידול סרטני שנוצר באיבר מרוחק ממקום התפתחות הגידול הראשוני. מקור המונח הלועזי הינו בשפה היוונית, בה משמעות המילה
Metastasis הינה הזזה, העברה.
גרורות באיברים שניוניים מרוחקים הינן תוצרים של התהליך הגרורתי הרב שלבי, בו תאים סרטניים ניתקים מן הגידול הראשוני, חודרים לכלי דם או כלי לימפה, נודדים בהם ולבסוף יוצאים מהם ומתיישבים באיברים בגוף המרוחקים מן האיבר בו התפתח הגידול הראשוני[1][2]. האיברים הנפוצים ביותר להתפתחות גרורות הינם הריאות, הכבד, המוח והעצמות[3].
תהליך יצירת גרורות

גרורות נוצרות בתהליך רב שלבי מורכב. התהליך הגרורתי כולל הינתקות התאים הסרטניים מן הגידול הראשוני, חדירה לכלי דם וכלי לימפה, נדידה ולבסוף יציאה מאותם כלי דם וכלי לימפה והשתרשות באיברים המרוחקים מן האיבר בו התפתח הגידול הראשוני[4]. השתרשות ושגשוג התאים הסרטניים באיבר השניוני יובילו ליצירת גרורות, שהן למעשה גידולים שניוניים.
על מנת שתא סרטני יצליח ליצור גרורות, עליו להשלים את התהליך הגרורתי. התהליך כולל את השלבים הבאים:
- פולשנות מקומית - התאים הסרטניים ניתקים מהגידול הראשוני וחודרים לרקמה בריאה הקרובה אליהם.
- חדירה למחזור הדם - התאים הסרטניים חודרים לכלי הדם או כלי לימפה הנמצאים בקרבת מקום ונודדים באמצעותם לאיברים אחרים בגוף.
- יציאה ממחזור הדם - התאים הסרטניים נעצרים או מפסיקים לנוע בכלי דם קטנים, הנקראים נימים, באיבר השניוני המרוחק. אז הם חודרים את הנימים ופולשים לתוך הרקמה של האיבר השניוני.
- התבססות באיברים מרוחקים - התאים הסרטניים מתיישבים ברקמת האיבר השניוני ויוצרים בתחילה מיקרו-גרורות, גידולים קטנים שאינם יכולים להתפתח מעבר לגודל מסוים. מיקרו-גרורות אלה מעודדות יצירה של כלי דם חדשים בסביבתן, מה שמאפשר את התפתחותן למאקרו-גרורות. אספקת הדם נחוצה לתאים הסרטניים על מנת לקבל חמצן וחומרי מזון.
היכולת של תא סרטני להשלים את תהליך יצירת הגרורות תלויה במכלול התכונות שלו. רק תא לו יהיו את כל התכונות הדרושות להשלמת התהליך יצליח להגיע לאיבר מרוחק. גם לאחר ההגעה לאיבר המרוחק, אין כל הבטחה כי התא שצלח את תהליך יצירת הגרורות, יצליח להשתרש באיבר ולשגשג בו. גרורות יכולות להישאר רדומות במשך שנים עד שהן מתחילות לגדול שוב, אם בכלל.
עדויות שהצטברו לאחרונה מצביעות על כך שהיכולת של תא שהגיע לאיבר שניוני להתרבות וליצור בו גרורות מושפעת, בין היתר, מאינטרקציות של התאים הסרטניים עם סביבת האיבר השניוני[5]. נצפה למשל, שסביבת הריאות מעכבת חיות של תאים סרטניים שיוצרים גרורות בריאות ובכך משפיעה על היכולת ליצור גרורות באיבר זה[6].
מיקום התפתחות גרורות
תהליך יצירת הגרורות איננו אקראי - לסרטנים שונים ישנה נטייה לנדוד לאיברים שונים. אבחנה זו נטבעה לראשונה בשנת 1889 על ידי המנתח האנגלי סטיבן פאגט (באנגלית Stephen Paget), אשר תבע את היפותזת ה Seed and Soil, שאומרת כי גרורות יתפתחו רק כאשר תהיה התאמה בין התא הסרטני (Seed) לבין הסביבה באיבר השניוני אליו הגיע (Soil)[7]. כך למשל, סרטן בלוטת הערמונית יצור לרוב גרורות בעצמות, ואילו סרטן המעי הגס ינדוד לרוב לכבד[8]. אם כן לסביבה באיבר השניוני ישנה השפעה על התפתחות גרורות באיבר זה[9].
| סוג הסרטן | איברים עיקריים להתפתחות גרורות |
|---|---|
| שלפוחית השתן | עצמות, כבד, ריאות |
| סרטן השד | עצמות, כבד, ריאות, מוח |
| סרטן המעי הגס | כבד, ריאות, צפק |
| סרטן הכליות | עצמות, כבד, ריאות, מוח, בלוטת האדרנל |
| סרטן הריאות | עצמות, כבד, ריאות, מוח, בלוטת האדרנל |
| סרטן העור | עצמות, כבד, ריאות, מוח |
| סרטן השחלות | כבד, ריאות, צפק |
| סרטן הלבלב | כבד, ריאות, צפק |
| סרטן בלוטת הערמונית | עצמות, כבד, ריאות, בלוטת האדרנל |
| סרטן הקיבה | כבד, ריאות, צפק |
| סרטן בלוטת התריס | עצמות, כבד, ריאות |
| סרטן הרחם | עצמות, כבד, ריאות, צפק, נרתיק |
תסמינים
לרוב, התאים סרטניים נודדים בשלב ראשוני לעבר בלוטות לימפה. הריאות, העצמות, הכבד והמוח הינם איברים נפוצים להתפתחות גרורות כמו כן[10]. התסמינים השכיחים באיברים הללו הינם:
- בלוטות לימפה - הרחבת צמתי לימפה
- ריאות - שיעול, יריקת דם וקוצר נשימה
- עצמות - כאב ושברים
- כבד - הגדלה, בחילות וצהבת
- מוח - תסמינים נוירונליים כגון כאבי ראש, פרכוסים וסחרורת
לחלק מהחולים, יחד עם זאת, אין תסמינים כלל.
אבחנה
גרורות יכולות להימצא בעת האבחנה של הגידול הראשוני או שנים אחריה. כאשר גידולים נוספים מאובחנים בחולה שטופל כנגד סרטן בעבר, לרוב מדובר בגרורות ולא בגידול ראשוני נוסף. אין בדיקה אחת המאבחנת גרורות, בדיקות שונות נחוצות על מנת לאבחן הימצאות או היעדר גרורות. הבדיקות שנעשות נבחרות על פי סוג הגידול הראשוני ועל פי התסמינים אותם מתאר החולה.
בדיקות דם
בדיקות דם שגרתיות יכולות להצביע על מדדים חריגים המרמזים על הימצאות גרורות. כך למשל תפקודי כבד חריגים יכולים להצביע על גרורות בכבד. יחד עם זאת, למדדים חריגים אלה יכולים להיות גורמים רבים שאינם סרטן. לרוב, בדיקות הדם הינן תקינות, גם אצל אנשים בעלי מחלה מפושטת ומתקדמת. בסרטנים מסוימים, ישנם סמנים ספציפיים אשר ניתן למדוד את רמתם בדם, כגון הסמן PSA בסרטן בלוטת הערמונית ו CA-125 בסרטן השחלות. עלייה ברמת הביטוי של מדדים אלה בדם לעומת רמת הביטוי שלהם בעת האבחנה יכולה להצביע על התקדמות והתפשטות הסרטן ולרמז על פיזור גרורתי.
בדיקות הדמיה
ישנן בדיקות רבות שמטרתן "לצלם תמונות" של איברים שונים בתוך הגוף. בדיקות ההדמיה שיבוצעו ייבחרו על פי סוג הגידול הראשוני, האיברים המועדפים ליצירת גרורות על ידי הגידול הראשוני ועל פי התסמינים שיתוארו על ידי החולה.
צילום רנטגן
בצילום רנטגן נבלעות קרני הרנטגן בחומרים צפופים בתוך הגוף, כגון סחוס ועצם, אבל לא על ידי חומרים שאינם צפופים, כמו דם. לכן צילום זה מאפשר לבחון הימצאות גרורות בעצמות הגוף.
מיפוי עצמות
מיפוי עצמות מתבצע באמצעות חומר רדיואקטיבי המאפשר לאבחן נזק בעצמות בכל הגוף. אם אכן נצפה נזק, ניתן לבצע צילום רנטגן על מנת לאפיין את גודל הנזק.
אולטרא-סאונד (US)
אולטרה סאונד (US) (בעברית: על-שמע) היא דרך לאבחן הימצאות של גרורות בחלל הבטן. השיטה טובה בזיהוי נוזלים בחלל הבטן ולכן יכולה להבדיל היטב בין ציסטה בכבד שהינה שפירה, לבין גידול מוצק בכבד החשוד כגרורתי.
טומוגרפיה ממוחשבת (CT)
בדיקת טומוגרפיה ממוחשבת (CT) היא סוג מתוחכם יותר של צילום רנטגן, הבונה תמונה תלת-ממדית של פנים הגוף. בבדיקה זו ניתן לקבל תמונה של הראש, הצוואר, בית החזה והאגן ולבחון הימצאות גרורות באיברים אלה.
הדמיית תהודה מגנטית (MRI)
הדמיית תהודה מגנטית (MRI) מאפשרת להדגים רקמות רכות עם ניגודיות טובה יותר מאשר בטומוגרפיה ממוחשבת (CT), וללא שימוש בקרינה מייננת. השימוש הטוב ביותר לבדיקה זו הוא אבחון הימצאות גידולים סרטניים או גרורות במוח או גרורות בעמוד השדרה.
טומוגרפיית פליטת פוזיטרונים (PET)
טומוגרפיית פליטת פוזיטרונים מאתרת אזורים בגוף בהם יש פעילות חילוף חומרים גבוהה, האופיינית לגידולים ולגרורות. כאשר הבדיקה מסתיימת, אותם אזורים בעלי פעילות חילוף חומרים גבוהה "יידלקו". יחד עם זאת, ישנם תאים סרטניים להם אין פעילות חילוף חומרים גבוהה ולכן לא יזוהו בשיטה זו, וכמו כן, לעתים "יידלקו" אזורים בהם יש פעילות מוגברת בשל סיבות אחרות שאינן הימצאות תאים סרטניים.
טומוגרפיית פליטת פוזיטרונים בשילוב טומוגרפיה ממוחשבת (PET-CT)
בדיקה זו משלבת את שיטת הטומוגרפיית פליטת פוזיטרונים (PET) ושיטת הטומוגרפיה הממוחשבת (CT). שילוב שתי שיטות אלה הינו יעיל מאוד באיתור מקומות בהם ישנה פעילות חילוף חומרים מוגברת, האופיינית לגידולים ולגרורות. בשילוב שתי השיטות מתקבל כלי הדמיה היכול להבדיל בין ממצא גרורתי לממצא שאינו כזה ולאפיינו היטב מבחינת גודל ומיקום. הבדיקה פחות יעילה בממצאים שגודלם פחות מסנטימטר אחד.
אנדוסקופיה
אנדוסקופיה מאפשרת התבוננות באיברים פנימיים באמצעות צינור גמיש אשר בקצהו ישנה מצלמה. לעתים יוחדר צינור זה בפתחים שקיימים בגוף, כגון פי הטבעת, ולעתים יצטרך המנתח לעשות חתך קטן דרכו יוחדר הצינור, על מנת לבחון למשל את חלל הבטן. במהלך בדיקה זו ניתן גם לקחת דגימות מרקמות.
ביופסיה
לעתים קרובות, גם לאחר ביצוע בדיקות רבות, הרופאים לא יהיו בטוחים מהו הממצא החשוד, ויהיה צורך לקחת דגימת תאים מהאזור החשוד ולשלוח אותם לבדיקה פתולוגית. תהליך לקיחת דגימה קטנה זו קרוי ביופסיה ומטרתו הוא לאבחן האם הממצא החשוד הוא שפיר או סרטני באמצעות בדיקות פתולוגיות.
-
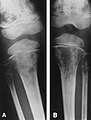
צילום רנטגן של גרורות בעצמות
-
אולטרה סאונד (US) של גרורות בכבד
-
טומוגרפיה ממוחשבת (CT) של גרורה במוח
-
הדמיית תהודה מגנטית (MRI) של גרורה במוח
-
טומוגרפיית פליטת פוזיטרונים (PET) של גרורות בכבד
-
טומוגרפיית פליטת פוזיטרונים בשילוב עם טומוגרפיה ממוחשבת (PET-CT) של גרורות בבלוטות לימפה
טיפול
הטיפול נקבע ברובו על פי סוג הגידול הראשוני, גודלו, מיקומו, מספר הגרורות ומיקומן, גיל החולה, מצב בריאותו הכללי וסוג טיפולים שקיבל החולה בעבר, אם בכלל. בעת הימצאות גרורות, ישנם מספר טיפולים שיכולים להינתן:
טיפול מערכתי
בטיפול מערכתי ניתנים חומרים הנודדים בזרם הדם ובכך משפיעים על כל התאים בגוף. לשיטת טיפול זו שייכים הטיפולים ההורמונליים, כימותרפיה, טיפולים ביולוגיים ורוב הטיפולים הניסיוניים. לרוב כאשר מתגלות גרורות, הטיפול המערכתי הוא הטיפול הנבחר, כיוון שאם התגלו גרורות באיבר מסוים, סביר כי ישנן גרורות באיברים נוספים גם אם לא אובחנו בשיטות ההדמיה בשל גודלן הקטן.
טיפול מקומי
בטיפול מקומי מתמקדים על אזור הגרורה בלבד. לשיטת טיפול זו שייכים הניתוח המקומי להסרת גרורות וטיפול קרינתי, או שילוב של השניים. לרוב, טיפול מקומי זה ייבחר כאשר יהיה צורך בטיפול חזק, ממוקד ומהיר, וכאשר אין זמן להמתין עד שהטיפול המערכתי יגיע לאזורים בהן ישנן גרורות.
טיפול מניעתי
לעיתים, כאשר מדובר בסרטנים להם יש נטייה לשלוח גרורות, לאחר הסרת הגידול הראשוני תהיה המלצה לבצע טיפול מניעתי כדי למנוע התפתחות גרורות באיברים מרוחקים. כלומר, הטיפול ימנע מתאים סרטניים בודדים שייתכן והגיעו לאיברים מרוחקים להתפתח לגרורות. הטיפולים המניעתיים יכולים להיות טיפולים מערכתיים או טיפולים מקומיים. לדוגמא טיפול קרינתי למוח בסרטן הריאות[11] או כימותרפיה לחולות בסרטן השד[12].
טיפול להקלה בכאב
טיפול להקלה בכאב קרוי גם טיפול פליאטיבי והוא ניתן לעתים בשילוב עם טיפול מערכתי או טיפול מקומי, ובמקרים אחרים כאשר לא ניתן לטפל כלל הוא ניתן על מנת להקל בתסמינים של החולה אשר לא ניתן לעשות דבר על מנת להצילו.
שיטות הטיפול שקיימות כיום ברובן אינן מצליחות לרפא סרטן גרורתי, על אף שישנם כמה סוגי סרטן, כגון סרטן בלוטת הערמונית וסרטן בלוטת התריס שניתנים לטיפול גם לאחר שליחת גרורות. מדענים רבים בוחנים דרכים חדשות למנוע התפשטות גידולים ראשוניים על מנת לבלום היווצרות גרורות. לפני שטיפול יהפוך להיות זמין לחולים ברחבי העולם, הוא צריך להיבחן במחקרים קליניים ולהימצא יעיל ובטוח. ישנם מחקרים קליניים רבים המתקיימים בימים אלה בבתי חולים, אוניברסיטאות, מכוני מחקר ועוד. תוצאות של מחקרים קליניים קודמים הובילו להתקדמות בטיפול בסרטן והן לזיהוי, אבחנה ומניעה של המחלה.
סיכויי הישרדות
גרורות הינן הגורם העיקרי למוות בחולי סרטן. ברוב המקרים, חולים עם מחלה מקומית שאיננה גרורתית ומפושטת הינם בעלי סיכויי הישרדות גבוהים יותר משל אלה עם מחלה גרורתית. ראיות שהצטברו במהלך העשורים האחרונים מצביעות על כך ש-60 עד 70 אחוז מהחולים הינם בעלי מחלה גרורתית כבר בעת האבחנה. בנוסף, חולים שאינם מציגים מחלה מפושטת בעת האבחנה עלולים לפתח מחלה גרורתית שתצריך טיפול מתאים. קיומן או העדרן של גרורות, המצביע על התפשטות המחלה, משפיע על דירוג גידול סרטני ועל סוג הטיפול שיינתן למחלה. על אף שישנם סרטנים גרורתיים שיוכלו להירפא על ידי טיפולים מסוימים, רוב סרטנים הגרורתיים הינם חשוכי מרפא. יחד עם זאת, טיפולים זמינים לכל החולים עם סרטנים גרורתיים. המטרה העיקרית של הטיפולים הללו היא לשלוט בהתקדמות והתפתחות הגידול ולהקל בתסמינים הנגרמים לחולה בעקבות התהליך סרטני. במקרים מסוימים, טיפולים כנגד סרטנים גרורתיים יאריכו חיים. אך חשוב לציין, כי רוב החולים שמתים מסרטן, מתים מסרטן גרורתי.
ראו גם
קישורים חיצוניים
הערות שוליים
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
- ^ Klein, C. A. (2008). "CANCER: The Metastasis Cascade". Science. 321 (5897): 1785–7. doi:10.1126/science.1164853. PMID 18818347.
- ^ Chiang, Anne C.; Massagué, Joan (2008). "Molecular Basis of Metastasis". New England Journal of Medicine. 359 (26): 2814–23. doi:10.1056/NEJMra0805239. PMID 19109576.
- ^ Coghlin, Caroline; Murray, Graeme I (2010). "Current and emerging concepts in tumour metastasis". The Journal of Pathology. 222 (1): 1–15. doi:10.1002/path.2727. PMID 20681009.
- ^ Pantel, K; Brakenhoff, RH (2004). "Dissecting the metastatic cascade". Nature reviews. Cancer. 4 (6): 448–56. doi:10.1038/nrc1370. PMID 15170447.
- ^ Maman, Shelly; Witz, Isaac P. (2013). "The Tumor Immunoenvironment": 15. doi:10.1007/978-94-007-6217-6_2. ISBN 978-94-007-6216-9.
{{cite journal}}: Cite journal requires|journal=(עזרה);|chapter=ignored (עזרה) - ^ Maman, Shelly; Edry-Botzer, Liat; Sagi-Assif, Orit; Meshel, Tsipi; Yuan, Weirong; Lu, Wuyuan; Witz, Isaac P. (2013). "The metastatic microenvironment: Lung-derived factors control the viability of neuroblastoma lung metastasis". International Journal of Cancer. 133 (10): 2296. doi:10.1002/ijc.28255.
- ^ Hart, IR (1982). "'Seed and soil' revisited: Mechanisms of site-specific metastasis". Cancer metastasis reviews. 1 (1): 5–16. PMID 6764375.
- ^ Disibio, G; French, SW (2008). "Metastatic patterns of cancers: Results from a large autopsy study". Archives of pathology & laboratory medicine. 132 (6): 931–9. doi:10.1043/1543-2165(2008)132\931:MPOCRF]2.0.CO;2. PMID 18517275.
- ^ Klein-Goldberg, Anat; Maman, Shelly; Witz, Isaac P. (2013). "The role played by the microenvironment in site-specific metastasis". Cancer Letters. doi:10.1016/j.canlet.2013.08.029.
- ^ Leong, SP; Cady, B; Jablons, DM; Garcia-Aguilar, J; Reintgen, D; Jakub, J; Pendas, S; Duhaime, L; Cassell, R; Gardner, M; Giuliano, R; Archie, V; Calvin, D; Mensha, L; Shivers, S; Cox, C; Werner, JA; Kitagawa, Y; Kitajima, M (2006). "Clinical patterns of metastasis". Cancer metastasis reviews. 25 (2): 221–32. doi:10.1007/s10555-006-8502-8. PMID 16770534.
- ^ Yang, GY; Matthews, RH (2000). "Prophylactic cranial irradiation in small-cell lung cancer". The oncologist. 5 (4): 293–8. PMID 10964996.
- ^ Wickerham, DL (2010). "Breast cancer chemoprevention: Progress and controversy". Surgical oncology clinics of North America. 19 (3): 463–73. doi:10.1016/j.soc.2010.03.005. PMC 3034655. PMID 20620921.