טיטניום דו-חמצני – הבדלי גרסאות
ויקישיתוף בשורה |
מ ניקיון פייפ ראשון בתבניות# |
||
| שורה 1: | שורה 1: | ||
{{תרכובת |
{{תרכובת |
||
|תמונה=[[קובץ:Titanium(IV)_oxide.jpg|250px]] |
|תמונה=[[קובץ:Titanium(IV)_oxide.jpg|250px]] |
||
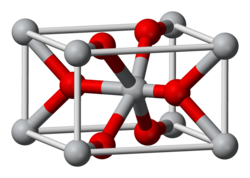
|תמונה2=[[קובץ:Rutile-unit-cell-3D-balls.png|250px]] |
|תמונה2=[[קובץ:Rutile-unit-cell-3D-balls.png|250px]] |
||
גרסה מ־00:49, 8 באפריל 2016
שגיאות פרמטריות בתבנית:תרכובת
פרמטרים [ מסה מולקולרית, נוסחה כימית ] לא מופיעים בהגדרת התבנית
 | |
 | |
| כתיב כימי |
TiO₂ |
|---|---|
| מראה | מוצק לבן |
| מספר CAS | 13463-67-7 |
| צפיפות | 4.23 גרם/סמ"ק |
| מצב צבירה | מוצק |
| טמפרטורת היתוך |
1843 °C 2116.15 K |
| טמפרטורת רתיחה |
2972 °C 3245.15 K |
טיטניום דו-חמצני או תחמוצת טיטניום, הידועה גם בשמות טיטניום דיאוקסיד וטיטניה, היא תרכובת כימית של טיטניום וחמצן שנוסחתה TiO2. צורתה הנפוצה ביותר של טיטניום דו-חמצני הוא רוטיל. רוטיל הוא הכינוי למינרל הנפוץ של התחמוצת, ועל שמו קרוי גם המבנה הגבישי (כינוי המבנה הגבישי על שם המינרל הוא מנהג נפוץ, כאשר דוגמה נוספת בולטת הוא הפרובסקיט. במצבה הנפוץ התרכובת היא אבקה לבנה. טיטניום דו-חמצני הוא זרז המשמש לפירוק תרכובות כימיות, ובעיקר פירוק של תרכובות אורגניות. בתעשייה החומר משמש כמרכיב בצבעים, וכתוסף למשחות שיניים או באיפור מינרלי. בשיטת מספרי ה-E, כצבע מאכל, מסומנת התרכובת E171.
תחמוצת הטיטניום נפוצה בטבע בעיקר במינרלים רוטיל (rutile), אנטס (anatase) וברוקיט (brookit), ובצורות נוספות, נפוצות פחות. לתחמוצת הטיטניום מגוון של פאזות בעלות מבנים גבישיים שונים, בהם מבנה טטרגונלי (רוטיל ואנטס), מבנה אורתורומבי (ברוקיט) ומבנים אחרים, מונוקליניים וקוביים.

ניתן לייצר ננוצינורות וננו-סרטים מפאזת האנטס של טיטניה, באמצעות סינתזה הידרותרמית. למבנים אלה יש פוטנציאל לקטליזה ופוטוקטליזה.
