כסף חנקתי – הבדלי גרסאות
מאין תקציר עריכה |
מ ויקיזציה |
||
| שורה 1: | שורה 1: | ||
כסף חנקתי הוא תרכובת כימית |
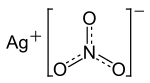
'''כסף חנקתי''' ('''ניטרט''') הוא [[תרכובת]] כימית [[מסיס]]ה של [[כסף (יסוד)|כסף]] ו[[חנקה]] (ניטרט), ש[[נוסחה כימית|נוסחתה הכימית]] AgNO<sub>3</sub>. כסף חנקתי משמש כחומר מוצא להכנת תרכובות כסף אחרות, דוגמת אלו המשמשות לייצור סרטי [[צילום]], וכן כ[[טיטרציה|טיטרציות]][[ארגנטומטריה|ארגנטומטריות]]. תמיסת כסף חנקתי משמשת גם לחיטוי מים וכתכשיר נגד [[זיהום (רפואה)|זיהום]] [[חיידק]]י. |
||
{{תרכובת| |
{{תרכובת| |
||
|תמונה=[[תמונה:Silver-nitrate-2D.svg|150px]] |
|תמונה=[[תמונה:Silver-nitrate-2D.svg|150px]] |
||
| שורה 16: | שורה 16: | ||
| |
| |
||
}} |
}} |
||
==הסטוריה== |
|||
==היסטוריה== |
|||
[[אלברטוס מגנוס]] תיעד |
[[אלברטוס מגנוס]] תיעד ב{{ה|מאה ה-13}} הפרדה בין כסף ל[[זהב]] על ידי המסת הכסף ב[[חומצה חנקתית]]. הוא גם ציין שהתמיסה המתקבלת צובעת בשחור את העור. |
||
==הפקה== |
==הפקה== |
||
| שורה 23: | שורה 24: | ||
<math>Ag(s) +2HNO_3(aq)\Rightarrow AgNO_3 + NO_2(g) +H_2O</math>. |
<math>Ag(s) +2HNO_3(aq)\Rightarrow AgNO_3 + NO_2(g) +H_2O</math>. |
||
את התגובה יש לבצע במנדף בשל פליטת הגז NO<sub>2</sub> |
את התגובה יש לבצע במנדף בשל פליטת הגז NO<sub>2</sub> |
||
==יישומים== |
==יישומים== |
||
כסף חנקתי הוא |
כסף חנקתי הוא ה[[מלח]] הזול ביותר של כסף, ויתרונותיו ביציבותו היחסית לאור, הוא אינו היגרוסקופי (אינו סופח מים מהאויר), מסיס במים ובממסים אחרים. לכן הוא חומר מוצא מועדף להכנת הלידים של כסף AgX כש-X הוא [[יון]] [[פלואוריד]], [[כלוריד]], [[ברומיד]] או [[יודיד]]. כאופן דומה כסף חנקתי הוא חומר גלם לחומרי נפץ מבוסס כסף דוגמת כסף פולמינאט - Silver fulminate (AgCNO) , כסף אזיד AgN<sub>3</sub> או כסף אצטיליד Ag<sub>2</sub>C<sub>2</sub>. יציבותה של התרכובת מאפשרת שימוש בה כסטנדרט אנליטי ב[[ארגנטומטריה]]. |
||
| ⚫ | |||
{{קצרמר|כימיה}} |
|||
[[קטגוריה:מלחים]] |
[[קטגוריה:מלחים]] |
||
| ⚫ | |||
גרסה מ־23:04, 6 בינואר 2010
כסף חנקתי (ניטרט) הוא תרכובת כימית מסיסה של כסף וחנקה (ניטרט), שנוסחתה הכימית AgNO3. כסף חנקתי משמש כחומר מוצא להכנת תרכובות כסף אחרות, דוגמת אלו המשמשות לייצור סרטי צילום, וכן כטיטרציותארגנטומטריות. תמיסת כסף חנקתי משמשת גם לחיטוי מים וכתכשיר נגד זיהום חיידקי.
שגיאות פרמטריות בתבנית:תרכובת
פרמטרים [ מסה מולקולרית, נוסחה כימית ] לא מופיעים בהגדרת התבנית
פרמטרים ריקים [ 1, 2 ] לא מופיעים בהגדרת התבנית
 | |
 | |
| שם סיסטמטי | Silver Nitrate |
|---|---|
| שמות נוספים | lunar caustic |
| כתיב כימי |
AgNO₃ |
| מראה | מוצק לבן |
| מספר CAS | 7761-88-8 |
| צפיפות | 4.35 גרם/סמ"ק |
| מצב צבירה | מוצק |
| מסיסות | גבוהה מאוד, מסיס גם באתנול ואצטון |
| טמפרטורת היתוך |
212 °C 485.15 K |
| טמפרטורת רתיחה |
444 °C 717.15 K |
| מקדם שבירה |
1.744 |
| אנתלפיית התהוות סטנדרטית | −124.4 קילוג'ול למול |
היסטוריה
אלברטוס מגנוס תיעד במאה ה-13 הפרדה בין כסף לזהב על ידי המסת הכסף בחומצה חנקתית. הוא גם ציין שהתמיסה המתקבלת צובעת בשחור את העור.
הפקה
כסף חנקתי מתקבל מתגובה של כסף מתכתי עם חומצה חנקתית . את התגובה יש לבצע במנדף בשל פליטת הגז NO2
יישומים
כסף חנקתי הוא המלח הזול ביותר של כסף, ויתרונותיו ביציבותו היחסית לאור, הוא אינו היגרוסקופי (אינו סופח מים מהאויר), מסיס במים ובממסים אחרים. לכן הוא חומר מוצא מועדף להכנת הלידים של כסף AgX כש-X הוא יון פלואוריד, כלוריד, ברומיד או יודיד. כאופן דומה כסף חנקתי הוא חומר גלם לחומרי נפץ מבוסס כסף דוגמת כסף פולמינאט - Silver fulminate (AgCNO) , כסף אזיד AgN3 או כסף אצטיליד Ag2C2. יציבותה של התרכובת מאפשרת שימוש בה כסטנדרט אנליטי בארגנטומטריה.

