ביולוגיה מולקולרית

בִּיּוֹלוֹגְיָה מוֹלֵקוּלָרִית (Molecular Biology) היא ענף מרכזי בביולוגיה, המתמקד בפעילויות ביולוגיות במישור המולקולרי, ובייחוד במבנה ושימור ה־DNA, תהליכי ביטוי גנים אשר כוללים שעתוק, תרגום, ועוד. בבסיס הדיסציפלינה עומדת הַדּוֹגְמָה הַמֶּרְכָּזִית (The central Dogma) אשר נוסחה במקור על ידי זוכה פרס נובל פרנסיס קריק. על פי הַדּוֹגְמָה, מידע ביולוגי ארוז ב-DNA, ואותו המידע "זורם" דרך RNA לתצורה פעילה – שהיא חלבון. על פי הניסוח המקורי, ברגע שחלבון נוצר, הוא לא יכול להציג את המידע הגנטי המקורי.
הביולוגיה המולקולרית בכללותה חוקרת את הַדּוֹגְמָה הַמֶּרְכָּזִית, ובפירוט היא עוסקת בין היתר במנגנוני שימור ה-DNA, בתהליך השעתוק של RNA מ־DNA, בתרגום חלבונים על סמך RNA, ובאינטראקציות השונות של מרכיבי המערכת. תחום זה מכיל כלי מחקר טכניים רבים, גבולותיו אינם מוגדרים היטב והוא חופף בחלקו לתחומים אחרים בביולוגיה, בעיקר גנטיקה וביוכימיה. בעוד שהביולוגיה המולקולרית ממוקדת בקשרי הגומלין בין המערכות השונות של התא, כולל קשרים בין DNA, RNA והסינתזה של החלבונים, הביוכימיה עוסקת באופן מיוחד באינטראקציית חלבון-חלבון ובזרימת מידע על ידי מסלולים מטבוליים. גנטיקה עוסקת באופן מיוחד, כמו גם הביולוגיה המולקולרית, ב-DNA. עם זאת, הגנטיקה מציגה זרימת מידע גנטי בקנה מידה של דורות, לעומת הביולוגיה המולקולרית אשר עוסקת בגנום של אורגניזם בודד.
ויליאם אסטבורי, מאבות התחום, תיאר ב-1961 בכתב העת Nature את הביולוגיה המולקולרית כך:
יותר גישה מאשר טכניקה, גישה מנקודת המבט של מה שקרוי מדעים בסיסיים, כאשר הרעיון המרכזי הוא לחפש מתחת לתופעות הגדולות של הביולוגיה הקלאסית, להבנת הגורמים שלהן ברמה המולקולרית. ביולוגיה זו מעוניינת בעיקר בצורתן של מולקולות ביולוגיות, והיא בעיקר תלת-ממדית ומבנית, אף כי היא לא רק שיכלול של המורפולוגיה (תורת הצורה) – עליה עם זאת להבין את היצירה והפונקציה [של המולקולות].
— [1]
היסטוריה[עריכת קוד מקור | עריכה]
התחום נוסד בשנות השלושים של המאה ה-20, והמושג "ביולוגיה מולקולרית" נטבע בידי וורן ויבר ב-1938. ויבר היה מנהל מחלקת מדעי הטבע במכון רוקפלר, והוא חשב כי הביולוגיה צפויה לעבור שינוי משמעותי בעקבות התקדמות משמעותית בתחום הקריסטלוגרפיה. לפיכך הוא העביר תקציבים רבים לתחומים הביולוגיים.
בתחילת המאה ה-20 התפרסמו כתביו של גרגור מנדל, ועקרונות התורשה הבסיסיים נעשו ידועים. בשלב זה כבר הבינו כי תכונות תלויות ב'גנים', אך עוד לא היה ברור מה הם בדיוק אותם גנים, וכיצד הם משפיעים על תכונות מסוימות. היה ידוע בשלב זה כי תאים מכילים חלבונים, סוכרים, שומנים, DNA ו-RNA. כמו כן, נראה היה כי חלבונים מציגים את השונות הגדולה ביותר מבחינה תפקודית, והם מסוגלים לפעול כאנזימים אשר מתווכים פעילויות תאיות, לכן בשלב זה סברו כי הגנים מורכבים מחלבונים פעילים.
הראשון להציג את הקשר בין גנים לחלבונים היה רופא בריטי בשם ארצ'יבלד גארוד. ד"ר גארוד טיפל בחולים אשר סבלו ממחלה לא-קטלנית בשם אלקפטונאוריאה, אשר צובעת את השתן בשחור. הצבע השחור נוצר עקב המולקולה אלקפטון (Alkapton), שבחולים אלו איננה מתפרקת לתוצר חסר צבע. גארוד הציע כי הסיבה למחלה הוא אנזים מפרק-אלקפטון פגום מלידה, כלומר, הוא הציע כי בקרב החולים ישנו חלבון ספציפי שאינו מבצע את תפקידו. כמו כן, גארוד שם לב כי המחלה עוברת בהורשה רצסיבית על פי הסבריו של מנדל, וכך התפרסמה ההצעה הראשונה הקושרת בין גנים לבין חלבונים.
ב-1940 ג'ורג' וולס בידל ואדוארד לורי טאטום הוכיחו למעלה מכל ספק את השערתו של גארוד, ובכך ביססו את הקשר בין גנים לחלבונים. בניסויים שערכו, בהם עשו שימוש בשיטות הן מתחום הגנטיקה והן מתחום הביוכימיה, הם חשפו תאים לקרינה וכתוצאה מכך נוצרו חלבונים ספציפיים אשר היו תקולים לכל אורך חיי האורגניזם. כך ניתן היה להסיק כי חלבונים נוצרים על סמך גנים, והגנים עצמם רגישים לקרינה. בידל וטאטום טבעו את הסלוגן הידוע: "One gene - one enzyme". כיום ידוע כי סלוגן זה איננו נכון. עוד לא היה ברור ממה הגנים עצמם מורכבים, רק היה ידוע כי הגנים אחראים ליצירת חלבונים. באופן מעניין, שני החוקרים החליפו את השימוש בזבוב הפירות דרוזופילה באורגניזם מודל מתאים יותר, הפטרייה החד תאית Neurospora; השימוש באורגניזמי מודל חדשים הפך למוטיב חוזר בהתפתחות הענף של ביולוגיה מולקולרית.
ב-1944 הראה אוסוולד אברי מאוניברסיטת רוקפלר כי גנים עשויים מ-DNA. עבודתו לא התקבלה באופן גורף, ורק ב-1952 הוכיחו אלפרד הרשי ומרתה צ'ייס כי החומר התורשתי הוא אכן DNA (ולא חלבונים כפי שחשבו בשלב מוקדם יותר), בניסוי שנודע כניסוי הרשי-צ'ייס. בניסוי זה הראו כי הדבקה של חיידקים מבקטריופאג' (נגיף הפוגע בחיידקים) היא על ידי DNA ולא על ידי חלבונים.
ב-1953 ג'יימס ווטסון ופרנסיס קריק פענחו את המבנה הדו גדילי של ה-DNA, בין היתר בהסתמך על תוצאות השתברות קרני ה-X במחקר שערכו רוזלינד פרנקלין, מוריס וילקינס, וריימונד גוסלינג. ב-1958 ניסח קריק לראשונה את הַדּוֹגְמָה הַמֶּרְכָּזִית של הביולוגיה המולקולרית, לפיה מידע ביולוגי נשמר ב-DNA, והוא מתבטא כחלבון. ברגע שנוצר החלבון, לא ניתן לנוע בחזרה למקור המידע.
ב-1961 הניחו פרנסואה ז'קוב וז'אק מונו כי קיים מתווך בין DNA לתוצר החלבוני, שלו קראו RNA שליח (mRNA). כמו כן, במהלך שנות השישים נקבע הקשר בין המידע המצוי ב-DNA ולמבנה החלבונים: הקוד הגנטי, אשר נשמר כרצף נוקלאוטידים ב-DNA, מגדיר את סדר חומצות האמינו בחלבונים. כל שלשה של נוקלאוטידים ב-DNA נקראת קודון, והיא מקודדת לחומצה אמינית אחת.
בתחילת שנות השישים הראו ז'קוב ומונו גם כי חלבונים מסוימים, חלבונים מווסתים, מבקרים את השעתוק של גנים ומשפיעים על ביטוים. למעשה, עבודתם הבהירה כי ישנם מקבצים של גנים אשר מתבטאים יחדיו, ופעילותם קשורה זה בזה. בשנת 1965 זכו ז'קוב, מונו ואנדרה לווף, המנהל של השניים במכון פסטר ושותפם לעבודה, בפרס נובל.
ב-1971 התגלה אנזים ההגבלה הראשון, HindII[2], גילוי שעליו זכו ב-1978 ורנר ארבר, דניאל נתנס והמילטון סמית' בפרס נובל לפיזיולוגיה או לרפואה. אנזימי הגבלה הם כלי בסיסי וחיוני בתחום ההנדסה הגנטית, מכיוון שאנזימים אלו חותכים את ה-DNA באתרים ספציפיים.
מאז הופיעו להם חידושים רבים, והביולוגיה המולקולרית התבססה כאבן יסוד בכל המדעים הביולוגיים למיניהם. ההתפתחות בתחום זה האיצה התקדמות בתחומי מחקר נוספים, כגון גנטיקה, אימונולוגיה, וירולוגיה, אמבריולוגיה וחקר הסרטן. השימוש ב-DNA מאורגניזם אחד, והחדרתו לאורגניזם שני, שינתה את פני הכלכלה, בדגש על תעשיית המזון והפארמה. המזון עבר הנדסה גנטית כך שיהיה פורה, מזין וטעים יותר. נוצרו תרופות בקנה מידה המוני על ידי שימוש בפטריות, חיידקים ותאי כליה של עכברים. הגנום האנושי רוצף ופורסם. למדנו לשבט בעלי חיים שלמים. פותחו טיפולים רפואיים משתנים המתאימים את עצמם ל-DNA האישי של כל מטופל ומטופל. כיום חיסונים נוצרים במהירות שיא, וניתן רק לדמיין לאן התחום ימשיך להתפתח.
מבנה ה-DNA[עריכת קוד מקור | עריכה]

 ערך מורחב – DNA
ערך מורחב – DNA
נוקלאוטידים - חומצות גרעין[עריכת קוד מקור | עריכה]
מולקולות ה-DNA הן שרשראות ארוכות אשר מורכבות מאבני בניין פשוטות יחסית הנקראות "נוקלאוטידים" (Nucleotides), או "חומצות גרעין". כל נוקלאוטיד בעצמו מורכב משלושה מרכיבים:
- בסיס חנקני
- סוכר
- קבוצת פוספט
הבסיסים החנקניים הם מבנים טבעתיים על בסיס חנקן ופחמן. ישנים בסיסים אשר בנויים מטבעת בודדה, וישנם אלו אשר מורכבים משתי טבעות המאוחות זו לזו. הטבעות הבודדות נקראות פירימידינים (Pyrimidines), ואילו הטבעות הכפולות נקראות פורינים (Purines).
מבין הפורינים הנפוצים ניתן למנות את אדנין (A) ואת גואנין (G). מבין הפירימידנים הנפוצים ניתן למנות את ציטוזין (C), תימין (T) ואת אורציל (U).
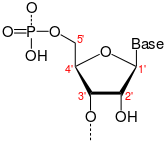
הסוכר בנוקלאוטידים הוא פנטוז, כלומר, סוכר בעל חמישה פחמנים. ארבעה מתוך חמשת הפחמנים הללו מעורבים בפעילויות חשובות למבנה ולתפקוד ה-DNA:
- פחמן C'1 קושר את הבסיס החנקני. בעגה המקצועית הקשר נקרא קשר N-גליקוזידי.
- פחמן C'2 יכול לקשור, או לנתק, קבוצת הידרוקסיד (OH). בנוכחות קבוצת ה-OH הסוכר נקרא ריבוז. בהיעדר קבוצת ה-OH הזו הסוכר נקרא דה-אוקסי-ריבוז, וזהו ההבדל המהותי ביותר (אם כי לא היחיד) בין RNA לבין DNA.
- פחמן C'3 משתתף בבניית שרשרת הנוקלאוטידים.
- פחמן C'5 קושר קבוצות פוספט, כפי שניתן לראות בתמונה. גם פחמן זה משתתף בבניית שרשרת הנוקלאוטידים יחד עם פחמן C'3. הקשרים שהם בונים יחדיו נקראים קשרים פוספו-די-אסטרים.
אף על פי שניתן לקשור מספר קבוצות פוספט, בשרשרת ה-DNA ישנה רק קבוצת פוספט בודדת. קבוצות הפוספט טעונות במטען שלילי, ולכן ה-DNA (וכך גם ה-RNA) הם בעלי פעילות חשמלית. תכונה זו מנוצלת הן על ידי התאים, ומסייעת לקיפול ה-DNA, אבל גם באופן מלאכותי במעבדות ובמרפאות. לדוגמה, במהלך משבר ה-COVID-19, יוצרו באופן מלאכותי חיסונים על בסיס RNA על ידי החברות המסחריות פייזר ומודרנה. ה-RNA, בהתאם לדוגמה המרכזית, מקודד לחלבון ויראלי אשר יזוהה על ידי מערכת החיסון. ה-RNA עצמו טעון שלילית, ובשביל לשנע אותו, ולשמור עליו, הוא הוחדר לתוך מעטפת שומנית אשר מכילה גם חלקיקים טעונים חיובית. מעטפת שכזו נקראת ליפופלקס (Lipoplex). דוגמה נוספת לשימוש במטענים חיוביים לטובת אריזת נוקלאוטידים היא אריזת גנום ויראלי. בווירוסים, הנוקלאוטידים ממוקמים בתוך קופסה חלבונית בשם קפסיד (Capsid). פעמים רבות ישנם מטענים חיוביים בחלקו הפנימי של הקפסיד, כפי שניתן לראות למשל בווירוס ה-TMV.

חומצות הגרעין נקשרות זו לזו באופן סדרתי, כך שנוצרת שרשרת ארוכה של נוקלאוטידים. הקשר נוצר על ידי קבוצות הסוכר והפוספט של הנוקלאוטידים. פחמן C'3 קושר קבוצת פוספט, אשר מחוברת מבעוד מועד לפחמן C'5 של הנוקלאוטיד הבא בשרשרת, כפי שניתן לראות בציור.
ה-DNA לא נותר חד-גדילי בתאים חיים, אלא הוא נמצא בתצורה דו-גדילי. הגדילים קשורים זה לזה בעזרת קשרי מימן. באופן שגרתי, פורין בגדיל אחד יקשור בקשרי מימן פירימידין בגדיל המשלים, ולהפך. על פי רוב הפורין A קושר את הפירימידין T, ואילו הפורין G קושר את הפירימידין C. ב-RNA, הפורין A קושר את הפירימידין U במקום הפירימידין T. עובדה זו לפיה ישנם זוגות קבועים - G:C ו-A:T אמנם נפוצה, אך לא אבסולוטית. לעיתים פגמים ב-DNA מובילים לקשרים לא-שגרתיים בין בסיסי הגנום.

זוגות בסיסים אלו נקראים גם 'זוגות בסיסים ווטסון-קריק', על שם מפצחי מבנה ה-DNA: פרנסיס קריק וג'יימס ווטסון.
מבנה ה-RNA[עריכת קוד מקור | עריכה]
 ערך מורחב – RNA
ערך מורחב – RNA
מולקולות ה-RNA הן דומות באופן תהומי למולקולות ה-DNA. עם זאת, ישנם שלושה הבדלים מרכזיים בין DNA לבין RNA:
- מספר הגדילים - על פי רוב, DNA הוא מבני דו-גדילי, ואילו RNA הוא מבנה חד-גדילי.
- שייר הסוכר - ב-DNA ישנו דאוקסיריבוז, ואילו ב-RNA ישנו ריבוז.
- בסיסים חנקניים - כאמור, ב-DNA ישנו פירימידין בשם טימין (T). ב-RNA פירימידין זה מוחלף באופן מושלם על ידי הפירימידין אורציל (U). יתרה מכך, בסיסים רבים ב-RNA הם מותמרים (בעוד שישנן מעט התמרות על גבי ה-DNA), מה שמוליד בסיסים חנקניים נוספים מלבד ארבעת הבסיסים הנפוצים (A, G, C, U). בין הבסיסים המיוחדים ניתן למנות את I, rT, Ψ, D ועוד.
ה-RNA היא מולקולה גמישה למדי, אשר מסוגלת ליצור מגוון רחב של מבנים תלת־ממדיים. עם זאת, יציבותה של מולקולה זו היא נמוכה. מולקולת ה-RNA נוטה להתפרק בתהליך של אוטו-הידרוליזה. המנגנון לפירוק זה נובע מדה-פרוטונציה ספונטנית של 2'-OH, ובעקבות זאת תקיפה נוקלאופילית של הפוספט על ידי יון האוקסיד.
בתאים חיים, ה-RNA מיוצב על ידי חלבונים, מה שמאריך את אורך חייו.
אריזת הגנום[עריכת קוד מקור | עריכה]
 ערך מורחב – כרומטין
ערך מורחב – כרומטין
כל תא אנושי מכיל כ-2 מטרים של גדילי DNA. עם זאת, קוטר תא אנושי ממוצע עומד על כ-15 מיקרון. כיצד ניתן לגשר על הפער בין אורך הגנום, לבין קוטר התא?

ראשית כל, ה-DNA הדו-גדילי נארז על גבי מבנים חלבוניים הנקראים היסטונים. ישנם היסטוני ליבה, אשר מורכבים משמונה חלבונים - H2A, H2B, H3 ו-H4 (ישנם שני עותקים לכל חלבון). בנוסף לכך ישנו חלבון היסטוני נוסף בשם H1, אשר תפקידו הוא לארוז מקבצי היסטוני ליבה.
חלבוני ארכיטקטורה גבוהים כגון SMC, שאינם היסטונים, מסוגלים לקפל עוד יותר את ה-DNA יחד עם ההיסטונים הצמודים אליו.
מכלול ה-DNA וחלבוני האריזה השונים נקרא כרומטין. בהתאם לצורך, ניתן לווסת את קומפקטיות אריזת הכרומטין. כאשר התא מעוניין להשתמש במקטעים מסוימים מן הגנום, אתרים אלו יוותרו פתוחים. לעומת זאת, אחת הדרכים בה התא מסוגל להשתיק גנים היא על ידי קיפול דחוס במיוחד של הגנום, כך שמקטע זה לא יהיה נגיש לשאר חלבוני התא.
בעת חלוקת התא, ה-DNA נמצא בתצורתו הקומפקטית ביותר.
אריזת גנום ויראלי[עריכת קוד מקור | עריכה]
בכל הווירוסים, ישנה מגבלה חריפה על "כלכלת המידע" ואריזת הגנום. הכוונה ב"כלכלת המידע" היא שהמידע המקודד בגנום הוויראלי צריך להכיל את כל החלבונים הדרושים לקיום הויריון. באופן מפתיע, דרישה זו איננה טריוויאלית כלל וכלל, והתפתחו מנגנונים רבים למען מעקף מגבלה זו.
למען האינטואיטיביות, נבחן דוגמה:
נניח כי לפנינו גנום ויראלי פשוט וקטן במיוחד, אשר מכיל 5,000 נוקלאוטידים (5kb). כל שלושה נוקלאוטידים מקודדים לחומצה אמינית אחת, ולכן גנום זה מסוגל לקודד כ-1666 חומצות אמינו, אם הגנום נקרא ברציפות מתחילתו ועד סופו. בתצורתו הדחוסה ביותר, גנום זה יתפוס צורה כדורית בקוטר 90Å. הגנום הוויראלי איננו צף חופשי במרחב, אלא הוא מוגן במעטפת חלבונית אשר נקראת קפסיד. עובי ממוצע של קפסיד עומד על כ-30Å. על מנת ליצור מעטפת חלבונית בעובי שכזה, שתוכל גם להכיל את הגנום הוויראלי המדובר, יש צורך בכ-25,000 חומצות אמינו!
כיצד ניתן להשתמש ב-1666 חומצות אמינו, על מנת לייצר מעטפת המורכבת מ-25,000 חומצות אמינו? בעיה זו נפתרת באופן חלקי על ידי שימוש ביחידות חוזרניות באופן רפטטיבי, לרוב כ-60 יחידות חוזרניות. לכן זה לא מפתיע כי מרבית הקפסידים הם סימטריים.
עם הזמן, וירוסים פיתחו מנגנוני אריזה משוכללים ומפתיעים במיוחד. מנגנונים אלו כוללים גם פעילויות הקשורות למבנה הקפסיד, אך גם לקומפקטיות גדילי ה-DNA או ה-RNA של אותו ויריון (הכוונה ויריון היא וירוס בוגר אשר מסוגל להדביק). ישנם אף וירוסים בהם המטען הגנטי דחוס באופן דומה לקריסטלים אשר מיוצרים באופן סינתטי במעבדה.
הַדּוֹגְמָה הַמֶּרְכָּזִית[עריכת קוד מקור | עריכה]
 ערך מורחב – הדוגמה המרכזית של הביולוגיה המולקולרית
ערך מורחב – הדוגמה המרכזית של הביולוגיה המולקולרית

שכפול[עריכת קוד מקור | עריכה]
 ערך מורחב – שכפול DNA
ערך מורחב – שכפול DNA
כאמור, כל המידע הגנטי שמור ב-DNA. על מנת שמידע זה יועבר לדורות הבאים, יש להפיק העתקים של מידע זה. לאחר שכפול ה-DNA, עותק אחד יוותר מאחור, ואילו עותק חדש יועבר הלאה לדור הבא.
החלבון המרכזי אשר אחראי על ביצוע השכפול נקרא DNA פולימראז. חלבון זה הוא מכונה מולקולרית מורכבת, אשר מורכבת ממספר תת-יחידות. קומפלקס זה פועל על גבי DNA חד-גדילי, אשר על פיו נוצר הגדיל המשלים. תוך כדי השכפול, הגדיל המשלים נקשר לגדיל התבנית, וכך מתקבל DNA דו-גדילי.
ל-DNA פולימראז ישנה מגבלה חריפה, והיא היעדר יכולת סינתזה דה-נובו (סינתזה יש מאין). פעולתו של החלבון היא למעשה הארכת גדיל DNA חד-גדילי. לכן, מלבד DNA חד-גדילי אשר מהווה כתבנית, על מנת שיתבצע שכפול יש לצרף למערכת גם רצפים קצרים של DNA, או RNA, אותם ה-DNA פולימראז יוכל להאריך לכדי הגדיל המשלים. רצפים קצרים אלו, אותם DNA פולימראז מאריך, נקראים פריימרים (או בעברית - תחלים).
במילים אחרות, שכפול DNA על ידי DNA פולימראז תלוי בגדיל תבנית (Template strand) ארוך, ובגדיל פריימר קצר (Primer strand). חלבון הפולימראז מאריך את גדיל הפריימר בהתאם לגדיל התבנית.
מכיוון ש-DNA הוא מבנה דו-גדילי, כיצד נוצרים הגדילים החד-גדיליים עליהם DNA פולימראז מסוגל לפעול?
ראשית כל, גדיל התבנית נוצר על ידי פעילותם של שני חלבונים:
- חלבוני איניציאציה (Initiation Proteins)
- הליקאז (Helicase)
חלבוני האיניציאציה מבצעים את ההפרדה הראשונית שבין שני גדילי ה-DNA. דוגמאות לחלבונים ממשפחה זו כוללים את DnaA הפרוקריוטי, ואת ה-ORC האאוקריוטי. מבנים אלו מפרידים את שני גדילי ה-DNA באזור מוגדר.
לאחר מכן ההליקאז מתחבר לאחד הגדילים, ותפקידו הוא לשבור את קשרי המימן אשר מרכיבים את ההליקס הדו-גדילי. בחירת הגדיל עליו ההליקאז נטען תלויה באורגניזם. פעילותו של DNA פולימראז מצומדת לפעילותו של ההליקאז.
לעומת גדיל התבנית, גדילי הפריימר נוצרים על ידי חלבון נפרד אשר נקרא פרימאז. חלבון זה מייצר מקטעים חד-גדיליים קצרים, אותם הפולימראז מאריך. באופן מפתיע, אותם פריימרים מורכבים מ-RNA, ולא מ-DNA. בהמשך פריימרים אלו יחתכו ויוחלפו לכדי מקטעי DNA.
כפי שניתן להבין, מדובר בתהליך מורכב להפליא, אשר תיארנו רק חלק קטן מתוכו. חלבונים נוספים אשר לוקחים חלק בביצוע השכפול הם: טופואיזומראז, SSB, ליגאז ועוד רבים. מכלול החלבונים אשר פועלים יחדיו לשכפול ה-DNA נקראים ה"רפליזום".
מודל הטרומבון[עריכת קוד מקור | עריכה]

כפי שצוין לפני כן, ה-DNA הוא מבנה דו-גדילי, כאשר כל גדיל הוא רצף של נוקלאוטידים המחוברים זה לזה בקשרים קוולנטיים פוספודיאסטריים. שני הגדילים מזווגים באמצעות בקשרי מימן, בחוקיות שנקראת כיום 'קשרי ווטסון-קריק'. הקשרים הפוספודיאסטריים הם בעלי כיווניות, מכיוון שתהליך היצירה של קשר מסוג זה מחייב אינטראקציה בין ההידרוקסיד בפחמן C'3, לבין קבוצת הפוספט בעמדה אלפא של פחמן C'5 על גבי הנוקלאוטיד הבא. לכן, בכל גדיל בודד של DNA, קצה אחד יציג קצה C'5, ואילו הקצה השני יציג קצה C'3. הכיווניות הזו נקראת 5' ל-3'. הקצה ה-5' נחשב במעלה הזרם, או Upstream, ואילו הקצה ה-3' נחשב במורד הזרם, או Downstream.
בעת השכפול, ה-DNA פולימראז קורא במקביל את שני הגדילים בו זמנית, אף על פי שהם ממוקמים באוריינטציה הפוכה זו לזו. אחד הגדילים נקרא על ידי הפולימראז מ-5' ל-3', ואילו הגדיל השני נקרא מ-3' ל-5'. גדילי הבת שנוצרים מסוגלים להיווצר אך ורק בכיווניות 5' ל-3'. איך אם כן מסנתז הפולימראז גדילי DNA מ-3' ל-5'?
שאלה זו תעתעה בחוקרים רבים בתחום הביולוגיה המולקולרית במשך זמן ממושך. מסתבר אפוא כי הגדיל אשר נקרא מ-5' ל-3' (שמהווה בתורו תבנית לגדיל מ-3' ל-5' - אך מבנה זה איננו אפשרי) מתקפל על עצמו, ויוצר לולאה. גדיל הבת אשר מסונתז, גדל לתוך הלולאה. נוסף על כך, גדיל זה מסונתז במקטעים, אשר נקראים מקטעי אוקאזקי. כאשר מקטע אוקאזקי מסונתז בשלמותו, הלולאה מתכווצת, ומתחילה הסינתזה של המקטע הבא. השינוי המחזורי בגודל הלולאה קיבל את השם האל-מותי "מודל הטרומבו". כך מסונתזים שני הגדילים בו זמנית, ובאותו הכיוון.
הגדיל הנקרא מ-3' ל-5' מאפשר סינתזה של גדיל בת מ-5' ל-3', ולכן מסונתז באופן המשכי, ללא מקטעי אוקאזקי. גדיל זה נקרא 'הגדיל המתמשך' (Leading strand), ואילו הגדיל השני, המסונתז באופן מקוטע, נקרא 'הגדיל המפגר' (Lagging Strand).
שעתוק[עריכת קוד מקור | עריכה]
 ערך מורחב – שעתוק (ביולוגיה)
ערך מורחב – שעתוק (ביולוגיה)

ביצורים רב תאיים, כל התאים מכילים את אותו הגנום - DNA. מה, אם כן, מבדיל בין תא השייך לעין, או ללב, לכבד, או לשחלה? יתרה מכך, כיצד תאים, גם במיקרואורגניזמים, מגיבים לתנאי סביבה משתנים?
אף על פי שה-DNA מכיל גנים רבים, על פי רוב רק מקצת מן הגנים מגיעים לידי ביטוי חלבוני. תאים שונים, גם אם הם מכילים את אותו הגנום, מבטאים גנים שונים. זוהי סוגיה מרכזית ומהותית המובילה להבדלים בין התאים השונים בגוף. תא בודד עשוי להגיב לגירוי חיצוני באמצעות שינוי פרופיל הגנים אשר בא לידי ביטוי.
ביטוי גנים, או בלועזית - gene expression - הוא מכלול של פעולות, אשר בסופן נוצרת מולקולה פעילה על בסיס DNA, אך שהיא איננה DNA בעצמה. על פי רוב, הכוונה במונח זה היא ביטוי ברמת חלבון, אך ישנם גנים רבים אשר מייצרים מולקולות RNA אפקטוריות. על מנת שגנים יתבטאו, ראשית יש צורך ביצירת מולקולת RNA על בסיס מולקולת ה-DNA. תהליך זה נקרא שעתוק, או transcription. מקצת מן ה-RNA, אשר לו תכונות ייחודיות, מאפשר לייצר חלבונים על סמך רצף הנוקלאוטידים שלו. ל-RNA אשר מהווה תבנית ליצירת חלבון אנו קוראים mRNA, ולתהליך ההמרה משפת הנוקלאוטידים, לשפת חומצות האמינו - אנו קוראים תרגום (translation).

בדומה לשכפול, החלבון המרכזי אשר מבצע את השעתוק הוא פולימראז, אך הפעם מדובר בקומפלקס חלבוני בשם RNA פולימראז. בפרוקריוטים ישנו, לרוב, RNA פולימראז בודד, ואילו באאוקריוטים ישנם שלושה סוגים שונים. החלבון RNA פולימראז II מהווה הפולימראז המרכזי, והוא גם זה שאחראי על יצירת mRNA.
מכיוון שתעתיקי ה-RNA מהווים את חלק הארי של ביטוי גנים, ישנו תהליך בקרה הדוק, מורכב ומגוון על השעתוק בכללותו. הנקודה הרגישה ביותר בתהליך הבקרה היא תחילת השעתוק. על מנת שקומפלקס ה-RNA פולימראז יקשור את ה-DNA ויחל בסינתזת RNA, יש צורך בחלבונים מתווכים. באאוקריוטים, חלבונים אלה נקראים פקטורי שעתוק, ואילו בפרוקריוטים הם נקראים גם פקטור סיגמא (σ factor). פקטורי השעתוק קושרים מצד אחד את הפולימראז, ומן הצד השני את ה-DNA. אתר הקישור של פקטורי השעתוק ל-DNA נקרא פרומוטר (promoter). על פי רוב הפרומוטר ממוקם במעלה הזרם (5') לגן, אם כי ישנם גם פרומוטורים הממוקמים במורד הזרם לגן, אך במקרה כזה נוצרות לולאות ב-DNA.
לעיתים קרובות, פקטורי השעתוק ממתינים בסביבת התא במצב בלתי-פעיל, אך בעת קבלת הסיגנל המתאים - ישופעלו כך שיאפשרו שעתוק של גנים ספציפיים.
תרגום[עריכת קוד מקור | עריכה]
 ערך מורחב – תרגום (ביולוגיה)
ערך מורחב – תרגום (ביולוגיה)

בעוד שבשכפול DNA, ובשעתוק RNA, הרכיבים הקטליטיים החשובים ביותר הם חלבונים - בתרגום חלבונים, הרכיב הקטליטי החשוב ביותר הוא הריבוזום. הריבוזום הוא גופיף RNA המורכב משתי תת-יחידות, אחת קטנה ואחת גדולה. ישנם גם חלבונים המסייעים לפעילות הריבוזום, אך אלו חלבונים לא-קטליטיים.
תהליך השעתוק מייצר מולקולות רבות של RNA, וביניהן rRNA (אשר מרכיב את הריבוזום), tRNA (אשר קושר חומצות אמינו), RNAi (שמווסת ביטוי גנים), tmRNA (שמחלץ ריבוזום שנתקע במהלך התרגום) ועוד רבים. נוסף על כל אלו, ישנה מולקולת RNA ייחודית בשם (mRNA (messenger RNA. מולקולה זו מסוגלת להיקשר לתת-היחידה הקטנה של הריבוזום, ועל פיה יתרחש תהליך התרגום. לאחר האינטראקציה בין ה-mRNA לתת-היחידה הקטנה, תתחבר גם התת-היחידה הגדולה. במילים אחרות, הריבוזום מושלם במלואו רק לאחר קליטת ה-mRNA.

תפקידה של התת-היחידה הקטנה הוא לקלוט את ה-mRNA, ולקרוא אותו. לעומתה, התת-היחידה הגדולה אחראית לבניית החלבון. התת-היחידה הגדולה מבצעת את תפקידה על ידי קישור tRNA, מולקולות RNA אשר נושאות חומצות אמינו.
עד כה תיארנו אינטראקציה בין:
- התת-היחידה הקטנה ל-mRNA
- התת-היחידה הקטנה לתת-היחידה הגדולה
- התת-יחידה הגדולה ל-tRNA
כיצד הריבוזום מתווך נכונה קישור בין tRNA מתאים לכל נקודה ונקודה ב-mRNA?
התשובה לכך נעוצה באינטראקציה נוספת - בין ה-mRNA לבין ה-tRNA. כל שלשת נוקלאוטידים ב-mRNA נקראת קודון, ואילו על גבי ה-tRNA ישנן שלשות קומפלמנטריות על גבי הנקראות אנטי-קודון. כאשר מתרחש זיווג בסיסים מתאים בין הקודון לאנטי-קודון, החומצה האמינית תתנתק מן ה-tRNA ותתווסף לפפטיד הצומח. לאחר כל צימוד mRNA-tRNA, הריבוזום יתקדם קודון נוסף במורד הזרם (5' ל-3'), כך שהקודון הבא ייקרא על ידי tRNA חדש. בתום תהליך התרגום ה-mRNA מתנתק מן הריבוזום, אשר בתורו מתפרק למרכיביו.
היחס למדעים ביולוגיים מולקולריים אחרים[עריכת קוד מקור | עריכה]

חוקרים בביולוגיה מולקולרית משתמשים בטכניקות מסוימות, השייכות למדע זה דווקא, אך כבר מראשית הדרך היה שימוש אינטנסיבי וקריטי בטכניקות וברעיונות מפיזיקה, גנטיקה, ביוכימיה וביופיזיקה. אין קו ברור שמבדיל בין דיסציפלינות אלה, כפי שהיה בעבר. באופן סכמטי, ניתן להבין את ההבדלים בין התחומים כך:
- ביוכימיה היא המחקר של החומרים והתהליכים שקורים בתוך יצורים חיים.
- גנטיקה היא המחקר של ההשפעה של הבדלים גנטיים על אורגניזמים. לעיתים ניתן למצוא את הגן היחיד שגורם להשפעות אלה, אך לפעמים העניין מסובך יותר.
ביולוגיה מולקולרית היא המחקר של היסודות המולקולריים של התהליכים של שכפול, שעתוק ותרגום של החומר התורשתי. הדוגמה המרכזית של הביולוגיה המולקולרית היא שהחומר הגנטי מועתק ל-RNA ומשם מתורגם לחלבון. על אף שזוהי תמונה פשטנית ביותר של הביולוגיה המולקולרית, זו נקודת התחלה טובה להבנת התחום. בזמן האחרון חוקרים מגלים תפקידים חדשים ל-RNA, שעשויים לשנות את ההבנה הזו.
הרבה מהעבודה הנעשית בביולוגיה מולקולרית היא כמותית, ובתקופה האחרונה חלק גדול מהמחקר נעשה בשיתוף של מדעי המחשב, בתחומי הביואינפורמטיקה. מתחילת העשור, המחקר של מבנה ופונקציית הגן, גנטיקה מולקולרית, היה תת-התחום החשוב ביותר בביולוגיה מולקולרית.
תחומים אחרים בביולוגיה מתמקדים במולקולות במידה גוברת והולכת, או ישירות במחקר של האינטראקציות של המולקולות כמו בביולוגיה של התא או ביולוגיה התפתחותית, או באופן עקיף, למשל כאשר משתמשים בטכניקות של הביולוגיה המולקולרית על מנת להבין את האפיונים ההיסטוריים של אוכלוסיות או מינים, כגון בתחומים של ביולוגיה אבולוציונית, כמו גנטיקה של האוכלוסייה ופילוגנטיקה. יש גם מסורת רבת שנים של מחקר של ביומולקולות בתחום הביופיזיקה.
טכניקות של ביולוגיה מולקולרית[עריכת קוד מקור | עריכה]
מאז שנות החמישים המאוחרות, ביולוגים מולקולריים למדו לאפיין, לבודד ולתפעל את המרכיבים המולקולריים של תאים ואורגניזמים. מרכיבים אלו כוללים את ה-DNA, ה"מחסן" של המידע הגנטי, וה-RNA, מולקולה הדומה ל-DNA, הפועלת כעותק של ה-DNA, וכן יש לה פונקציות מבניות ואנזימטיות ממשיות, וכן חלק בתהליך התרגום; וחלבונים, המולקולה המבנית והאנזימטית העיקרית בתא.
Expression Cloning[עריכת קוד מקור | עריכה]
 ערך מורחב – שיבוט מולקולרי
ערך מורחב – שיבוט מולקולרי
אחת מהטכניקות הבסיסיות ביותר בביולוגיה מולקולרית, המשמשת למחקר של פונקציה של חלבונים, היא Expression Cloning. בטכניקה זו, הקוד ב-DNA עבור חלבון מסוים מועתק (בעזרת אנזימים שונים) לפלסמיד (הידוע כ-Expression Vector). לפלסמיד זה עשויים להיות אלמנטים מיוחדים, שעוזרים לייצור החלבון המסוים הזה, וכן עשויים להיות לו סמנים אנטיביוטיים, שעוזרים לעקוב אחרי הפלסמיד.
את הפלסמיד הזה אפשר להחדיר לתאים של חיידקים או של חיות. הכנסה של ה-DNA לתאי חיידקים נקראת טרנספורמציה, וניתן לבצעה בכמה שיטות, כולל אלקטרופורציה, מיקרו-הזרקה ובאופן כימי. הכנסה של DNA לתאים אוקריוטיים, כמו תאי חיות, קרויה טרנספקציה. יש כמה טכניקות אפשריות לעשות זאת. ניתן גם להחדיר את ה-DNA בעזרת נגיפים כנושאי ה-DNA. במקרים כאלה, הטכניקה נקראת טרנסדוקציה ויראלית.
בכל מקרה, הקידוד של ה-DNA עבור החלבון המסוים שאנו מעוניינים בו נמצא עכשיו בתוך התא, וניתן לייצר את החלבון. מגוון שיטות קיימות על מנת להבטיח את ייצור החלבון בכמויות גדולות, ואז ניתן להפיק את החלבון מהתא. ניתן לבדוק את החלבון לפעילות אנזימית תחת מגוון סיטואציות, או שאפשר לגבש את החלבון על מנת שניתן יהיה לבדוק את המבנה הרביעוני שלו. בתעשיית התרופות, ניתן לבדוק את התועלת של תרופות חדשות כנגד החלבון הזה.
תגובת שרשרת פולימראזית (PCR)[עריכת קוד מקור | עריכה]
 ערך מורחב – PCR
ערך מורחב – PCR
תגובת שרשרת פולימראזית (PCR) היא טכניקה רב תכליתית לשכפול DNA. באופן כללי, PCR מאפשר לשכפל מקטע DNA מסוים מיליוני פעמים, או לשנות אותו בצורה שנקבעה מראש. לדוגמה, ניתן להשתמש ב-PCR על מנת ליצור אתרים לאנזימי הגבלה, או על מנת לגרום למוטציה בבסיסים מסוימים ב-DNA.
אלקטרופורזה בג'ל[עריכת קוד מקור | עריכה]
 ערך מורחב – אלקטרופורזה בג'ל
ערך מורחב – אלקטרופורזה בג'ל

אלקטרופורזה בג'ל היא אחד המכשירים העיקריים של הביולוגיה המולקולרית. העיקרון הבסיסי כאן הוא שאת ה-DNA, ה-RNA, והחלבונים ניתן להפריד בעזרת שדה חשמלי. על ידי ג'לים שונים, ניתן להפריד את המולקולות על פי גודלן, או על פי המטען החשמלי שלהן, כשבדרך כלל ה-DNA שטעון שלילית ירוץ בג'ל לקצה החיובי וכך יופרד בבנדים על פי גודל.
EMSA[עריכת קוד מקור | עריכה]
עמודת גודל ואימונוכימיה[עריכת קוד מקור | עריכה]
ניתן ליצור נוגדנים לרוב החלבונים על ידי הזרקת כמויות קטנות של החלבון לתוך חיות כמו עכבר, ארנב, כבש, סוס או חמור. בנוגדנים אלה ניתן להשתמש במגוון שיטות.
בעמודת גודל, החלבונים מופרדים לפי גודלם, בתוך ג'ל שנמצא בין שני לוחות זכוכית. שיטה זו קרויה SDS-Page. החלבונים בג'ל מועברים לאחר מכן לקרום תומך כלשהו. לקרום ניתן להחדיר מיהולים של נוגדנים. ניתן לצפות בנוגדנים שנקשרים לחלבון שאנו מעוניינים בו במגוון שיטות, כגון זהירה כימית או רדיואקטיביות.
שימוש נוסף של נוגדנים הוא טיהור חלבונים. נוגדנים לחלבון מסוים מיוצרים ואז מחוברים ל"חרוזים". לאחר שהנוגדן יתחבר לחלבון, ניתן להפריד את קבוצת הנוגדן-חלבון באמצעות צנטריפוגה. בתהליך הסרכוז, החרוזים, יחד עם הנוגדנים, ייפרדו משאר התמיסה וכתוצאה מכך יצטרפו אליהם גם החלבונים. שאר החלבונים יישארו בתמיסה. אפשרות אחרת היא לחבר את החלבונים לחרוזים שמתרכבים לתווך תומך כלשהו, ואז לשטוף מהתמיסה את שאר החלבונים, כך שרק אלה שמקושרים לחרוזים יישארו. אחר כך מוציאים את החלבון מהתווך, בדרך כלל בעזרת הוספת תמיסה בעלת ריכוז מלח גבוה, או על ידי שינוי של ה-pH של התמיסה.
מוטגנזה מכוונת[עריכת קוד מקור | עריכה]
 ערך מורחב – מוטגנזה מכוונת
ערך מורחב – מוטגנזה מכוונת
מוטגנזה מכוונת היא טכניקה שבה מוטציה נגרמת באתר מוגדר במולקולת DNA.
ספריית הפחתה[עריכת קוד מקור | עריכה]
 ערך מורחב – ספריית הפחתה
ערך מורחב – ספריית הפחתה
ספריית הפחתה היא שיטה בביולוגיה מולקולרית בה ניתן לבחון 'עלייה' או 'ירידה' (תלוי לאיזה כיוון עושים אותה) של גנים ספציפיים כתגובה לשינוי מסוים כגון: טמפרטורה, חומרים שונים, ותנאי סביבה קיצוניים.
מערכת Cre-LoxP[עריכת קוד מקור | עריכה]
ביולוגים מולקולריים חשובים[עריכת קוד מקור | עריכה]
- מקס פרוץ
- ג'ון קנדרו
- ויליאם אסטבורי
- ג'ון דזמונד ברנל
- דורותי קרופוט הודג'קין
- קתלין לונסדייל
- הלן מגאו
- פרנסואה ז'קוב
- כריסטיאנה ניסליין-פולהרד
- פרנסיס קריק
- ג'יימס ווטסון
- ז'אק מונו
- אנדרה לווף
- לינוס פאולינג
- סוסומו טונגוואה
- רוזלינד פרנקלין
- מוריס וילקינס
- מקס דלבריק
- סלבדור לוריא
- פרדריק סנגר
- סידני ברנר
- ג'ק שוסטק
ראו גם[עריכת קוד מקור | עריכה]
| ביולוגיה | |
|---|---|
|
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- הספרייה הווירטואלית לביוכימיה וביולוגיה תאית
- המוסד לביולוגיה מולקולרית ותאית
- סרטון מולטימדיה על מורכבות החיים ברמה המולקולרית
- ביולוגיה מולקולרית, באתר אנציקלופדיה בריטניקה (באנגלית)
 ביולוגיה מולקולרית, דף שער בספרייה הלאומית
ביולוגיה מולקולרית, דף שער בספרייה הלאומית
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ Astbury, W.T. (1961). "Molecular Biology or Ultrastructural Biology?" (PDF). Nature. 190: 1124. doi:10.1038/1901124a0. PMID 13684868. נבדק ב-2008-08-04.
- ^ Roberts RJ (באפריל 2005). "How restriction enzymes became the workhorses of molecular biology". Proc. Natl. Acad. Sci. U.S.A. 102 (17): 5905–8. doi:10.1073/pnas.0500923102. PMC 1087929. PMID 15840723.
{{cite journal}}: (עזרה)
