חומצה כלורית
 | |
 | |
| כתיב כימי |
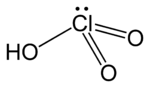
ClHO₃ |
|---|---|
| מסה מולרית | 84.45914 גרם/מול |
| מראה | תמיסה חסרת צבע |
| מספר CAS | 7790-93-4 |
| צפיפות | 1, בתמיסה (בקירוב) גרם/סמ"ק |
| מסיסות | >40 g/100 ml (20 °C) |
| חומציות | −1 pKa |
חומצה כלורית HClO3, היא אוקסו-חומצה של כלור, ושל הקודמן הפורמלי של מלחי כלורט. היא חומצה חזקה (קבוע הדיסאסוציאציה, pKa ≈ −1) ומחמצנת.
את החומצה ניתן להכין בתגובה של חומצה גופרתית עם בריום כלורט. בתגובה נוצר בריום סולפט לא-מסיס, ששוקע מהתמיסה:
- Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
דרך הכנה אחרת היא חימום חומצה היפוכלורית, שמתפרקת ליצירת חומצה כלורית ומימן כלורי:
- 3HClO → HClO3 + 2 HCl
החומצה יציבה בתמיסה מימית קרה עד לריכוז של כ-30%. ניתן להכין תמיסה בריכוז של 40% על ידי נידוף זהיר בלחץ מופחת. מעל ריכוזים אלה, בחימום, תמיסות חומצה כלורית מתפרקות ליצירת מגוון תוצרים, לדוגמה:
- 8HClO3 → 4HClO4 + 2H2O + 2Cl2 + 3 O2
- 3HClO3 → HClO4 + H2O + 2 ClO2
הפירוק נשלט על ידי גורמים קינטיים. למעשה, חומצה כלורית לעולם אינה יציבה תרמודינמית מול דיספרופורציונציה.
חומצה כלורית היא מחמצן חזק ביותר, מגע שלה עם חומר אורגני דליק גורם להתלקחות אש מיידית[1] ולכן יש לנקוט אמצעי זהירות מתאימים כאשר עובדים איתה.
לקריאה נוספת[עריכת קוד מקור | עריכה]
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- King, R. B. (Ed.) (1994) Encyclopedia of Inorganic Chemistry, Vol. 2, p. 658. Chichester:Wiley. ISBN 0-471-93620-0
קישורים חיצוניים[עריכת קוד מקור | עריכה]
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ ד"ר אבי סאייג תגובה כימית מדליקה, באתר של מכון דוידסון לחינוך מדעי, 21 בספטמבר 2016
