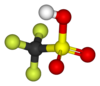
חומצה טריפלואורומתאנגופריתית
| |||
| כתיב כימי |
TfOH | ||
|---|---|---|---|
| מסה מולרית | 150.08 גרם/מול | ||
| מראה | נוזל שקוף חסר צבע | ||
| מספר CAS | 1493-13-6 | ||
| צפיפות | 1.696 גרם/סמ"ק | ||
| מסיסות | מסיס לגמרי במים (בתהליך אקסותרמי) | ||
| טמפרטורת היתוך |
-40 °C 233.15 K | ||
| טמפרטורת רתיחה |
165.5 °C 438.65 K | ||
| חומציות | (±2.0) 14.7- pKa | ||
| NFPA 704 | |||
חומצה טריפלואורומתאנגופריתית שידועה גם בשמה המקוצר חומצה טריפלית או TfOH, היא חומצה בעלת נוסחה מולקולרית של CF3SO3H. החומצה הטריפלית נחשבת לרוב לאחת החומצות החזקות ביותר והיא נכללת בקבוצת הסופר-חומצות. החומצה הטריפלית היא בערך חזקה פי 1000 (לפי קבוע הדיסוציאציה pKa) מחומצה גופרתית. החומצה הטריפלית נמצאת תחת שימוש נרחב בעיקר בתחום הקטליזטורים.
תכונות
[עריכת קוד מקור | עריכה]החומצה הטריפלית היא נוזל היגרוסקופי חסר צבע בטמפרטורת החדר. החומצה הטריפלית ממיסה תרכובות אורגניות כמו דימתילפורממיד (DMF), דימתיל סולפוקסיד (DMSO), אטצוניטריל (CH3CN) ודימתיל סולפון. הוספת החומצה הטריפלית לתרכובות אורגניות יכולה להיות מסוכנת מאוד, בגלל האנרגיה שמשתחררת בתגובה, היות שהתגובה אקסותרמית מאוד, הוכחה להיות החומצה הטריפלית ממס מצוין לחומרים אורגניים.
היסטוריה וסינתזה
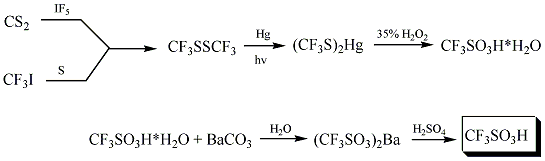
[עריכת קוד מקור | עריכה]החומצה הטריפלואורומתאנגופריתית סונתזה לראשונה בשנת 1954 על ידי צמד המדענים הסלדין וקיד על ידי הריאקציה הבאה:
דרך אחרת של סינטוז החומצה הטריפלית פלואורוניזציה אלקטרוכימית:

שימושים
[עריכת קוד מקור | עריכה]החומצה הטריפלית נחשבת לחומצה מצוינת לתרומת פרוטונים לתרכובות אחרות מכיוון שהבסיס המוצמד של החומצה הטריפלית איננו מגיב עם הצורונים האחרים.
יצירת מלחים
[עריכת קוד מקור | עריכה]החומצה הטריפלית מגיבה בתגובה אקסותרמית עם מתכות פחמתיות (בקשר יוני עם -CO3) ומתכות הידרוקסיות (עם קבוצת הידרוקסיל - -OH). דוגמה לתגובה כזו היא סינתזה של נחושת טריפלית (נחושת טריפלואורומתאנוגופריתית - Cu (OTf)2 פלי המשוואה הבאה :
- CuCO3 + 2 CF3SO3H → Cu(O3SCF3)2 + H2O + CO2
בטיחות
[עריכת קוד מקור | עריכה]מגע עם העור עלול לגרום לכוויות חמורות ולהרס הדרגתי של רקמות באזור הפגוע. שאיפת אדי החומצה עשויות לגרום לעוויתות שעשויות להיות קטלניות, לדלקת ולבצקת ריאות. הוספה של החומר לתמיסות פולריות(אנ') גורם לתגובה אקסותרמית מסוכנת במיוחד.