cAMP
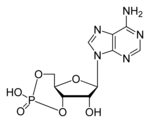

cAMP (ראשי תיבות של Cyclic adenosine monophosphate) היא מולקולה חשובה למספר רב של תהליכים ביולוגים. מולקולה זו היא נגזרת של אדנוזין טריפוספאט (ATP).
סנתוז
[עריכת קוד מקור | עריכה]cAMP מופק ממולקולת ATP על ידי אדנילט ציקלאז (AC) שהוא חלבון הנמצא בממברנת התא, חלבון זה משופעל בעזרתם של ההורמונים גלוקגון ואפינפרין. בעת קישור הורמונים אל GPCR באתר המטרה שלהם על פני הממברנה החיצונית של התא, מתרחש שינוי בתוך התא המאפשר קישור של חלבון ממשפחת חלבוני ה-G לחלבון הממברנלי אדנילט ציקלאז ולהפעלתו.
בשלב הבא מתפצל הטרימר לשתי יחידות: יחידת אלפא ויחידה המורכבת מבטא וגאמא כך שהן מחוברות לדימר, חלבון אלפא (S) נודד לאדנילט ציקלאז ומשפעל אותו. בשלב זה אדנילט ציקלאז מושך אליו מולקולות ATP והופך אותם למולקולות cAMP. לתהליך זה ידועות שתי בקרות. הראשונה- המאפשרת את הפסקת אדנלט ציקלז, היא החלפה של GTP ל-GDP G אלפא מתנתק מהחלבון ומתחבר שוב לטרימר ההתחלתי. דרך שנייה- היא תחרות של G אלפא (Q) אשר מתחרה על הקישור לאדנילט ציקלאז.
מפעילות
[עריכת קוד מקור | עריכה]cAMP הוא שליח שניוני המשמש למעבר אותות תוך־תאים, כגון תרגום של מסרים המועברים על ידי הורמונים, למשל גלוקגון ואדרנלין שאינם יכולים לחדור את ממברנת התא. תכליתו של cAMP הוא בעיקר שפעול של PKA (protein kinase A) ובקרה על התופעות הפיזיולוגיות המופיעות עקב הופעת ההורמון. כמו כן, הוא מבקר מעבר סידן דרך תעלות יוניות.
בבני אדם
[עריכת קוד מקור | עריכה]אצל בני האדם cAMP משפעל את PKA, שבמצב הלא-פעיל הוא טטרהמר (מורכב מארבע תתי-יחידות). אנזים זה מורכב משתי תתי-יחידות רגולטוריות (בקרה) ושתיים קטליטיות, כיחידה C2R2. כאשר ביחידות הרגולטוריות ישנם אתרים הקושרים cAMP ואזור חלבוני המתאים בצורה קומפלימנטרית לאתרים הפעילים של היחידות הקטליטיות.
עם קבלת ההורמון, מתחיל סינתוז של cAMP אשר נקשר ליחידות הרגולטוריות, דבר המאפשר שינוי קונפורמציה וניתוק של היחדות הקטליטיות להמשך פעילות (זרחון חלבוני במקרה זה).
החלבונים המזורחנים יכולים להיות אחראיים על מספר פעולות המתרחשות בתא (לדוגמה הגברת הגלוקונאוגנזה).כמו כן ישנם חלבונים שבעת זירחונם נקשרים ל DNA וגורמים לביטוי מוגבר של גן מסוים. לא כל חלבוני קינאז מגיבים ל-cAMP: מספר חלבוני קינז אינם תלויים ב-cAMP לדוגמה פרוטאין קינאז C.
בחיידקים
[עריכת קוד מקור | עריכה]רמת ה-cAMP משתנה בהתאם למצע הגידול של החיידק. בנוכחות גלוקוז, שהוא מקור האנרגיה הנפוץ ביותר בטבע, רמת ה-cAMP נמוכה. באופרון הלקטוז ישנו רפרסור היוצר מחסום פיזי שלא מאפשר ל-RNA פלימראז לשעתק את מקטע ה-DNA הנחוץ.
קומפלקס זה מאפשר קישור טוב ל-DNA. דוגמה לפעילות cAMP: ווסת חיובי של lac operon. בסביבה בה יש ריכוז נמוך של גלוקוז cAMP נקשר לאתר על CAP. החלבון הופך עצמו לפעיל ונקשר לאתר ספציפי ליד lac פרומוטור. צורה זו נוחה לרנ"א פולימראז להקשר בסמיכות לפרומוטור, על מנת להתחיל שעתוק של lac operon. בריכוז גבוה של גלוקוז, ריכוז cAMP פוחת ו-CAP משתחרר מ-lac operon.
cAMP וסרטן
[עריכת קוד מקור | עריכה]חוקרים סבורים כיום כי חוסר בקרה על רמות cAMP קשור להתפשטות סרטן בתאים נגועים.[דרוש מקור]
במוח
[עריכת קוד מקור | עריכה]מחקרים בעת האחרונה מראים כי cAMP משפיע על תפקוד האונה הקדמית במוח שאחראית על המחשבות המורכבות שביכולתנו לבצע (רקמת הקורטקס הקדמית). פעילות רגולטיבית של תעלות יונות במוח (HCN) מבוצעת בנוכחות cAMP אשר מאפשר את פתיחתן. עליה לרמות גבוהות של cAMP מאלצות את התעלות להישאר פתוחות. דבר זה גורם לתאי המוח לתקשורת לקויה ובכך משתבשת פעילתו של המוח.
גלריה
[עריכת קוד מקור | עריכה]-
cAMP represented in three ways