נתרן פחמתי
 | |
| סודה לכביסה | |
 | |
| נתרן פחמתי | |
| שם סיסטמטי | נתרן פחמתי |
|---|---|
| שמות נוספים | סודה לכביסה |
| כתיב כימי |
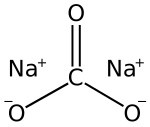
CNa₂O₃ |
| מסה מולרית | 105.988 גרם/מול |
| מראה | מוצק גבישי לבן |
| מספר CAS | 497-19-8 |
| צפיפות | 2.54 גרם/סמ"ק |
| מצב צבירה | מוצק |
| מסיסות |
70 g/L (0 °C) 216 g/L (20 ºC) 450 g/L (100 °C) |
| טמפרטורת היתוך |
851 °C 1124.15 K |
| טמפרטורת רתיחה |
1,600 °C 1873.15 K |
| חומציות | 10.33 |
| בסיסיות | 3.67 pKb |
| אנתלפיית התהוות סטנדרטית | 1130.7- קילוג'ול למול |
נתרן פחמתי (בלעז: סודיום קרבונט, Sodium Carbonate), הידוע גם כפחמת הנתרן, נתרן קרבונט או "סודה לכביסה", הוא מלח נתרני שנוסחתו הכימית Na2CO3. פחמת הנתרן נפוץ בשימוש יומיומי בעיקר כמרכך מים. ניתן להפיקו מאפר של צמחים מסוימים או, באופן מלאכותי, ממלח ואבן גיר, בתהליך הנקרא תהליך סולווה.
שימושים
[עריכת קוד מקור | עריכה]הנתרן הפחמתי משמש בעיקר כמרכך מים בתהליך הכביסה, ולכן מכונה לעיתים סודה לכביסה. כאשר לא משתמשים בנתרן הפחמתי, נדרשים דטרגנטים נוספים על מנת לספוג את יוני המגנזיום והסידן החופשיים במי הכביסה. כמו כן, סודה לכביסה משמשת כמסיר יעיל לכתמי שומן ואלכוהול.
שימוש נוסף וחשוב לנתרן הפחמתי הוא בייצור זכוכית: כאשר מחממים נתרן פחמתי עם סיליקה וסידן פחמתי לטמפרטורות גבוהות, ולאחר מכן מקררים במהירות, נוצרת הזכוכית הנפוצה ביותר, הידועה בשם זכוכית סודה (Soda-lime glass).
בזכות בסיסותו של הנתרן הפחמתי הוא משמש לעיתים כבסיס בתהליכים הדורשים ויסות. לדוגמה, הוא משמש כווסת pH בתהליך פיתוח תמונות. באופן דומה, פעמים רבות משתמשים בנתרן הפחמתי בברכות, כאשר יש צורך לבטל את החומציות של הכלור.
הנתרן הפחמתי משמש גם בתור אלקטרוליט בתהליכים כימיים, בזכות מוליכותו הטובה בתהליך האלקטרוליזה.
ריכוך מים
[עריכת קוד מקור | עריכה]מים קשים אפשר לרכך באמצעות סודיום קרבונט בהתאם לריאקציות הבאות:
כתוצאה מריאקציות אלה המים לא מכילים יותר יונים של סידן ומגנזיום הגורמים לקשיות המים. הם מוחלפים על ידי יוני הנתרן.
ראו גם
[עריכת קוד מקור | עריכה]- תהליך סולווה
- סידן פחמתי
- נתרן ביקרבונט (סודה לשתייה)



