מודל VSEPR
מודל VSEPR (ראשי תיבות באנגלית: Valence shell electron pair repulsion – מודל הדחייה בין זוגות האלקטרונים ברמות הערכיות) היא תאוריה המנבאת את הצורה הגאומטרית של המולקולות. תאוריה זו מתחשבת בעובדה שזוג אלקטרונים בלתי קושרים (שלא משמשים ליצירת קשר קוולנטי על ידי שיתוף אלקטרונים בין האטומים) דוחים זה את זה. המודל נקרא לעיתים מודל גילספי-נייהולם, על שם שני ההוגים העיקריים שלו.
תאוריה זו מסבירה בין היתר את צורתה הליניארית של המולקולה CO2 לעומת מולקולת H2O המכופפת (וזו הסיבה שהיא פולרית (קוטבית) ופחמן דו-חמצני אינו פולרי) מכיוון שלמים יש שני זוגות אלקטרונים שלא משתתפים ביצירת הקשר והם דוחים זה את זה ואת האלקטרונים הקושרים, ואילו בפחמן דו-חמצני אין אלקטרונים לא קושרים.
את מודל VSEPR מקובל להשוות עם תאוריית הקשר הערכי (Valence bound theory), אשר מתארת את צורת המולקולה על פי אורביטלים אשר זמינים אנרגטית לקשר, ובה מסווגים הקשרים לקשרי סיגמא ופאי. תאוריית האורביטלים המולקולריים היא מודל נוסף המסביר כיצד אטומים ואלקטרונים מרכיבים מולקולה.
ההנחה כי יש קשר בין הגאומטריה המולקולרית לבין מספר אלקטרוני הערכיות הוצגה עוד ב-1940 בהרצאת בייקר שנשאו נוויל סידג'ויק והרברט פאוול מאוניברסיטת אוקספורד. ב-1957 רונלד גילספי ורונלד סידני נייהולם מהקולג' האוניברסיטאי של לונדון ניסחו זאת לכדי תאוריה מפורטת המאפשרת לבחור מבין מספר גאומטריות חלופיות.
שיטת AXE[עריכת קוד מקור | עריכה]
"שיטת AXE" של ספירת אלקטרונים היא נוסחה כללית המשמשת לעיתים קרובות בעת שימוש בתאוריית VSEPR. ה-A מייצג את האטום המרכזי והמספר המצוין תחתיו הוא תמיד אחד. ה-X מייצג את המספר של קשרי סיגמא בין האטומים המרכזיים לאטומים הקשורים אליהם. קשרים קוולנטים מרובים (כפולים, משולשים) נספרים כ X יחיד' (כיוון שבכל קשר קוולנטי הקשר הראשון הוא קשר סיגמא והקשרים הנוספים במידה וקיימים יהיו קשרי פאי). ה-E מייצג את מספר זוגות האלקטרונים הלא קושרים סביב האטום המרכזי. הסכום של X ו-E, ידוע כמספר סטרי (steric number), קשור גם במספר הכולל של האורביטלים המוכלאים המשמש את תאוריית הקשר הערכי (VB).
בהסתמך על המספר הסטרי והחלוקה של Xs ו-Es, מודל VSEPR מנבא את צורת המולקולה כמובע בטבלאות הבאות. הגאומטריות נקראות על פי מיקומי האטומים בלבד, ולא על פי סידור האלקטרונים. למשל התיאור של AX2E1 כזוויתית מציין כי AX2 היא מולקולה זוויתית ללא התייחסות לזוג הלא קושר, על אף שהזוג הלא קושר מסייע בקביעת הגאומטריה של המולקולה.
| מספר סטרי |
גאומטריה בסיסית 0 זוגות לא קושרים |
זוג 1 לא קושר | 2 זוגות לא קושרים | 3 זוגות לא קושרים |
|---|---|---|---|---|
| 2 | קווית |
|||
| 3 |  מישורית משולשת |
 זוויתית |
||
| 4 |  טטראהדרית |
 פירמידה משולשת |
 זוויתית |
|
| 5 |  דו-פירמידה משולשת |
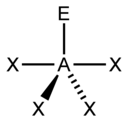 נדנדה (Seesaw) |
 צורת T |
 קווית |
| 6 | 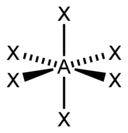 אוקטאהדרית |
 פירמידה מרובעת |
 מישורית ריבועית |
|
| 7 |  דו-פירמידה מחומשת |
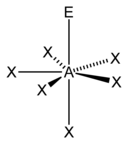 פירמידה מחומשת |
||
| 8 | Square antiprismatic |
| סוג מולקולה | צורה | סידור אלקטרונים[1] | גאומטריה[2] | זוויות הזוגות הקושרים | דוגמאות |
|---|---|---|---|---|---|
| AX1En | דו אטומי | 180° | HF, O2 | ||
| AX2E0 | קווית | 180° | BeCl2, HgCl2, CO2 | ||
| AX2E1 | זוויתית | 
|

|
120° | NO2−, SO2, O3 |
| AX2E2 | זוויתית | 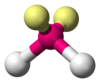
|

|
109.5° | H2O, OF2 |
| AX2E3 | קווית | 
|
180° | XeF2, I3− | |
| AX3E0 | מישורית משולשת
(משולש מישורי) |

|

|
120° | BF3, CO32−, NO3−, SO3 |
| AX3E1 | פירמידה משולשת | 
|

|
107° | NH3, PCl3 |
| AX3E2 | צורת T | 
|

|
180°,90° | ClF3, BrF3 |
| AX4E0 | טטראהדרית | 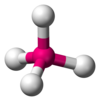
|

|
109.5° | CH4, PO43−, SO42−, ClO4− |
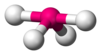
| AX4E1 | נדנדה (Seesaw) | 
|
|
180°,120°,90° | SF4 |
| AX4E2 | מישורית ריבועית | 
|

|
180°,90° | XeF4 |
| AX5E0 | דו-פירמידה משולשת | 
|

|
180°,120°,90° | PCl5 |
| AX5E1 | פירמידה מרובעת | 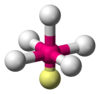
|

|
180°,90° | ClF5, BrF5 |
| AX6E0 | אוקטאהדרית | 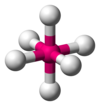
|

|
180°,90° | SF6 |
| AX6E1 | פירמידה מחומשת | 
|

|
144°, 90°, 72° | XeOF5−, IOF52−[3] |
| AX7E0 | דו-פירמידה מחומשת | 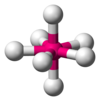
|

|
180°, 90°, 72° | IF7 |
| AX8E0 | Square antiprismatic | XeF 2−8 |
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ סידור האלקטרונים כולל זוגות לא קושרים, אשר מסומנים בצהוב
- ^ גאומטריה נצפית (ללא זוגות לא קושרים)
- ^ Enrique J Baran, Mean amplitudes of vibration of the pentagonal pyramidal XeOF5− and IOF52− anions, Journal of Fluorine Chemistry 101, 2000-01, עמ' 61–63 doi: 10.1016/s0022-1139(99)00194-3
