שתנן
 | |
 | |
| שם סיסטמטי | קרבוניל דיאמיד[1] |
|---|---|
| שמות נוספים |
קרבמיד קרבוניל דיאמין דיאמינו מתנל דיאמינו מתנון |
| כתיב כימי |
CH₄N₂O |
| מסה מולרית | 60.07 גרם/מול |
| מראה | צבע לבן, חסר ריח |
| מספר CAS | 57-13-6 |
| צפיפות | 1.33 גרם/סמ"ק |
| מצב צבירה | מוצק |
| מסיסות |
108 g/100 ml (20 °C) 167 g/100 ml (40 °C) 251 g/100 ml (60 °C) 400 g/100 ml (80 °C) 733 g/100 ml (100 °C) |
| טמפרטורת היתוך |
132.7 °C 405.85 K |
| חומציות | 0.18 |
| אנתלפיית התהוות סטנדרטית | −333.3 קילוג'ול למול |
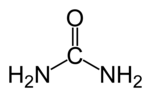
שִׁתְנָן (או שֵינָן, שתנה; בלועזית: אוּרֵאַה) הוא תרכובת אורגנית המורכבת מפחמן, חנקן, מימן וחמצן. נוסחתו הכימית היא CON2H4 או CO(NH2)2. באמצעות ייצור שתנן נפטר הגוף מעודפי חנקן הנוצרים במהלך חילוף חומרים.
אצל חלק מהחיות, האטומים המרכיבים את השתנן מגיעים מפחמן דו-חמצני, מים, חומצה אספרטית ואמוניה. והשתנן נוצר בתהליך אנאבולי. תהליך זה צורך אנרגיה, כיוון שאמוניה, תוצר לוואי נפוץ של חילוף החומרים בגוף, היא רעילה ויש לנטרלה. השתנן נוצר בכבד. חיות ימיות לא מייצרות שתנן, כיוון שסביבתן משופעת במים והן יכולות פשוט לפלוט את האמוניה לסביבה מיד כשהיא נוצרת. עופות מייצרים חומצת שתן, חומר רעיל פחות מהשתנן, כיוון שצריכת המים שלהם קפדנית יותר. גם בני אדם מייצרים מעט חומצת שתן, כתוצאה מפירוק פורין. ייצור עודף של חומצת שתן יכול לגרום לסוג של דלקת מפרקים הנקרא שיגדון.
גילוי השתנן
[עריכת קוד מקור | עריכה]השתנן התגלה על ידי הילר רול, כימאי צרפתי, ב-1773. ב-1828, השתנן היה לתרכובת האורגנית הראשונה שסונתזה מחומרים אי-אורגניים, על ידי הכימאי הגרמני פרידריך ולר, שהפיק שתנן מאשלגן ציאנאטי ואמוניום גופרתי. בכך הפריך ולר את התאוריה הגורסת כי היסודות הכימיים המרכיבים אורגניזמים חיים שונים במהותם מאלה המרכיבים את החומר הדומם, והניח את היסוד לכימיה האורגנית.
שימושים
[עריכת קוד מקור | עריכה]שימוש תעשייתי
[עריכת קוד מקור | עריכה]שימושי השתנן בתעשייה:
- חומר גלם לייצור פלסטיק.
- רכיב בדשן ומזון לחיות, המספק מקור זול וזמין של חנקן.
- משמש כתוסף למנועי דיזל ברכבים שונים, במטרה לנטרל את תחמוצות החנקן הרעילות הנפלטות מהמנוע. השתנן הופך את הגזים חנקן חד-חמצני () וחנקן דו-חמצני (), לחמצן וחנקן אטמוספירי: ו-.
- משמש כתחליף למלח בכבישים ובמסלולי המראה המשמש למניעת קיפאון. שתנן אינו גורם לשיתוך (קורוזיה) בניגוד למלח.
- כמרכיב במרככי שיער ותחליבים.
- משמש כמגיב בקומפרסים לקירור בערכות עזרה ראשונה, הודות לתגובה האנדותרמית שהוא יוצר במגע עם מים.
שימוש מעבדתי
[עריכת קוד מקור | עריכה]השתנן משמש כדנטורנט של חלבונים. באמצעות הפרת הקשרים הלא קוולנטיים בחלבון, שתנן גורם לאיבוד הקיפול הטבעי שלהם. לשם כך משתמשים בשתנן בריכוזים של עד 10 מולר.
שימוש רפואי
[עריכת קוד מקור | עריכה]שימוש תרופתי
[עריכת קוד מקור | עריכה]השתנן משמש בתכשירים דרמטולוגיים לטיפול בעור יבש.
אבחון פיזיולוגי
[עריכת קוד מקור | עריכה]כיוון שהשתנן מיוצר בגוף ברמה קבועה יחסית, רמות גבוהות של שתנן מצביעות על בעיה בסילוק השתנן, או במקרים נדירים יותר, בייצור עודף שלו. הגורם הנפוץ ביותר לאורמיה (רמה גבוהה של שתנן בדם) הוא בעיות בכליות, אך בהרבה מקרים הגורם הוא דווקא התייבשות. רמת השתנן נמדדת (גם באמצעות Blood urea nitrogen) יחד עם רמת הקראטינין על מנת לאבחן ישירות בעיות בכליות (כמו מחלת כליות כרונית) או בעיות משניות (כמו היפותירואידיזם - בעיות בתפקוד של בלוטת התריס).
רמות גבוהות מאוד של שתנן בדם (אורמיה) עלולות לגרום להפרעות נוירולוגיות, ותקופות ארוכות של אורמיה עלולות לגרום לעור לפתח גון אפרפר.
רמת השתנן בדם יכול להיות מושפעת גם ממחלות דם ממאירות כגון לוקמיה ומיאלומה נפוצה.
שימושים אבחנתיים אחרים
[עריכת קוד מקור | עריכה]שתנן המסומן באיזוטופים (פחמן 14 - רדיואקטיבי, או פחמן 13 - איזוטופ יציב) משמש לבדיקת נשימה לגילוי הליקובקטר פילורי בקיבה ובתריסריון. הבדיקה מגלה את האנזים אוראז, המיוצר על ידי ההליקובקטר, בתגובה המייצרת אמוניה משתנן. תהליך זה מעלה את הpH של הקיבה מסביב לחיידק. ניתן לזהות בעזרת אותו מבחן מינים דומים להליקובקטר פילורי בחיות כגון קופים כלבים וחתוליים (גם חתוליים גדולים).
קישורים חיצוניים
[עריכת קוד מקור | עריכה]- אודות השתנן, באתר אינפומד
- דלק חלופי מבוסס חנקן לאחסון כימי בר-קיימא של מימן, כתב העת אקולוגיה וסביבה, אוקטובר 2015
- שתנן, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 416, 860–861. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The compound H2N-CO-NH2 has the retained named ‘urea’, which is the preferred IUPAC name, (…). The systematic name is ‘carbonyl diamide’.
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.





