זרחון חמצוני
|
עיינו גם בפורטל פורטל הביולוגיה מהווה שער לחובבי הביולוגיה ולמתעניינים בתחום. בין היתר, תוכלו למצוא בפורטל מידע על ביולוגים חשובים ועל ענפי הביולוגיה. |
בביולוגיה, זרחון חמצוני הידוע גם בשם זרחון צמוד להעברת אלקטרונים (Oxidative phosphorylation, electron transport-linked phosphorylation, ,terminal oxidation) הוא מסלול מטבולי המהווה את השלב האחרון (השלישי) בתהליך הנשימה התאית. בתהליך באמצעות חמצון תוצרים הנפלטים ממעגל קרבס משתחררת אנרגיה המשמשת ליצירת אדנוזין תלת זרחתי (ATP), מולקולה המשמשת בתא להנעת תהליכים ביוכימיים רבים, מאדנוזין דו זרחתי (+ADP) וקבוצת זרחה (Pi).
רקע[עריכת קוד מקור | עריכה]

הזרחון החמצוני מתבצע בתאים איקריוטים על הממברנה הפנימית של המיטוכונדריה, תוך שימוש במנגנון כימופיזיקלי הקרוי כימיואוסמוזה, אשר במהלכו נוצר הפרש ריכוזי יונים של מימן בין החלל הפנימי הקרוי מטריקס לבין החלל הבין קרומי. ביצורים פרוקריוטיים התהליך מתבצע בצורה דומה רק מיקומו הוא על-גבי ממברנת התא עצמו. התהליך מתרחש לאחר שהמזון עבר גליקוליזה וסיים לעבור במעגל קרבס במטריקס של המיטוכונדריה. במהלך מעגל קרבס, חוזרו מולקולות רבות אשר בשלב זה הן משמשות להנעת הזרחון החמצוני, ולכן הוא חייב להיות מצומד למעגל קרבס, או למנגנון אחר המשחרר מולקולות מחוזרות באופן שוטף. כמו כן כתוצאה מהשימוש בתוצרי מעגל קרבס תהליך זה הוא השלב בו נוצרות רוב מולקולות ה ATP של הנשימה התאית. בהשוואה לשני השלבים הקודמים, בהם מתקבלות מולקולות ATP בודדות, מיוצרות בתהליך הזרחון החמצוני 30 - 36 מולקולות ATP על כל מולקולת גלוקוז שנצרכת בתהליך הגלקוליזה[1], וכן בערך 14 מולקולות ATP עבור חומצות שומן הנצרכות בתהליך חמצון בטא, בתהליכים אידיאלים. בפועל ישנם פרוטונים המצליחים לחמוק דרך הממברנה ללא ניצול האנרגיה שלהם כך שהכמויות מעט פחותות ממספרים אלו[2].
חשיבות אבולוציונית[עריכת קוד מקור | עריכה]
לניצול האנרגטי היעיל של הגלוקוז באמצעות התהליך חשיבות אבולוציונית עליונה: מאז שפיתחו היצורים הארובּיים הראשונים על-פני כדור הארץ את מנגנון הזרחון החמצוני, ועמו בעצם את תהליך הנשימה האווירנית, הפכו היצורים שבאו אחריהם במרוצת הדורות לגדולים יותר ומורכבים יותר כיוון שנוצר מנגנון להפקה יעילה של אנרגיה. המגוון המרשים הקיים כיום בעולם החי כנראה נוצר בזכות אותן מולקולות ATP המיוצרות בזרחון החמצוני. ראיה לכך, היצורים הידועים היחידים שאינם משתמשים בזרחון חמצוני לשם הפקת אנרגיה הם מיקרואורגניזמים - רובם חיידקים ומיעוטם פרוטיסטים ופטריות[3].
המנגנון הכימיואוסמוטי[עריכת קוד מקור | עריכה]

מתוך חוק שימור האנרגיה נובע כי כל פעולה הדורשת אנרגיה חייבת להיות מצומדת לפעולה הפולטת אנרגיה על מנת שתוכל להתרחש. יצירת ATP היא פעולה המעלה את הרמה האנרגטית של המערכת ולכן היא דורשת אנרגיה אי לכך מצומד לה תהליך המשחרר אנרגיה. לפי המנגנון הכימואוסמוטי התהליך משחרר האנרגיה המשמש לייצור ה ATP הוא שרשרת של העברת אלקטרונים באמצעות תגובות חמצון-חיזור.
תהליך המרת האנרגיה משרשרת מעבר האלקטרונים לחלבון ATP סינתאז, החלבון שמייצר ATP, מתרחש ביוקריוטים על הקרום הפנימי של המיטוכונדריה באמצעות ייצור זרם פרוטונים החוצה את הממברנה. זרם הפרוטונים מתרחש כתוצאה מהפרש ריכוזי יונים שמייצרת שרשרת מעבר האלקטרונים בין שני צידי הקרום הפנימי של המיטוכונדריה, מה שיוצר גם הפרש מתח בין שני צידי הממברנה הנובעים מהמטען החשמלי של היונים וגם לחץ הנע מהפרש הרכוזים[4]. החלבון המייצר את ה ATP מסיים את התהליך בכך שהוא משמש כתעלה למעבר היונים תוך ניצול האנרגיה החופשית שלהם לייצור ATP[5], בצורה דומה לגלגל מים המשמש לייצור חשמל מאנרגיה מכנית, כך שבמעבר דרכו הם מסובבים את ראש החלבון הלוחץ בצורה מכנית על המולקולות ADP+ ו Pi הגורם להם להתרכב יחד למולקולה אחת. בסוף התהליך הפרוטון משתחרר בצידה השני של הממברנה. התהליך הכימופיזיקלי של התמרת אנרגיה באמצעות מעבר פרוטונים דרך ממברנה כתוצאה מהפרשי ריכוזי יונים קרוי כימואוסמוזה[6]. על גילוי המנגנון קיבל בשנת 1978 הביוכימאי פיטר מיטשל פרס נובל[7], כאשר עד לגילויו של מיטשל התאוריה הרווחת הייתה שה-ATP נוצר במיטוכונדריה באמצעות זרחון ישיר של PO3 במצע עשיר בזרחן, ולא באמצעות כימואוסמוזה.
שרשרת מעבר אלקטרונים ביוקריוטים[עריכת קוד מקור | עריכה]
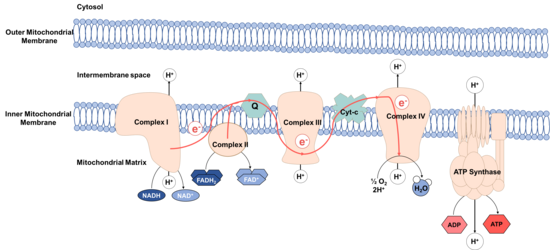
המנגנון היוצר את הפרש ריכוזי יוני המימן בין קרומי המיטוכונדריה קרוי שרשרת מעבר אלקטרונים. בתהליך מולקולות המחוזרות במעגל קרבס כמו FADH2 ו-NADH נקראות נשאי אלקטרונים, זאת כיוון שבתהליך החיזור הם נטענו באנרגיה פוטנציאלית גבוהה וכדי להגיע למצבם היציב הם נוטות להעביר אלקטרונים למולקולות איתם הם נמצאות בריאקציה. במהלך מסירת האלקטרון בריאקציה בין נשאי האלקטרונים לחלבונים הנמצאים בממברנה, מועברים פרוטונים (יוני מימן) בין צידי הממברנה נגד מפל הריכוזים לתוך המרווח הבין קרומי של המיטוכונדריה תוך שימוש באנרגיה הנפלטת מנשאי האלקטרונים. האלקטרונים עוברים דרך חלבונים שונים בממברנה ובסופו של דבר נקלטים על ידי אטומי חמצן אטמוספירי המתרכבים יחד ליצירת מים. אנרגיית הפרש הריכוזים של היונים מומרת לאנרגיה מכנית לפי המנגנון הכימיואוסמוטי ב-ATP סינתאז המקובע בתוך ממברנת המיטוכונדריה הפנימית, הלוחץ באופן מכני את מולקולות ה ADP+ ו- Pi עד להתרכבותם לכדי מולקולת ATP.
-
תרשים המתאר את השרשרת במיטוכונדריון:
תוצרים מחוזרים המגיעים ממעגל קרבס מעבירים אלקטרונים לחלבונים בממברנה,
היוצרים הפרש הריכוזים של יוני המימן על הממברנה התוך מיטוכונדריאלית.
התהליך מסתיים בזרימתם של האלקטרונים חזרה דרך האינזים ATP סינתאז,
המייצר ATP באמצעות האלקטרונים העוברים דרכו.
מתווכי העברת אלקטרונים[עריכת קוד מקור | עריכה]
בשרשרת מעבר האלקטרונים מצויים בין הקומפלקסים השונים מספר מתווכים אשר משמשים אמצעי לשינוע האלקטרונים בין קומפלקס אחד למשנהו.
קו-אנזים Q10[עריכת קוד מקור | עריכה]
 ערך מורחב – קו-אנזים Q10
ערך מורחב – קו-אנזים Q10
קו-אנזים Q10 או יוביקינון הוא מולקולה הנמצאת על הממברנה הפנימית של המיטוכונדריה ומשמשת כמתווך המעביר אלקטרונים בין קומפלקס אחד לקומפלקס שלוש ובין קומפלקס שניים לקומפלקס שלוש. מבכינה כימית המולקולה מכילה ראש פולארי היכול להימצא בשלושה מצבי חמצון שונים. המחומצן ביותר, כאשר החמצנים מחוברים בקשר כפול אל הטבעת. השני, כאשר חמצן אחד נמצא בקשר עם מימן, ואילו החמצן השני נמצא בצורה רדיקלית. במצב המחוזר ביותר, שני החמצנים שבראש הפולארי מחוברים למימן. במצב זה ניתן להגיד שהמולקולה נמצאת בצורתה הכהלית, ובשל כך בנומנקלטורה יוביקינון כוהלי מקבל את הסיומת נול המשמש לציון כהלים. אל הראש הפולארי מחובר זנב פחמני הידרופילי ארוך, המקנה למולקולה את היכולת לנוע בתוך הממברנה הליפידית.
ציטוכרום C[עריכת קוד מקור | עריכה]
 ערך מורחב – ציטוכרום
ערך מורחב – ציטוכרום
ציטוכרום C הוא שם פוליפפטיד המכיל קבוצת הם כקו-פקטור. האתר הפעיל בחלבוני הציטוכרום הוא אטום הברזל שנמצא על קבוצת ההם. הברזל מסוגל להימצא בשני מצבי חמצון שונים: +Fe2 (מחוזר) ו-+Fe3 (מחומצן). הברזל המחומצן מסוגל לקלוט אלקטרון בודד מהסביבה, ואילו הברזל המחוזר מסוגל למסור אלקטרון לסביבה. יכולתו הן לחזר והן לחמצן הופכת אותו למתווך יעיל של תהליכי חמצון-חיזור בתא.
-
מעבר לצורה הכהלית מ-Q ל-QH2.
-
Ubisemichinon, הצורה הרדיקלית של יוביקינון Q.−
-
ציטוכרום C בירוק אשר במרכזו קבוצת הם.
הקומפלקסים הממברנלים[עריכת קוד מקור | עריכה]
שרשרת מעבר האלקטרונים מורכבת מארבעה קומפלקסים חלבוניים אשר מעבירים את האלקטרון מאחד לשני ומניעים את התהליך. בנוסף לקומפלקסים נמצאת התעלה ATP סינתאז המייצרת את ה ATP. לשרשרת שתי נקודות התחלה, קומפלק אחד וקומפלקס 2.
-
הקומפלקסים המשתתפים בשרשרת מעבר האלקטרונים
קומפלקס I[עריכת קוד מקור | עריכה]

קומפלקס I או NADH-coenzyme Q oxidoreductase, הוא החלבון הראשון בשרשרת מעבר האלקטרונים[8]. קומפלקס זה הוא בעצם אנזים ענקי, אשר אצל יונקים מגיע למשקל באזור אלף קילו-דלטון, שמכיל בתוכו 46 יחידות משנה[9]. צורתו ברוב האורגניזמים דומה למגף, כך שישנה רגלית היוצאת מתוך ממברנת המיטוכונדריה אל עבר המטריקס המיטוכונדריאלי[10][11] ורגלית השוכנת בתוך הממברנה, נכון ל-2010 המבנה המדויק ידוע רק בבקטריות[12][13]. הגנים מקודדים את החלבונים של הקומפלקס נמצאים גם בד.נ.א המיטוכונדריאלי וגם בד.נ.א. הגרעיני.
הקומפלקס אחראי על חמצון מולקולת ה- NADH באמצעות קו-אנזים Q10 (יוביקיונון) שהוא בעצם מולקולה כימית המסיסה בשומן ולכן היא יכולה לנוע בחופשיות בתוך הממברנה הפנים מיטוכנדריאלית השומנית. בקומפלקס מתרחשת התגובה הבאה:
הריאקציה מתחילה (ובעקבותיה כל שרשרת מעבר האלקטרונים) כאשר מולקולת NADH נקשרת לקומפלקס ומעבירה שני אלקטרונים תוך פירוק ל +NAD ו-+H.האלקטרונים נכנסים למערכת בעזרת קו-פקטור בשם FMN (ריבופלאבין-5-פוספט). כאשר לאחר החיזור הוא נהפך לFMNH2 בשלב הבא האלקטרונים מועברים לסדרה של מקבצי ברזל-סולפיד[12] הן מסוג [2Fe–2S] והן מסוג [4Fe–4S]. במהלך הריאקציה מועברים פרוטונים מהמטריקס המיטוכנדריאלי לתוך החלל הבין קרומי, המחקר המודרני עדיין לא מצא איך התהליך מתרחש בדיוק, משערים כי בתהליך מתרחשים שינויים מבניים בקומפלקס I הגורמים לחלבון להיקשר לפרוטונים ולהעביר אותם את הממברנה[14]. לבסוף האלקטרונים מועברים משרשרת מקבצי הברזל-סולפיד למולקולת יוביקיונון אשר נמצא בממברנה הפנימית של המיטוכונדריה[8]. גם חיזור מולקולת היוביקיונון תורם להגדלת גרדיאנט הפרוטונים מאחר שהפרוטונים המעורבים בריאקצית החיזור נלקחים מתוך המטריקס המיטוכנדריאלי כדי ליצור את מולקולת היוביקיונול (QH2).

קומפלקס II[עריכת קוד מקור | עריכה]
קומפלקס II הקרוי Succinate-Q oxidoreductase מהווה נקודת כניסה שנייה לשרשרת מעבר האלקטרונים[15]. סוקצינט דהידרוגנאז הוא הקומפלקס היחיד בשרשרת אשר משמש גם כאחד האנזימים במעגל קרבס. מבחינה מבנית הוא מכיל ארבע תתי יחידות חלבוניות, קו-פקטור בשם FAD הקשור אליו, מקבצי ברזל-סולפיד ויחידת הם אשר לא משתתפת בהעברת האלקטרונים לקו-אנזים Q, ככל הנראה תפקיד קבוצה זו להפחית את הייצור של תוצרי חמצן ראקטיביים כדוגמת חמצן רדיקלי[16][17]. הקומפלקס לוקח מולקולת סוקצינט ומקטלז את חמצון המולקולה לפומרט תוך חיזור מולקולת ל-. מולקולת ה- מעבירה 2 אלקטרונים ל-Q. אשר נע בתוך הממברנה הפנימית לעבר קומפלקס 3. במהלך הריאקציה אותה מקטלז קומפלקס II לא מועברים פרוטונים לתווך הבין ממברנלי, והתגובה משחררת פחות אנרגיה ביחס לחמצון NADH.
ניתן לסכם את התגובה במשוואה הבאה:
ETF-Q[עריכת קוד מקור | עריכה]
קומפלקס III[עריכת קוד מקור | עריכה]
קומפלקס III או Q-cytochrome c oxidoreductase מהווה את השלב השלישי או השני בשרשרשת מעבר האלקטרונים[18]. ביונקים האנזים בנוי מדימר. כל אחת משתי יחידות הדימר מכילה אחת עשרה תתי יחידות חלבוניות, מקבץ ברזל גופרית מסוג [2Fe-2S] ושלושה ציטוכרומים, נשאי אלקטרונים בעלי קבוצת הם פרוסטטית: אחד מסוג c1 ושתיים מסוג b[19]. אטום הברזל בקבוצת יכול לעבור בין דרגות החמצון (+2) ו- (+3), ובמיטוכונדריה מנוצלת תכונה זו על מנת להעביר את האלקטרונים. התגובה אותה מזרז קומפלקס שלוש היא חמצון ה-QH2 שבא מהקומפלקסים הקודמים, וחיזור שתי מולקולות של ציטוכרום c תוך מסירת שני פרוטונים לתווך הבין ממברנלי. לכן המשוואה היא:
עם זאת, אלמנט שמסבך את המנגנון הוא העובדה שציטכרום c מסוגל לקבל רק אלקטרון אחד בכל פעם, בעוד QH2 מוסר שני אלקטרונים. על מנת לפתור בעיה זו האנזים מחלק את שני האלקטרונים הנמסרים בין ציטוכרום c, למולקולת Q הכלואה באנזים. מולקולה זו לאחר קבלת האלקטרון הנוסף הופכת להיות רדיקלית Q.− אך נשארת קשורה לאנזים. לאחר מכן מגיע עוד QH2 המוסר אלקטרון נוסף אל ציטוכרום c ואל Q.− שקוטף שני פרוטונים מהמטריקס המיטוכונדריאלי, הופך ל QH2 בחזרה ומשתחרר מן האנזים.
-
סרטון המדמה את פעילות קומפלקס 3
-
ניתן לראות את הקומפלקס. כאשר בצד שמאל הוא מוצג בחלק הראשון של המנגנון בו Q אינו רדיקלי, ובצד ימין מתואר חלקו השני של המנגנון בו Q רדיקלי מחוזר קוטף פרוטונים ומשתחרר לממברנה.

קומפלקס IV[עריכת קוד מקור | עריכה]
קומפלקס IV קרוי Cytochrome c oxidase והוא מהווה את השלב האחרון בשרשרת המעבר[20]. אצל יונקים האנזים מכל 13 תתי יחידות חלבוניות, שתי קבוצות הם ומספר יונים מתכתיים: שלושה אטומי נחושת, יון מגנזיום ויון אבץ[21]. האנזים מתווך העברת אלקטרונים אל חמצן תוך העברת זוג פרוטונים אל התווך הבין ממברנלי. תגובה כימית זו היא האחרונה בשרשרת העברת האלקטרונים. בריאקציה מתבצע חיזור של חמצן אטמוספירי, אשר מהווה את הגורם האחרון אליו מועברים האלקטרונים בשרשרת, למולקולת מים. החיזור של החמצן למים צורך שני פרוטונים נוספים מן המטריקס המיטוכונדריאלי, דבר התורם גם הוא להגברת הגרדיאנט הכימואוסמוטי. ניתן לסכם את הריאקציה אותה מזרז ציטוכרום C אוקסידאז באמצעות המשוואה הבאה:
ATP סינתאז[עריכת קוד מקור | עריכה]
ראו גם[עריכת קוד מקור | עריכה]
לקריאה נוספת[עריכת קוד מקור | עריכה]
Lehninger, J. (2005). Principles of biochemistry: Nelson, D., and Cox, M. Biochem. Mol. Biol. Educ.
| מטבוליזם | ||
|---|---|---|
| נשימה תאית | גליקוליזה • מעגל קרבס • זרחון חמצוני | |
| מסלולים נוספים | גלוקונאוגנזה • גליקוגנזה • גליקוגנוליזה • מסלול הפנטוז פוספט • מעגל קורי • מעגל האוריאה • חמצון בטא • תסיסה מעגל קלווין • מעגל הגליוקסילט • פוטוסינתזה • ניטריפיקציה | |
| תרכובות עיקריות | גלוקוז • פירובט • NAD • כלורופיל | |
| מגוון מטבולי | אורגניזם אווירני • אורגניזם אל-אווירני • הטרוטרוף • אוטוטרוף | |
קישורים חיצוניים[עריכת קוד מקור | עריכה]
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ Rich PR (2003). "The molecular machinery of Keilin's respiratory chain". Biochem. Soc. Trans. 31 (Pt 6): 1095–105. doi:10.1042/bst0311095. PMID 14641005.
- ^ Porter RK, Brand MD (1995). "Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes". Biochem. J. 310 (Pt 2): 379–82. doi:10.1042/bj3100379. PMC 1135905. PMID 7654171.
- ^ אולם ישנם גם מיקרואורגניזמים רבים שמבצעים זרחון חמצוני ונשימה אווירנית. ראו פרטים נוספים בערך אנארובי.
- ^ Dimroth P, Kaim G, Matthey U (1 January 2000). "Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases". J. Exp. Biol. 203 (Pt 1): 51–9. PMID 10600673. Archived from the original on 30 September 2007.
- ^ Schultz BE, Chan SI (2001). "Structures and proton-pumping strategies of mitochondrial respiratory enzymes". Annu Rev Biophys Biomol Struct. 30: 23–65. doi:10.1146/annurev.biophys.30.1.23. PMID 11340051.
- ^ Mitchell P, Moyle J (1967). "Chemiosmotic hypothesis of oxidative phosphorylation". Nature. 213 (5072): 137–9. Bibcode:1967Natur.213..137M. doi:10.1038/213137a0. PMID 4291593.
{{cite journal}}: תחזוקה - ציטוט: שימוש בפרמטר authors (link) - ^ הדף על פיטר מישל באתר פרסי נובל
- ^ 1 2 Hirst J (2005). "Energy transduction by respiratory complex I--an evaluation of current knowledge" (PDF). Biochem. Soc. Trans. 33 (Pt 3): 525–9. doi:10.1042/BST0330525. PMID 15916556.
- ^ Lenaz G, Fato R, Genova ML, Bergamini C, Bianchi C, Biondi A (2006). "Mitochondrial Complex I: structural and functional aspects". Biochim. Biophys. Acta. 1757 (9–10): 1406–20. doi:10.1016/j.bbabio.2006.05.007. PMID 16828051.
- ^ Baranova EA, Holt PJ, Sazanov LA (2007). "Projection structure of the membrane domain of Escherichia coli respiratory complex I at 8 A resolution". J. Mol. Biol. 366 (1): 140–54. doi:10.1016/j.jmb.2006.11.026. PMID 17157874.
- ^ Friedrich T, Böttcher B (2004). "The gross structure of the respiratory complex I: a Lego System". Biochim. Biophys. Acta. 1608 (1): 1–9. doi:10.1016/j.bbabio.2003.10.002. PMID 14741580.
- ^ 1 2 Sazanov LA, Hinchliffe P (2006). "Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus". Science. 311 (5766): 1430–6. Bibcode:2006Sci...311.1430S. doi:10.1126/science.1123809. PMID 16469879.
- ^ Efremov R.G., Baradaran R., & Sazanov L.A., (2010) The arcdhitecture of respiratory complex I, Nature 465, 441-445
- ^ Hirst J (January 2010). "Towards the molecular mechanism of respiratory complex I". Biochem. J. 425 (2): 327–39. doi:10.1042/BJ20091382. PMID 20025615.
- ^ Cecchini G (2003). "Function and structure of complex II of the respiratory chain". Annu. Rev. Biochem. 72: 77–109. doi:10.1146/annurev.biochem.72.121801.161700. PMID 14527321.
- ^ Yankovskaya V, Horsefield R, Törnroth S, Luna-Chavez C, Miyoshi H, Léger C, Byrne B, Cecchini G, Iwata S, et al. (2003). "Architecture of succinate dehydrogenase and reactive oxygen species generation". Science. 299 (5607): 700–4. Bibcode:2003Sci...299..700Y. doi:10.1126/science.1079605. PMID 12560550.
- ^ Horsefield R, Iwata S, Byrne B (2004). "Complex II from a structural perspective". Curr. Protein Pept. Sci. 5 (2): 107–18. doi:10.2174/1389203043486847. PMID 15078221.
- ^ Crofts AR (2004). "The cytochrome bc1 complex: function in the context of structure". Annu. Rev. Physiol. 66: 689–733. doi:10.1146/annurev.physiol.66.032102.150251. PMID 14977419.
- ^ Iwata S, Lee JW, Okada K, Lee JK, Iwata M, Rasmussen B, Link TA, Ramaswamy S, Jap BK (1998). "Complete structure of the 11-subunit bovine mitochondrial cytochrome bc1 complex". Science. 281 (5373): 64–71. Bibcode:1998Sci...281...64I. doi:10.1126/science.281.5373.64. PMID 9651245.
- ^ Calhoun MW, Thomas JW, Gennis RB (1994). "The cytochrome oxidase superfamily of redox-driven proton pumps". Trends Biochem. Sci. 19 (8): 325–30. doi:10.1016/0968-0004(94)90071-X. PMID 7940677.
- ^ Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S (1996). "The whole structure of the 13-subunit oxidized cytochrome c oxidase at 2.8 A". Science. 272 (5265): 1136–44. Bibcode:1996Sci...272.1136T. doi:10.1126/science.272.5265.1136. PMID 8638158.