HPLC
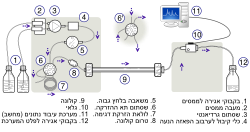
כרומטוגרפיה נוזלית בביצוע גבוה (באנגלית: High Performance Liquid chromatography), ובקיצור HPLC, שנקראת גם כרומטוגרפיה נוזלית בלחץ גבוה (באנגלית: High Pressure Liquid Chromatography), היא טכניקה אנליטית מתקדמת המבוססת על עקרונות הכרומטוגרפיה הנוזלית, שהיא שיטת הפרדה של חומרים, שמתרחשת ביעילות גבוהה בתוך מערכות מתקדמות מבחינה טכנולוגית[1][2].

מכשירי HPLC נגישים כיום לכל מעבדה כימית לשם בדיקות כימיות לקביעה של כמויות חומרים שונים ולזיהוים בשטחי מחקר מדעי שונים, בתהליכי פיתוח וייצור שונים בתעשייה הכימית ובאקדמיה, וכן במעבדות ממשלתיות ובמעבדות התעשייה הרוקחית, תעשיית המזון, הכימיה ותעשיות נוספות.
עקרון פעולה
[עריכת קוד מקור | עריכה]הקביעה הכמותית והזיהוי של החומרים הנבדקים נעשית כאשר הם המוכנסים אל המכשיר כדוגמאות נוזליות, מופרדים, ואז מתגלים בעזרת גלאים ל-HPLC, שעוזרים לזיהוי שלהם. הדיווח על כך נעשה בצורה ממוחשבת. התהליך המתרחש הוא כרומטוגרפיה נוזלית בלחץ גבוה מאוד. הדוגמאות עם החומרים הנבדקים מוכנסות לעמדת הזרקה, משם הן מועברות אל תוך תווך זורם שמעביר אותם אל עמודה גלילית (קולונה Column אנ') הארוזה בחלקיקים נייחים שמרכיבים את הפאזה הנייחת (Stationary Phase). קוטר החלקיקים האלה נע בין כ-2 מיקרומטר עד כ־10-20 מיקרומטר, תלוי במטרת העבודה. התווך הזורם נקרא פאזה הנעה (Mobile phase), שהיא תמיסה נוזלית בהרכבים כימיים שונים. הפאזה הנעה זורמת כל הזמן דרך כל מרכיבי המערכת הכרומטוגרפיית וההרכב שלה משפיע על מידת הנדידה השונה של כל אחד ממרכיבי הדוגמה דרך העמודה, ובכך היא מסייעת להפריד ביניהם. גם ההרכב הכימי של הפאזה הנייחת, כלומר חלקיקי העמודה הכרומטוגרפית, משפיע על מידת ההשהייה של כל מרכיב ומרכיב בדוגמה הנבדקת. לאחר ההפרדה החומרים מופיעים בזמנים שונים זה מזה בגלאים הייעודיים שמאפשרים את חישוב הכמות שלהם וקביעת הזהות שלהם, כפי שמתואר בספר Liquid chromatography detectors[3].

כפי שניתן לראות בציור בו יש סכימה של המערכת הכרומטוגרפית, המכשיר בנוי ממשאבה ששואבת תערובת ממסים בהרכב ידוע ומדויק של הפאזה הנעה, שזורמת ללא הפסק דרך כל מרכיבי המערכת. קצבי הזרימה ב-HPLC אנליטי הנפוץ ביותר הם בסביבות 1 מ"ל לדקה, ויש גם שימושים אחרים במיקרו/ננו HPLC בקצבי זרימה נמוכים מזה בהרבה (מיקרוליטרים לדקה). כאשר המכשיר משמש לניקוי חומרים הוא נקרא HPLC פרפרטיבי - Preparative ואז הוא יכול להגיע לקצבי זרימה של ליטרים לדקה. הפאזה הנעה הנדחפת על ידי המשאבה, עוברת קודם כל דרך מערכת הדגימה וההזרקה, שדוגֶמת נפח מדויק מאוד מהדוגמה, ואז היא מעבירה אותו אל העמודה הכרומטוגרפיית (הקולונה) הארוזה בגרגרי הפאזה הנייחת ובדרך כלל נמצאת בתוך תנור ששומר על הטמפרטורה שלה קבועה. נדרשים לחצים גבוהים מאוד במשאבה כדי להזרים את הפאזה הנעה דרך העמודה הכרומטורפית, מכאן שם הטכניקה. מרכיבי הדוגמה מתעכבים בתוך העמודה בקצב שונה כל אחד לפי המבנה הכימי שלו, דבר שגורם להפרדתם זה מזה. משם הם מועברים על ידי הפאזה הנעה אל הגלאי, שמגלה אותם ועוקב אחרי יציאתם מבחינת זמנים וכמויות שלהם.
תמונה של מערכת HPLC אמיתית נפוצה, קיימת ועובדת, על פירוט חלקיה נמצאת בציור המצורף כאן.

הכימיה של ההפרדה מתוארת בספר HPLC columns: theory, technology, and practice[4]. החומר ממנו בנויה הפאזה הנייחת נקרא גם 'מצע' (support). בין שתי הפאזות האלה יש הבדלים בתכונות הפיזיקליות-כימיות (לדוגמה, באופן הנפוץ ביותר הפאזה הנייחת היא הידרופובית והפאזה הנעה היא הידרופילית) המונעים מהן להתערבב. הפאזה הנעה זורמת כל הזמן ללא הפסקה דרך כל מרכיבי המערכת, כולל גם הדוגם והגלאי. הדוגמה שעומדת לעבור אנליזה מוכנסת לדוגם, וממנו עוברת מנה קבועה ממנה אל זרם הפאזה הנעה היישר אל העמודה הכרומטוגרפית. בתוך העמודה כל אחד ממרכיבי התערובת נמשך לפאזה הנחה בעוצמה שונה עקב שוני בתכונות הפיזיקליות או הכימיות שלו. לכן הפאזה הנחה מעכבת כל מרכיב במידה שונה על ידי הצמדה זמנית שלו אליה, מכאן שלכל מרכיב מהירות שונה, ולכן זמן השהות שלו במערכת שונה. כלומר, מרכיבי התערובת יוצאים מהקולונה בזמנים שונים, ובכך מופרדים.
בקצה הקולונה יש צינור שמוביל אל מתקן שנקרא גלאי (בגרסה הנפוצה בשימוש הגלאי הוא ספקטרופוטומטר הפועל באורכי הגל של אור נראה ואור אולטרא סגולי) שתפקידו לעקוב אחרי כל מרכיב ומרכיב, ולאתר את רגע היציאה שלו, ובעזרת שעון פנימי. המערכת מציינת את זמן השהות של החומר בקולונה, והוא נקרא זמן השהייה Retention Time. החומרים מתגלים בצורה של שיאים - Peaks - (פיקים) בתוך גרף שנקרא כרומטוגרמה - Chromatogram. זמן יציאתו של השיא שמייצג את החומר המסוים מאפשר זיהוי ראשוני של החומר וגובהו מאפשר חישוב כמותו, כפי שניתן ללמוד מתוך הספר Quantitative analysis using chromatographic techniques[5][6].
סוגי השיטות ב-HPLC
[עריכת קוד מקור | עריכה]היפוך פאזות
[עריכת קוד מקור | עריכה]הרוב המוחלט של הפרדות ואנליזות בעזרת HPLC כיום נעשה באופן הכרומטוגרפי (chromatographic mode) שנקרא היפוך פאזות[7] - Reversed Phase . בשיטת ה-Reversed Phase החומרים מתעכבים במערכת ככל שהם הידרופוביים יותר. לשם ההשהייה של החומרים האורגניים הפאזות הנחות הארוזות בתוך העמודות (קולונות - columns) הן מצע הידרופובי, שמורכב בעיקר מגרגרים נקבוביים של סיליקה ג'ל בצורות שונות, בעיקר כדוריות (spherical), בקטרים שונים (2, 3, 5, 7, 10 מיקרומטר) ובקוטר נקבוביות משתנה (60, 100, 150, 300, אנגסטרם), שעל שטח פניו קשורים כימית פחמימנים שונים כמו C3, C4, C8, C18 ועוד. יש גם מצעים הידרופוביים פולימריים המשמשים כפאזות נחות כאשר יש צורך בתמיסות ב-pH קיצוני או מצעי הכלאות של סיליקה עם קבוצות אורגניות. ברוב השיטות הקיימות כיום להפרדת חומרי רפואה משתמשים בקולונות מטיפוס C-18 שנקראות לעיתים בשמות מסחריים כמו ODS (Octadecylsilane) או RP-18. ככל שהפחמימן שקשור לפאזה הנייחת ארוך יותר כך מתעכבים יותר מרכיבי הדוגמה ומתאפשרת ההפרדה ביניהם.
הפאזות הנעות הן תערובות של מים וממסים אורגניים פולאריים, ברובם המכריע מתנול ואצטוניטריל. התערובות הללו מכילות לרוב תוספים שונים כמו בופרים (אצטאט, פוספאט, ציטראט), או חומרים פעילי שטח (אלקיל-אמינים או אלקיל-סולפונאטים) או תוספים מיוחדים (EDTA). המטרה בשימוש בתוספים כאלו או אחרים היא הגברת היעילות או הסלקטיביות, ובעיקר השליטה בהשהיית המומסים.
הגורמים המשפיעים על מידת ההשהיה של מומסים במערכות ה-Reversed Phase הם כדלקמן:
- האופי הכימי של שטח הפנים של הפאזה הנחה שארוזה בקולונה
- סוג הממסים המרכיבים את הפאזה הנעה ויחסי נפחיהם, וכן התוספים שלהם
- ה-pH של הפאזה הנעה.
האופי הכימי של שטח הפנים של הפאזה הנחה
[עריכת קוד מקור | עריכה]האופי הכימי של פני השטח של הפאזה הנייחת נקבע על ידי סוג הפחמימן הקשור על פני הסיליקה ג'ל, על ידי מידת הכיסוי שלו (Bonding Density) ביחידות של umole/m2, על ידי איכות וטוהר הסיליקה ג'ל ועל ידי מרכיבים שונים של הפאזה הנעה הספוחים באופן קבוע על פניו. ככלל, ככל שמספר הפחמנים בפחמימן הקשור אל הסיליקה גדול יותר, כן גדלה יכולתו להשהות מומסים אורגניים בתנאי שמשווים בין אחוזי הכיסוי זהים. כלל נוסף הקשור באופי שטח הפנים של הפאזה הנחה הוא, שככל שגדול יותר מידת הכיסוי שלו על ידי הפחמימן, כך גדלה מידת ההשהיה של כל המומסים האורגניים. קולונות נחשבות להידרופוביות יחסית אם מידת הכיסוי עולה על umole/m2 3.
גורם חשוב באופי של שטח הפנים של העמודות הוא התוספים פעילי השטח, או במינוח המקצועי "יוצרי זוג-יונים" (Ion Pairing Reagents). אלה הם תוספים כמו אלקיל-אמינים (אנ') (triethylamine, tetrabutylamine או אלקיל-סולפונאטים (אנ') (dodecylsulfonate, heptyl, hexyl or octyl sulfonates), הנספחים על פני הפאזה הנחה ההידרופובית ומצפים אותה במטען חיובי (האמינים) או שלילי (הסולפונאטים). בצורה כזאת הם יכולים להשפיע מאוד על מידת ההשהיה של מומסים טעונים חשמלית.
הרכב הממסים של הפאזה הנעה – חוזק ממס (Modifiers and Solvent Strength)
[עריכת קוד מקור | עריכה]שני הגורמים משפיעים על זמני ההשהייה של מרכיבי הדוגמה, המומסים. אחד הוא סוג הממסים המרכיבים את הפאזה הנעה והשני הוא היחסים ביניהם. בהגדרה, ממס חלש גורם למרכיבי הדוגמה המומסים להשתהות יותר בעמודה, וממס חזק יותר גורם להם לנדוד מהר יותר ולצאת מוקדם יותר. בזכות זאת ניתן ליצור תערוכות ממסים שישפיעו באופן שונה על כל אחד ממרכיבי הדוגמה. ככלל, הממס החלש ביותר בשיטת היפוך הפאזות ה-Reversed Phase הוא המים, והוא גם הממס הפולארי ביותר. כשמוסיפים למים ממסים אורגניים כמו מתנול MeOH או אצוניטריל או איזופרופנול, מחזקים את כוח ההמסה של הפאזה הנעה ובכך מזרזים את זמני היציאה של מרכיבי הדוגמה. ככל שאחוז הממס האורגני במים גבוה יותר כך גם יורדים זמני ההשהייה.
pH של הפאזה הנעה
[עריכת קוד מקור | עריכה]כאשר מדובר בדוגמאות המכילות מומסים בעלי קבוצות פונקציונליות מיוננות, כמו אמינים, קרבוקסילטים, פוספאטים, פוספונאטים, סולפאטים וסולפונאטים, ניתן לשלוט בדרגת היינון של הקבוצות הללו בעזרת שימוש בבופרים בפאזה הנעה. קבוצות קרבוקסיליות במומסים מקבלות מטען יותר ויותר שלילי ככל שה- pH של הפאזה הנעה עולה מעל ל-pKa שלהן, ואז הן הופכות את כל המולקולה לפולארית יותר. כלומר, העלאת ה-pH של הפאזה הנעה מעל 4–5 = pH (שהוא תחום ה-pKa המקובל לקבוצות קרבוקסיליות) מורידה את מידת ההשהיה של חומרים המכילים קבוצות קרבוקסיליות, והפוך, שימוש בפאזה ענה ב-pH נמוך מ־4 יגביר את ההשהיה שלהם כי אינן מיוננות. לעומת זאת, חומרים המכילים קבוצות פונקציונליות בסיסיות כמו אמינים, שתחומי ה-pKa שלהם מעל 8, יתעכבו יותר ויותר ככל שיעלה ה-pH של הפאזה הנעה, ויתקרב ל־8 משום שהם פחות מיוננים, ולכן פחות פולריים. מאחר שבדרך כלל אסור להשתמש בעמודות Reversed Phase בפאזות נעות בעלות pH גבוה מ־8 והשליטה על מידת ההשהיה של אמינים בתחום זה היא מוגבלת.
כרומטוגרפית חילוף יונים
[עריכת קוד מקור | עריכה]כרומטוגרפית חילוף יונים (Ion Exchange Chromatography) מתוארת בספר Handbook of Ion Chromatography[8]. בעזרת סוג זה של כרומטוגרפיה מפרידים חומרים יוניים בתמיסות מימיות ממקורות סביבתיים, תעשייתיים וביולוגיים, כיום היישום הוא בעיקר לאניונים אי-אורגניים. האריזה בנויה ממצע גרגירי של סיליקה ג'ל או פולימרים, או הכלאה ביניהם, לכן היא מסוגלת לעמוד בלחצים גבוהים יחסית הנהוגים בטכניקת HPLC.

תהליך ההפרדה מתואר בסכימה המצורפת כאן. על פני שטח האריזה של הקולונה קשורות קבוצות פונקציונליות מיוננות חיובית (אמינים) או שלילית (סולפונאטים או קרבוקסילאטים), אליהן קשורים יונים נגדיים לאיזון חשמלי, למשל הוא יון נגדי לאמינים ו- הוא יון נגדי לקרבוקסילטים והסולפונאטים (אנ'). כאשר לדוגמה מגיעים מומסים טעונים שלילית אל הקולונה שעל פניה קשורות קבוצות אמיניות חיוביות עם יון נגדי שלילי, הם יוצרים במהלך נדידתם בקולונה קשר יוני עם הקבוצות החיוביות האלה, תוך כדי החלפת היונים הנגדיים השליליים שלהן, מכאן השם "חילוף יונים" – Ion Exchange. ככל שצפיפות מטענם של מרכיבי הדוגמה גדולה יותר כך הם מתעכבים יותר ומושגת ההפרדה ביניהם.
הקולונות הפולימריות מסוגלות לעמוד בתנאי pH קיצוניים, אך יש להן נטייה לתפוח או להצטמק לפי הרכב הפאזה הנעה, והן רגישות יותר ללחצים גבוהים. לעומתן קולונות מחליפי יונים המבוססות על סיליקה ג'ל עמידות בלחצים גבוהים, אך הן רגישות לתנאי pH קיצוניים, שדווקא הם נדרשים לעיתים קרובות.
מערכת ה-HPLC המתאימה לסוג זה של כרומטוגרפיה היא לעיתים קרובות אל-מתכתית בכל חלקיה, או בנויה ממתכת אל-חלד אינרטית או מטיטניום באיכות טובה, כדי שתוכל לעמוד בתנאים קיצוניים של חומצה ובסיס בפאזה הנעה. הגלאים הנפוצים ביותר הם גלאיי מוליכות חשמלית, אך גם יש שימוש לגלאים אלקטרוכימיים או גלאי ספקטרומטרית מסה בחלק מהשיטות. גלאי המוליכות מודד כל הזמן את מוליכות הפאזה הנעה, וכאשר מופיעים מומסים בעלי מוליכות שונה מזו של הפאזה הנעה מתקבל סיגנל. הסיגנל הוא חיובי, אם מוליכותם גבוהה מזו של הפאזה הנעה, או שלילי אם היא נמוכה ממנה. מאחר שהפאזות הנעות מורכבות בדרך כלל מבופרים, שיכולים להגיע לריכוזים גבוהים ולערכי pH קיצוניים, לעיתים יש צורך להשתמש באביזרי 'דיכוי' יונים Ion Suppression שמורידים את כמות היונים בפאזה הנעה בעלת המוליכות הגבוהה מדי, כדי לקבל אותות ניתנים לכימות מהמומסים.
כרומטוגרפיה בפאזה נורמלית - Normal Phase
[עריכת קוד מקור | עריכה]הכרומטוגרפיה נוזלית בפאזה נורמלית מתחלקת לשני סוגים, האחד מתרחש בסביבה אל-מימית[9] והשני בסביבה מימית[10].
כרומטוגרפיה בפאזה נורמלית - בסביבה אל-מימית
[עריכת קוד מקור | עריכה]כרומטוגרפיה בפאזה נורמלית - Normal Phase Chromatography[11] בסביבה אל-מימית[9] היא אחת מצורות ה-HPLC הראשונות שיוצרו, ידועה גם כרומטוגרפיית ספיחה. בשיטה זו הפרדת התערובת מתבצעת על בסיס הספיחה לפאזה הנחה, ההבחנה בין מרכיבי התערובת השונים נוצרת בעזרת הבדלי הקוטביות ביניהם, או הבדלים כימיים של פני השטח בינם לבין הפאזה הנחה.
בשיטה זו, הפאזה הנחה היא קוטבית - פולארית, המבוססת על סיליקה ג'ל ללא מתמירים או אלומינה, ואילו הפאזה הנעה היא לא קוטבית - א-פולארית, אל-מיימית, המבוססת על ממסים כמו הקסאן (Hexane) או הפטאן (Heptane) עם תוספים כמו אתנול ואיזופרופנול. לפיכך שיטה זו מתאימה בעיקר להפרדת מומס בסביבה בלתי-קוטבית. מרכיב הדוגמה נמשך, ולכן מעוכב על ידי, הפאזה הנחה הקוטבית. עוצמת הספיחה גדלה ככל שהמרכיב פולרי יותר.
נוסף על גודל הקוטביות, ישנם עוד גורמים המשפיעים על מידת המשיכה של מרכיבי הדוגמה: טיב קבוצות הקצה, ההפרעות הסטריות באנאליט. יוצא מכך שניתן להשתמש בשיטה זו להפרדת איזומרים מבניים.
כרומטוגרפיה בפאזה נורמלית - (HILIC) Hydrophilic Interaction Chromatography בסביבה מימית
[עריכת קוד מקור | עריכה]כרומטוגרפיה בפאזה נורמלית בסביבה מימית[10] היא כרומטוגרפיה מודרנית יותר שבה גם כן הפרדת התערובת מתבצעת על בסיס ספיחה לפאזה הנחה כאשר ההבחנה בין מרכיבי התערובת השונים נובעת מהבדלי הקוטביות שביניהם, או הבדלים מבניים. וגם כאן הפאזה הנייחת היא פולארית, מבוססת סיליקה ג'ל אי אורגנית או הכלאה עם קבוצות אורגניות. השוני כאן הוא בכך שהפאזה הנעה היא גם פולארית - קוטבית מאוד, ומבוססת על מים וממס נוסף בדרך כלל אצטוניטריל כממס עיקרי. המולקולות המופרדות הן בעיקר פולאריות מאוד, וההשהייה שלהן עולה ככל שהן פולאריות יותר, הן אינן מסיסות בממסים של הפאזה הנורמלית האל מימית אלא רק בפאזות מימיות שמצליחות להריץ אותן דרך הפאזה הנייחת הפולארית מאוד.
כרומטוגרפיית ניפוי על סמך גודל מולקולרי Size Exclusion Chromatography - SEC
[עריכת קוד מקור | עריכה]כרומטוגרפיית ניפוי על סמך גודל מולקולרי מתוארת בספר Size Exclusion Chromatography[12]. היא נקראת גם Gel Filtration Chromatography - GFC בעיקר בקרב מדעני מדעי החיים, ובקרב הכימאים האורגניים היא ידועה גם כ-Gel Permeation Chromatography - GPC. סוג זה של כרומטוגרפיה נועד להפריד חומרים גבוהי משקל מולקולרי, פולימרים, בעזרת עמודות - קולונות עשויות מג'ל מיוחד שמסנן אותם לפי גודלם כפי שמתואר בספר Column Handbook for Size Exclusion Chromatography[13]. עמודה קלאסית טיפוסית היא בעלת אורך צינור של 25–30 ס"מ וקוטרו כ־3-10 מ"מ ארוזה בגרגרים בקוטר של 5–10 מיקרומטר, עשויים מג'ל מיוחד בעל נקבוביות גדולות מאוד. אריזת הקולונות משמשת כמעין נפה להבחנה בין מולקולות על פי גודלן. קוטר נקבוביות האריזה קובע איזה תחום משקלים מולקולריים תפריד הקולונה. כאשר החומרים בעלי המשקל המולקולרי הגבוה יותר לא מצליחים לחלחל דרך החלקיקים של אריזת העמודה הכרומטוגרפית, הם עוקפים את הגרגירים שבה וזורמים עם הפאזה הנעה שבין הגרגירים ויוצאים בזמן קצר יותר מאשר אלה שמצליחים לחלחל אל תוך חלקיקי האריזה ולעבור דרך ארוכה יותר. לכן סדר זמני היציאה הוא שקודם יוצאים החומרים הגדולים ואחריהם הקטנים יותר לפי סדר המשקלים המולקולריים.
כדי להרחיב את תחום המשקלים המולקולריים הניתנים לאנליזה מנמוכים מאוד, למשל כמה אלפים בודדים, עד לגבוהים מאוד, למשל מאות אלפים, נהוג לעיתים קרובות להשתמש במערך של קולונות בעלות אריזה בנקבוביות בגדלים שונים קשורות זו לזו בטור. כאשר מדובר בפולימרים בעלי פעילות ביולוגית, בדרך כלל הפאזות הנעות הן מימיות, ואילו כאשר מדובר בפולימרים סינתטיים וחומרים פלסטיים הפאזות הנעות בדרך כלל הן אל-מימיות. בדרך כלל מטרת ההפרדה היא לקבוע משקל מולקולרי, או יותר נכון פיזור המשקל המולקולרי של המומסים (Molecular size distribution).
הגלאים בהם משתמשים הם בעיקר גלאיי מקדם שבירה: Refractive Index (RI), בשל העובדה שפולימרים ביולוגיים כמו פוליסכרידים, או פולימרים אורגניים תעשייתיים הם חסרי בליעת אור בתחום ה-UV, אך נותנים תגובה טובה ורגישה מספיק בגלאי מקדם שבירה. כדי לגלות ולכמת חומרים פולימריים בעזרת גלאי מקדם השבירה, צריך להתקיים התנאי הבא: חייב להיות הפרש משמעותי בין ערך מקדם השבירה RI של הפאזה הנעה הנקייה לבין ערך מקדם השבירה RI של החומר המומס בתוך אותה הפאזה הנעה. כלומר ערך ה- ΔRI בין תמיסת החומר בפאזה הנעה לבין הפאזה הנעה הנקייה צריך להיות גדול מספיק כדי שהגלאי יבחין בחומר ויציג אותו כפיק בכרומטוגרמה[14].
כדי לקבוע פיזור משקל מולקולרי של מומסים חייבים קודם לכן לכייל את המערכת בעזרת חומרים ידועים, סטנדרטים, שמשקלם המולקולרי מוגדר וידוע, כמתואר בציור המצורף כאן.

הכיול נעשה כך שבונים גרף כיול שמקשר את זמני ההשהיה של קבוצת הסטנדרטים למשקלם המולקולרי. לאחר שקשר זה ידוע, ניתן להזריק למערכת חומרים שאינם ידועים ולקבוע את משקלם המולקולרי לפי זמני ההשהיה שלהם.
התשובה הסופית לאפיון משקלים מולקולריים של פולימרים ניתנת בדרך כלל ב"פיזור המשקל המולקולרי" שהוא בעצם פונקציה המתארת את הכמות היחסית של כל משקל מולקולרי, והיא מוצגת כמערך של המומנטים של הפיק המתאר את הפיזור הזה:
1st Moment = Mn (Number Average)
2nd Moment = Mw (Weight Average)
3rd Moment = Mz (Z Average)
4th Moment = Mz+1 (Z+1 Average)
Mw/Mn = Polydispersity
ככל שערך ה-Polydispersity גבוה יותר מ־1 החומר מורכב מאוכלוסייה בעלת פיזור גדול יותר של משקלים מולקולריים. המומנטים האלה קשורים גם לתכונות פיזיקליות של הפולימרים.
מאחר שזמני ההשהיה במכשיר כזה חייבים להימדד במדויק, כי מחשבים מהם משקל מולקולרי, יש חשיבות רבה מאוד לרמת הביצועים של מכשיר ה-HPLC בשמירה על קצב זרימה קבוע ומדויק. זמני ההשהיה מתייחסים ל-log MW, כלומר, בתנאים מסוימים שינוי ב־1% של קצב הזרימה יעלה או יוריד עד כ־10% מהמשקל המולקולרי של המומס. אחת הדרכים המקובלות להתמודד עם אי-דיוקים של משאבות ה-HPLC בעבודה עם GPC היא שימוש בחומרי ייחוס שנותנים פיק ייחוס (Reference Peak). בוחרים חומר שמופיע בסופה של הכרומטוגרמה ונותן אפשרות לנרמול של זמן ההשהיה. איפוס הגלאי נעשה על ידי מדידת הסיגנל שלו כאשר הפאזה הנעה ממלאת את שני התאים שבו, של הייחוס ושל הדוגמה. ואז, כאשר מגיע מומס אל תא הזרימה של הדוגמה הוא גורם לשינוי במקדם השבירה של האור העובר דרכו, וגורם להופעת סיגנל חיובי או שלילי, תלוי אם הוא מעלה או מוריד את מקדם השבירה. הסיגנל הזה הוא פרופורציונלי לריכוז הדוגמה. מאחר שמקדם השבירה רגיש ביותר לטמפרטורה חשוב מאוד להקפיד שהגלאי מצויד באמצעים שונים לשמירה טובה של טמפרטורות תאי הזרימה. בדרך כלל אחת הסיבות הנפוצות ביותר לחוסר היציבות של האותות בגלאים אלה (שמתבטא ב-Noise and drift של קו הבסיס - baseline) היא המבנה הלוקה בחסר של אמצעי השמירה על הטמפרטורה. כמו כן יש לוודא שהקולונות נמצאות בתנור השומר על הטמפרטורה, ומצויד באלמנט מחליף חום כדי שהתהליך כולו יתרחש בטמפרטורה אחידה.
המשקלים המולקולריים המתקבלים הם יחסיים בלבד לפי ההרכב הכימי של הסטנדרטים בהם השתמשו לכיול. לשם קבלת משקלים מולקולריים מוחלטים יש להשתמש בשיטות אפיון וגילוי נוספות כמו מד-צמיגות או מד פיזור אור, כפי שמתואר בספר Light Scattering, Size Exclusion Chromatography and Asymmetric Flow Field Flow Fractionation: Powerful Tools for the Characterization of Polymers, Proteins and Nanoparticles[15]. יש לזכור שאם מחברים כמה גלאים בטור חייבים להביא בחשבון את הזמן שנדרש לחומר הנבדק לעבור ביניהם, מה שמכונה Delay - עיכוב[16].
שימושים
[עריכת קוד מקור | עריכה]הספר Modern HPLC for Practicing Scientists[1] מתאר שימושים נרחבים בטכניקת HPLC שנחשבת לטכניקה אנליטית מדויקת שיכולה לאתר ולכמת מרכיבים רבים (גם מאות מרכיבים) בבת-אחת, בריכוזים נמוכים מאוד. חסרונותיה הם עלות מיכשור גבוהה יחסית, וצורך מתמיד בתחזוקה. תודות ליתרונותיה הטכניקה משמשת בתעשיות שונות המשתמשות בתערובות בעלות מרכיבים רבים, כמו מזון, נפט, ביוטכנולוגיה ובמיוחד היא נפוצה בתעשיית התרופות שבה נדרש דיוק רב.
ל-HPLC שימושים רבים בתחומי תעשייה ומחקר שונים.
- השימוש הנרחב ביותר של HPLC הוא בתעשיית התרופות[17][18][19] - בתעשייה זו רשויות המדינות המעניקות אישורים לייצור, הפצה, ומכירה של תרופות (כמו מנהל המזון והתרופות האמריקני, ה-FDA) דורשות פיקוח הדוק על כל מרכיבי התרופות. אחת הדרכים לקבוע אילו מרכיבים תרופה מכילה ומה ריכוזם היא הפרדה ב-HPLC. היתרונות בשיטה זו הם היכולת לנטר מרכיבי דוגמה בריכוזים נמוכים (בניגוד למשל לגרווימטריה), ולנטר מאות מרכיבים בעת ובעונה אחת בניסוי אחד (בניגוד למשל לספקטרוסקופיה) בשילוב עם גלאיי מס ספקטרומטריה.
- בתעשיית הנפט (פטרוכימיה) - נפט אינו חומר אחיד, אלא נכרה מהאדמה כתערובת בת מאות מרכיבים (ולפעמים אף אלפים), שהרכבה משתנה על פי מיקום גאוגרפי ועומק השאיבה. לכן נוצר צורך לאפיין את הרכב התערובת של הנפט הנשאב. גם כאן יתרון ל-HPLC, משום שהיא מפרידה את כל מאות המרכיבים בניסוי אחד, ויותר מכך, כמעט כל מרכיבי הנפט הם הידרופוביים, לפיכך כרומטוגרפיה בפאזה נורמלית יעילה מאוד להפרדתם.
- בתעשיית המזון[20] - לדוגמה, אחת הדרכים המקובלות לאפיון קפה היא HPLC, משום שגם קפה היא תערובת בת מאות מרכיבים שהרכבה משתנה מאזור גאוגרפי למשנהו. גם דרכי העיבוד של קפה מנוטרות בעזרת HPLC, כך למשל, מודדים את כמות הקפאין שנותרה בקפה "נטול קפאין. כפי שניתן לראות בספר Food Analysis by HPLC יש מאות שיטות לקביעת מרכיבים במזון טבעי או מתועש בעזרת HPLC.[20]
- HPLC מצוי גם בשימוש המדע הפורנזי[21][22], כלומר בשירות המעבדות לזיהוי פלילי של המשטרות בעולם. לדוגמה, בפעולתן של המשטרות לאכיפת פקודת הסמים הן ניצבות מול האתגר של הוכחה כי אבקה מסוימת היא סם המצוי בפקודה. לא זאת אף זאת, עליהם להביא ראיות שיהיו קבילות בבית המשפט. אחת השיטות שבהן משתמשת המשטרה היא אפיון הסם ב-HPLC. כלומר הבלש ממיס את הסם ובוחן אותו ב-HPLC, אחר כך בוחן גם דגימה מוכנה מראש של הסם אותו הוא חושד שגילה. אם מתגלה התאמה בשלש מרכיבים מן התערובת, הדבר קביל כהוכחה שלפנינו הסם החשוד.
ראו גם
[עריכת קוד מקור | עריכה]קישורים חיצוניים
[עריכת קוד מקור | עריכה]- High-performance Liquid Chromatography—Separations, Essentials in Modern HPLC Separations, 2013, Sciencedirect
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ 1 2 Michael W. Dong, Modern HPLC for Practicing Scientists, John Wiley & Sons, 2006
- ^ High Performance Liquid chromatography
- ^ Scott, Raymond P. W. (Raymond Peter William), 1924-2011., Liquid chromatography detectors, 2nd, completely rev. ed, Amsterdam: Elsevier, 1986, ISBN 978-0-444-42610-9
- ^ UD Neue, MZ El Fallah, HPLC columns: theory, technology, and practice, John Wiley & Sons, 1997
- ^ A. Hobson-Frohock, Quantitative analysis using chromatographic techniques, Endeavour 11, 1987-01, עמ' 163 doi: 10.1016/0160-9327(87)90221-3
- ^ Lloyd R. Snyder, Joseph J. Kirkland, John W. Dolan, Introduction to Modern Liquid Chromatography, John Wiley & Sons, 2011
- ^ Rosario LoBrutto, Yuri Kazakevich, Reversed‐Phase HPLC, 1, Wiley, 2007-01-22, עמ' 139–239, ISBN 978-0-471-68162-5. (באנגלית)
- ^ Joachim Weiss, Handbook of Ion Chromatography, Wiley Online Library, 2016-06-06 doi: 10.1002/9783527651610
- ^ 1 2 Veronika R. Meyer, Ch 9, Practical High-Performance Liquid Chromatography, John Wiley & Sons, Ltd, 2010, עמ' 159–172, ISBN 978-0-470-68842-7. (באנגלית)
- ^ 1 2 Joseph J Pesek, Maria T Matyska, A new approach to bioanalysis: aqueous normal-phase chromatography with silica hydride stationary phases, Bioanalysis 4, 2012-04, עמ' 845–853 doi: 10.4155/bio.12.39
- ^ Research gate - Normal phase Chromatography
- ^ Sadao Mori, Howard G. Barth, Size Exclusion Chromatography, Springer Science & Business Media, 1999-07-23, ISBN 978-3-540-65635-7. (באנגלית)
- ^ Chi-san Wu, Column Handbook for Size Exclusion Chromatography, Academic Press, 1999, ISBN 978-0-12-765555-0. (באנגלית)
- ^ הסבר מפורט ניתן בקישור הבא בפרק Introduction בעמוד 1–2: Waters 2414 Refractive Index Detector, 2008
- ^ Stepan Podzimek, Light Scattering, Size Exclusion Chromatography and Asymmetric Flow Field Flow Fractionation: Powerful Tools for the Characterization of Polymers, Proteins and Nanoparticles, John Wiley & Sons, 2011-04-20, ISBN 978-1-118-10272-5. (באנגלית)
- ^ Tips & Tricks GPC/SEC: Inter-Detector Delay, PSS-polymer.com
- ^ HPLC for pharmaceutical scientists, Hoboken, N.J.: Wiley-Interscience, 2007, ISBN 978-0-470-08795-4
- ^ McPolin, Oona., An introduction to HPLC for pharmaceutical analysis, Warrenpoint: Mourne Training Services, 2009, ISBN 0-9561528-0-5
- ^ Shulamit Levin, Pharmaceutical Sciences Encyclopedia, American Cancer Society, 2010, עמ' 1–34, ISBN 978-0-470-57122-4. (באנגלית)
- ^ 1 2 Leo M.L. Nollet, Food analysis by HPLC, 2, New York.Basel: Marcel Dekker, 2000
- ^ Forensic chemistry, Amsterdam, ISBN 978-0-12-800624-5
- ^ Shirley Bayne, Michelle Carlin, Forensic Applications of High Performance Liquid Chromatography, CRC Press, 2017-07-27, ISBN 978-0-429-25196-2. (באנגלית)


