אבולוציה של יוני מתכת במערכות ביולוגיות

האבולוציה של יוני מתכת במערכות ביולוגיות עוסקת בהתפתחות תהליכי חדירת יוני מתכת לתאי בעלי חיים, קשירתם לחלבוני התא ובשינויים האבולוציוניים של חילוף החומרים במערכות ביולוגיות שונות בעקבות החדירה. המתכות הנקשרות לחלבוני התא מכונות ביו-מתכות.[1] החלבונים קושרי המתכות מכונים מטאלופרוטאינים. תפקידם לשמש כקואנזימים לפעילות האנזימטית התוך-תאית. הקואנזימים נפוצים בכל האורגניזמים החיים.
יוני מתכות מאזנים את מפל החמצון-חיזור (Reductive potential) בתא החי על ידי העברה רציפה של אלקטרונים בתהליכים המטבוליים השונים של התא. ההשערה המדעית היא שמעל 40% מן ראקציות האנזימטיות נזקקות ליוני מתכת כקטליזטורים.[2] 30% מחלבוני התא הם חלבונים קושרי מתכות המכונים מטלומים (metallomes).[3] חשיפת יתר למתכות עלולה להוביל לתופעות של רעילות.[2] כניסת המתכות אל התאים ויציאת כמויות עודפות נעשית על ידי מערכות אנזימטית מורכבת. במהלך האבולוציה נוצר איזון בין האנזימים המייבאים את המתכות אל התאים, לבין אלה המייצאים את המתכות מן התאים לסביבה החיצונית וכן הסתגלות למתכות בריכוזים שונים.[4]
האטמוספירה הפרביוטית[עריכת קוד מקור | עריכה]
התקופה הפרביוטית (Prebiotic world) נחשבת לתקופה האבולוציונית השנייה של כדור הארץ והיא התרחשה לפני 4 מיליארד שנים. בתקופה זו שררו על פני כדור הארץ תנאים של חוסר חמצן. האטמוספירה הייתה מורכבת מדו-תחמוצת הפחמן וחנקן, כמויות מזעריות של גזים מחזרים של מתאן, אמוניה ומימן וכמויות אפסיות של חמצן.[5] לדעת חוקרים, התפתחות ראשית החיים על פני כדור הארץ התרחש על פי הסדר הבא: שלב הופעת ה-RNA שקדם להופעת ה-DNA ולהופעת החלבונים. תאוריה זו הקרויה בשם "עולם ה-RNA", והיא נשענת על יכולת מולקולות ה-RNA לשמור מידע תורשתי בדומה ל-DNA ויכולת לשכפל את עצמן ולזרז תגובות כימיות של חלבונים. לפי השערה זו, מולקולות ה-RNA נוצרו ראשונות וקדמו לפפטידים קושרי-המתכות.[6] הפפטידים הראשונים שהיו מעורבים בקשירת מתכות ובהולכת אלקטרונים קדמו לחלבונים הקדמוניים והם נוצרו לפני יותר מ-3.8 מיליארד שנים.[7] הפפטידים בעלי היכולת לקשור מתכות וה-RNA הובילו להתפתחות חלבונים מורכבים יותר.
ראשית החיים קשורה ליכולת של מקטעי חלבונים ראשוניים ליצור קשרים כימיים עם מתכות. המפגש בין החלבונים למתכות שהתאפשר לפני כמעט 4 מיליארד שנים בסביבה המכונה "המרק הקדום", סביבה מימית עשירה במולקולות אורגניות ומינרלים הניחה את התשתית להיווצרות חלבונים רבים. חוקרים טוענים שהתרכובות הקדומות האלה אפשרו את התפתחותם של החלבונים האחראים להובלת אלקטרונים בין אטומים שהפך לתהליך חיוני לקיומם של החיים עצמם. בתקופה הפרביוטית, הקרקע על פני כדור הארץ הייתה עשירה במימן גופרי. הסביבה החומצית של "המרק הקדום" אפשרה המסה של ברזל בהשוואה למתכות אחרות וקשירת יוני הברזל לחלבונים, בהתאם למודל של Irving–Williams series (אנ') בסביבה המחזרת ששרתה בתקופה הפרביוטית ויצירת מולקולות של חד-תחמוצת-הפחמן (Carbon monoxide) מדו תחמוצת הפחמן ויצירת הידרוציאניד (Hydrogen cyanide) מחנקן אטמוספירי התאפשרה הודות למתכות המעבר.
האטמוספירה ב"אסון החמצן"[עריכת קוד מקור | עריכה]
לפני 2.4 מיליארדי שנים החל תהליך של פליטת חמצן לאטמוספירה של כדור הארץ ב"אסון החמצן", בעקבות התפתחות חיידקי ציאנובקטריה[8] בעלי יכולת לבצע פוטוסינתזה. העשרת האטמוספירה בחמצן הובילה לזירוז חמצון גופרית לגופרות ולתחמוצת הגופרית ולזירוז המסת המתכות אבץ, נחושת, ניקל וקובלט על ידי הפיכתן לתחמוצות במי "המרק הקדום"[9] והגדלת זמינותן למערכות הביולוגיות של התאים.[10]
האבולוציה של קשירת המתכות לחלבוני התא[עריכת קוד מקור | עריכה]
חיוניות המתכות לתהליכים המטבוליים של התא מחיבת מנגנוני קשירה ואגירה במערכות תוך תאיות. תהליך זה מבטיח זמינות לאורך זמן. מחקרים[11] שנעשו בחלבונים קושרי המתכות ברזל, נחושת וניקל התמקדו באתרים המצויים במולקולות חלבונים. באתרים אלה זוהתה קבוצה קטנה של פפטידים בעלי מבנה דומה, על אף השוני של החלבונים עצמם. נמצא שאתרים קושרי מתכות מורכבים לרוב מיחידות מבניות קטנות החוזרות על עצמן. אותן אבני בניין נמצאו גם באזורים אחרים בחלבונים ולא רק באזורים קושרי מתכות ובחלבונים רבים נוספים. על סמך ניתוח המבנה של פפטידים שהתגלו כאופייניים לאזורים קושרי מתכות בחלבון, הסיקו החוקרים שהפעילות הביולוגית הראשונה של חלבונים הייתה כנראה הולכת אלקטרונים על ידי אותם הפפטידים קושרי המתכות. שאר התפקידים שהחלבונים ממלאים בתא החי התפתחו בשלבים מאוחרים יותר.

יונים של מתכות מצויים ברקמות של בעלי-חיים וממלאים תפקידים מגוונים במערכות ביולוגיות.[12] חלקם משתייכים לקבוצת מתכות המעבר (לפי הטבלה המחזורית): מגנזיום, מנגן, ברזל, אבץ, נחושות, ניקל, קובלט מעורבים במבנה תרכובות ההם בעל טבעת הפורפירין (Porphyrin) המאפשרת קשירת מתכות שונות ויצירת מטלואנזימים. מתכות נוספות המעורבות במערכות ביולוגיות הן: מוליבדן, סלניום, טונגסטן, ונדיום. המטלואנזימים מעורבים במחזוריות האלמנטים בטבע.[13]

מגנזיום[עריכת קוד מקור | עריכה]

מגנזיום מצוי בשפע בעולם החי כקטיון דו-ערכי בעיקר בציטופלזמה, בעצמות ובכלורופלסטים ומיעוטו נמצא גם בנסיוב.[14] ברקמות הוא מצוי בצורת מגנזיום-ATP,[15] כאחראי על מעברי האנרגיה[16] ומשמש כקו-פקטור ל-300 אנזימים אחראים על מגוון רחב של פעילויות ביוכימיות[17] ברקמות של החי והצומח. למגנזיום חשיבות רבה בתהליכים הביולוגיים של האורגניזם: פעילות שרירית ועצבית, ויסות לחץ הדם, ויסות ריכוז הגלוקוז בדם, סינתזה של חלבונים, גלוטטיון, DNA ו-RNA ותהליכי הפקת אנרגיה בפוספורילציה אוקסידטיבית וגליקוליזה.[18] יוני המגנזיום אחראים על ויסות המעבר הפעיל של יוני סידן ואשלגן בקרומי התא, בעל תפקיד מרכזי בתהליכי בניית השלד[19] ואחראי על קצב פעילות הלב.[20] באורגניזמים השייכים לפרוקריוטה ובצמחים המסוגלים לבצע פוטוסינתזה המגנזיום הוא יון מרכזי במבנה הכלורופיל,[21] פיגמנט המאורגן בטילקואידים (tylokoid) המצויים בכלורפלסטים.
מנגן[עריכת קוד מקור | עריכה]


המנגן כקטיון דו-ערכי הוא קו-פקטור חשוב בתהליכי הפוטוסינתזה. ההשערה היא שכבר בתחילת האבולוציה של תהליכי הפוטוסינתזה כשהאטמוספירה הייתה נטולת חמצן, יוני המנגן היוו מקור לאלקטרונים. בשלב התחלתי זה, התפתחה היכולת לנצל את אנרגיית השמש ליצירת חומרים אורגניים אשר היוו נידבך ביצירת אורגניזמים קדומים שקדמו לציאנובקטריה. בשלב האבולוציוני הבא התפתחו בחיידקי הציאנובקטריה הטילקואידים שהם מרכזים אנרגטיים לביצוע תהליכי הפוטוסינתזה.[22] תהליך זה הוביל להעשרת האטמוספירה בחמצן. האווירה על פני כדור הארץ הפכה מאל אווירנית לאווירנית.
היצורים הפרוקריוטים, נושאי הטילקואידים נבלעו על ידי יצורים אאוקריוטים בתהליכי אנדוסימביוזה. האנדוסימביוזה אפשרה את העברת תהליך הפוטוסינתזה מיצורים פרוקריוטים פשוטים ליצורים אאוקריוטים מורכבים, כגון אצות וצמחים מפותחים. המנגן המשמש כקו-פקטור באנזימים רבים ניתן להחלפה לקטיונים דו-ערכיים רבים אחרים, כגון, סידן, קובלט, נחושת, מגנזיום או אבץ. בתהליך הפוטוסינתזה, יוני המנגן מיצרים את הקומפלקס (Mn4O5Ca),[23] אינם ניתנים להחלפה על ידי מתכות אחרות.
תהליך הפוטוסינתזה שבו משתחררות מולקולות של חמצן גרם להופעת אורגניזמים המכונים ROS (Reactive oxygen species),[24] בעלי מנגנונים אנזימטיים המנטרלים את האפקט הרעיל של המטבוליטים: מימן אל-חמצני, פראוקסיד, רדיקל הידרוקסיל (hydroxyl radical) הנחשב לרדיקל חופשי. המנגן הוא קו-פקטור לאנזימים Mn-Dismutase[25][26] וקטאלזה[27] הממוקמים באברוני-התא, בכלורופלסטים, במיטוכונדריה בפראוקסיזומים ובקרום התא, שהתפתחו בשלבים המוקדמים של אבולוציית התאים. אנזימים אלה מנטרלים תוצרים רעילים הנוצרים בתהליכים המטבוליים של התא ועלולים לגרום לנזקים בלתי הפיכים למרכיבי תא חיוניים על ידי פגיעה בחלבונים, בחומצות הגרעין ובליפידים ותמותת תאים.
ברזל[עריכת קוד מקור | עריכה]

הברזל נחשב לאחת המתכות החשובות ביותר לתהליכים המטבוליים התאיים. הברזל הוא קו פקטור עיקרי בכל שלבי הנשימה התאית[28] במעבר אלקטרונים בין ברזל דו-ערכי לתלת-ערכי וההפך.
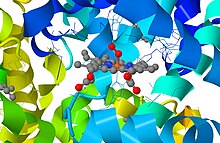

הקומפלקסים של ברזל-גופרית המתקשרים לחלבונים נחשבים למטלופרוטאינים הראשונים שנוצרו בתהליכי האבולוציה של הפוטוסינתזה.[29] אבולוציונית הם נוצרו מהתקשרות של פפטידים עם משקעים של מלחי Fe2(SO4)3(H2O)n. הפיכת הברזל הדו-ערכי לברזל-תלת ערכי והפוך הכרחיים לתהליכים ביולוגיים שונים ולתהליכי מחזור הברזל בטבע. הברזל מהווה מרכיב חשוב במערכות ביולוגיות שונות:[30] ציטוכרומים המצויים בקרום העוטף של המיטוכונדריון בכל האיקריוטים ואחראים להעברת אלקטרונים בתהליך הזרחון החמצוני, הקטאלזות האחראיות לפרוק מי-חמצן, המיוגלובין כנושא החמצן העיקרי בשרירים, ההם-פראוקסידזה (Haem peroxidase) המעורב בתהליך של קשירת החמצן להמוגלובין בתאי הדם האדומים, האנזים סינטאזה NOS (endothelial nitric oxide synthase) האחראי ליצירת תחמוצת החנקן מארגינין המשמש כמולקולת איתות (signaling molecule) בפרוקריוטה ואאוקריוטה,[31] והפריטין, חלבון נושא ברזל המצוי בציטופלזמה של תאים פרוקריוטים ואאוקריוטים, שתפקידו לווסת את ריכוז הברזל בתאים ולהבטיח זמינותו בכמויות רצויות לתפקוד האורגניזם. ויסות הפריטין נועד למנוע מחסור בברזל ונזקים כתוצאה מעודף ברזל.
ניקל וקובלט[עריכת קוד מקור | עריכה]
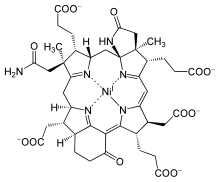
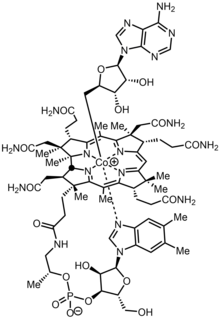
הניקל שריכוזו נמוך בקרקע, מהווה גורם חשוב בהתפתחות הקדומה של צורות חיים על פני כדור הארץ.[32] הטבעת הפורפירינית בעלת יכולת לקשור את המתכות ברזל, מגנזיום, ניקל וקובלט וליצור קו-אנזימים אחראים על מגוון רחב של תהליכים אנזימטיים בתא החי. יוני המתכות ניקל וקובלט מעורבים ביצירת מטלופרוטאינים. הניקל יוצר עם טבעת הפורפירין קומפלקס הקרוי (F-430), קו-אנזים מתיל רדוקטאזה (Methyl coenzyme M reductase) המשתתף בתהליך האנזימטי של שחרור גז המתאן. התוצאה של קשירת קובלט לטבעת הפורפירין היא יצירת קו-אנזים בעל חשיבות מטבולית גבוהה בשם ציאנקובלאמין (Cyancobalamine)[33] ההופך לוויטמין B12.[34]
נחושת[עריכת קוד מקור | עריכה]

הנחושת ויוני הנחושת נחשבים לקשי תמס ולכן לא היו זמינים לתאים הקדומים בראשית התהליך האבולוציוני. העשרת האטמוספירה בחמצן בתקופת "אירוע החמצן הגדול" אפשרה התמוססות נחושת אלמנטרית ויוני הנחושת החד-ערכיים והפיכתם ליונים דו-ערכיים ולהתהוות מטלופרוטאינים קושרי נחושת. מרבית האנזימים השייכים לקבוצת המטלופרוטאינים קושרי הנחושת מצויים באאוקריטה. רק מספר קטן של מטלופרוטאינים אלה נמצאים בפרוקריוטה, ציאנובקטריה וחיידקים אווירניים, דוגמת האנזים סופראוקסיד דיסמוטאז (SOD) על שלוש צורותיו: האנזימים Fe-SOD (קושר ברזל) ו-Mn-SOD (קושר מנגן) מצויים בכל הפרוקריוטה ובמיטוכונדריה של אאוקריוטה.
לעומת זאת, האנזים Cu-SOD (קושר נחושת) מצוי בציטופלזמה ובכלורופלסטים של האאוקריוטיה בלבד. שלושת האנזימים מקבוצת ה-SOD מפרקים מולקולות של סופראוקסיד הנחשב לרעיל למי חמצן. אלו מתפרקים בהמשך על ידי הקטלאזה לחמצן ומים. אנזימי ה-SOD והקטלאזה שומרים על התא בפני רעילותם של רדיקלי חמצון חופשיים.[35][36] מתכות נוספות הנקשרות לחלבונים שלא באמצעות טבעת ההם הן אבץ, מוליבדן, ונדיום.
אבץ[עריכת קוד מקור | עריכה]
האבץ הוא מתכת שחדרה לתאים החיים בשתי תקופות אבולוציוניות. בתקופה הראשונה, לפני 3–4 מיליארדי שנים, שררה אווירה אל-אווירנית על פני כדור הארץ, שבה האבץ הופיע כאבץ גופריתי. הסביבה החומצית של "הים הקדום" אפשרה לאבץ להתקשר למימן הגופריתי ולהפוך לאבץ גופריתי ולהתקשר לחלבוני תאים של מיקרואורגניזמים אל-אווירניים: פרוטאזות ונוקלאזות, אנזימים חוץ-תאיים, ולסינטטאזות, ודהידרוגנאזות שהן אנזימים תוך-תאיים.[37] בתקופת "אירוע החמצון הגדול", חל זירוז של חדירת אבץ למערכות הביולוגיות בממלכת הפרוטיסטה, בגלל זמינותו הגדולה.

לאבץ גם תפקיד חשוב באיזון המבנה המולקולרי של גורמי השעתוק המצויים באאוקריוטה (Transcription factor Sp1)[38][39] על ידי איזון קיפולי החלבון של גורמי השעתוק.
מוליבדן[עריכת קוד מקור | עריכה]

מוליבדן ויוני מוליבדן מצויים במרכזים פעילים של המטלואנזימים באורגניזמים רבים השייכים לארכאה, בקטריה, עובשים, צמחים ובעלי החיים, באנזימים האחראים על תהליכי הטרנספורמציה של פחמן, חנקן, גופרית, ארסן, סלניום וכלור בטבע, וכן של חומרים המכילים קבוצת קרבונילים, כגון אלדהידים, חד-תחמוצת-הפחמן ודו-תחמוצת-הפחמן.[40] מוליבדן משמש כקו-אנזים באנזימים מקבוצת הניטרוגנאזות (Nitrogenase) המכילים גם ברזל המצויים בחיידקים סימביוטים של צמחים, אחראים על קיבוע חנקן אטמוספירי והפיכתו לאמוניה, בתהליך המוביל לסינתזה של חלבונים. למוליבדן תפקיד חשוב גם במבנה של אנזימים המשתתפים במטבוליזם הגופרית המצויים במגוון רחב של אורגניזמים. בדומה לאבץ, המסת המוליבדן גברה בתקופת "אירוע החמצון הגדול" כאשר חלה האצה של הפיכת מוליבדן סולפיד למוליבדאט בעל מסיסות גבוהה יותר, הגברת חדירתו לתאים וקשירתו לאנזימים התוך-תאיים. הפיכת המוליבדן לקו-אנזים בתהליך האבולוציוני גרמה להיותו מתכת הכרחית לתהליכים ביולוגיים.
טונגסטן[עריכת קוד מקור | עריכה]

טונגסטן הוא אחת המתכות הקדומות ביותר שנקשרו למערכות ביולוגיות. בתקופה הפרביוטית הים הקדום היה עשיר בטונגסטן וגופרית ודל במוליבדן. לכן הטונגסטן חדר למערכות חיים ימיות. החיידק (Pyrococcus furiosus) השייך לארכאה, חי במקווי מים תרמיים חיידק אל-אווירני, אקסטרמופילי מתקיים בטמפרטורות שבין 70-103oC וזקוק לטונגסטן לקיומו. מכיל מספר אנזימים עמידים לחום מקבוצת הדהידרוגנאזות. מקבוצת ה-(Alcohol dehydrogenase) הם מטלואנזימים המכילים ברזל או אבץ וחמישה אנזימים מקבוצת אוקסידורדוקטזה (Oxidoreductase) מכילים ברזל, טונגסטן וגופרית.
ונדיום[עריכת קוד מקור | עריכה]
ונדיום גם הוא אחת המתכות הקדומות ביותר שנקשרו למערכות ביולוגיות. החיידק (Azotobacter vinelandii), מתג גראם שלילי אווירני, קושר חנקן על ידי חיזורו לאמוניה. התהליך מבוצע על ידי האנזים ניטרוגנאזה (Nitrogenase), באמצעות קו-פקטור המכיל יוני ברזל ומוליבדן. המוליבדן עשוי להיות מוחלף על ידי יוני ונדיום[41] על פי זמינות המתכות השונות. היותו של החיידק אווירני מעידה על תקופה התפתחותית בסביבת חמצן, המתאים לתקופת "אירוע החמצון הגדול" של לפני 2.4 מיליארדי שנים, ומקורב מבחינה גנטית לחיידק Pseudomona aeruginosa, השייכים למשפחה פסאודומונדה (Pseumonada).[42]
סלניום[עריכת קוד מקור | עריכה]

סלניום[43] משמש כקו-פקטור באנזימים רבים של הפרוקריוטה. אתר הפעילות שלו הוא סלניום-ציסטאין. הגנים האחראים ליצירת סלנופרוטאינים מצויים הן בעל-ממלכת הארכאה והן בעל-ממלכת הבקטריה.[44]
אבולוציה של פתוגניות בחיידקים[עריכת קוד מקור | עריכה]
התפתחות של פתוגניות של חיידקים מסוימים בגוף פונדקאי, תלויה בזמינותן של מתכות המאפשרות לפתח את אלימותם. במחקרים שנעשו על חיידקים שונים, כגון, Pseudomonas aeruginosa שהוא חיידק קומנסלי שעלול לההפך לפתוגני[45] בתנאים מסוימים. הפיכתו של החיידק לפתוגני מעודדת תחרותיות בינו לבין הפונדקאי על מתכות המעבר[46] ומאפשרת פיתוח יכולות לשימוש במתכת חיונית אחת במקומה של מתכת אחרת בהתאם לזמינותה במערכת.[4]
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ Christopher L. Dupont, Andrew Butcher, Ruben E. Valas, Philip E. Bourne, Gustavo Caetano-Anollés, History of biological metal utilization inferred through phylogenomic analysis of protein structures, Proceedings of the National Academy of Sciences 107, 2010-06-08, עמ' 10567–10572 doi: 10.1073/pnas.0912491107
- ^ 1 2 Emily Monosson, Evolution in a Toxic World, Washington, DC: Island Press/Center for Resource Economics, 2012, ISBN 978-1-59726-341-2. (באנגלית)
- ^ Michael S. Wang, Kenric J. Hoegler, Michael H. Hecht, Unevolved De Novo Proteins Have Innate Tendencies to Bind Transition Metals, Life 9, 2019-01-09, עמ' 8 doi: 10.3390/life9010008
- ^ 1 2 Kevin J. Waldron, Nigel J. Robinson, How do bacterial cells ensure that metalloproteins get the correct metal?, Nature Reviews Microbiology 7, 2009-01, עמ' 25–35 doi: 10.1038/nrmicro2057
- ^ Kevin J. Zahnle, Roxana Lupu, David C. Catling, Nick Wogan, Creation and Evolution of Impact-generated Reduced Atmospheres of Early Earth, The Planetary Science Journal 1, 2020-06-01, עמ' 11 doi: 10.3847/PSJ/ab7e2c
- ^ Ben K. D. Pearce, Ralph E. Pudritz, Dmitry A. Semenov, Thomas K. Henning, Origin of the RNA world: The fate of nucleobases in warm little ponds, Proceedings of the National Academy of Sciences 114, 2017-10-24, עמ' 11327–11332 doi: 10.1073/pnas.1710339114
- ^ Origin of Life: Study Reveals How Peptides Formed in the Early Earth, Inverse, 2019-07-11
- ^ William Martin, Michael J. Russell, On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells, Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences 358, 2003-01-29, עמ' 59–85 doi: 10.1098/rstb.2002.1183
- ^ אבני הבניין של החיים, באתר מכון דוידסון לחינוך מדעי, 2020-12-02
- ^ William Martin, Michael J. Russell, On the origins of cells: a hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells, Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences 358, 2003-01-29, עמ' 59–85 doi: 10.1098/rstb.2002.1183
- ^ Yana Bromberg, Ariel A. Aptekmann, Yannick Mahlich, Linda Cook, Stefan Senn, Maximillian Miller, Vikas Nanda, Diego U. Ferreiro, Paul G. Falkowski, Quantifying structural relationships of metal-binding sites suggests origins of biological electron transfer, Science Advances 8, 2022-01-14, עמ' eabj3984 doi: 10.1126/sciadv.abj3984
- ^ Robert J. P. Williams, Systems biology of evolution: the involvement of metal ions, BioMetals 20, 2007-04-01, עמ' 107–112 doi: 10.1007/s10534-007-9087-6
- ^ Peter M. H. Kroneck, The Biogeochemical Cycles of the Elements and the Evolution of Life, CRC Press, 2005, ISBN 978-0-429-16464-4
- ^ Office of Dietary Supplements - Magnesium, ods.od.nih.gov (באנגלית)
- ^ Elisabeth Gout, Fabrice Rébeillé, Roland Douce, Richard Bligny, Interplay of Mg 2+, ADP, and ATP in the cytosol and mitochondria: Unravelling the role of Mg 2+ in cell respiration, Proceedings of the National Academy of Sciences 111, 2014-10-28 doi: 10.1073/pnas.1406251111
- ^ Definition: magnesium from Online Medical Dictionary, web.archive.org, 2007-12-25
- ^ G. Webb, Modern Nutrition in Health and Disease, 9th edition. M. E. Shils, J. A. Olsen, M. Shike and A. C. Ross (editors). 1999. Baltimore: Williams & Wilkins. $105.00. ISBN 0-683-30769-X, British Journal of Nutrition 82, 1999-10, עמ' 331–332 doi: 10.1017/s0007114599001555
- ^ Read "Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride" at NAP.edu. (באנגלית)
- ^ S Wallach, Effects of magnesium on skeletal metabolism, Magnesium and trace elements 9, 1990-01-01, עמ' 1–14
- ^ Magnesium and Heart Rate, LIVESTRONG.COM (באנגלית)
- ^ Role of Magnesium in Plant Culture | PRO-MIX Greenhouse Growing, www.pthorticulture.com
- ^ Blog, OMEX Agriculture Inc., 2020-05-21
- ^ Santiago Alejandro, Stefanie Höller, Bastian Meier, Edgar Peiter, Manganese in Plants: From Acquisition to Subcellular Allocation, Frontiers in Plant Science 11, 2020 doi: 10.3389/fpls.2020.00300/full#b17
- ^ Baishnab Charan Tripathy, Ralf Oelmüller, Reactive oxygen species generation and signaling in plants, Plant Signaling & Behavior 7, 2012-12, עמ' 1621–1633 doi: 10.4161/psb.22455
- ^ Munehiro Kitada, Jing Xu, Yoshio Ogura, Itaru Monno, Daisuke Koya, Manganese Superoxide Dismutase Dysfunction and the Pathogenesis of Kidney Disease, Frontiers in Physiology 11, 2020 doi: 10.3389/fphys.2020.00755/full
- ^ Mengfan Liu, Xueyang Sun, Boya Chen, Rongchen Dai, Zhichao Xi, Hongxi Xu, Insights into Manganese Superoxide Dismutase and Human Diseases, International Journal of Molecular Sciences 23, 2022-01, עמ' 15893 doi: 10.3390/ijms232415893
- ^ Gf Gaetani, Am Ferraris, M Rolfo, R Mangerini, S Arena, Hn Kirkman, Predominant role of catalase in the disposal of hydrogen peroxide within human erythrocytes, Blood 87, 1996-02-15, עמ' 1595–1599 doi: 10.1182/blood.V87.4.1595.bloodjournal8741595
- ^ Austin D. Read, Rachel ET. Bentley, Stephen L. Archer, Kimberly J. Dunham-Snary, Mitochondrial iron–sulfur clusters: Structure, function, and an emerging role in vascular biology, Redox Biology 47, 2021-11, עמ' 102164 doi: 10.1016/j.redox.2021.102164
- ^ Kevin G. Taylor; Kurt O. Konhauser, Iron in Earth Surface Systems: A Major Player in Chemical and Biological Processes, pubs.geoscienceworld.org
- ^ Massimo Paoli, Jon Marles-Wright, Ann Smith, Structure–Function Relationships in Heme-Proteins, DNA and Cell Biology 21, 2002-04, עמ' 271–280 doi: 10.1089/104454902753759690
- ^ A Uzman, Molecular Cell Biology (4th edition) Harvey Lodish, Arnold Berk, S. Lawrence Zipursky, Paul Matsudaira, David Baltimore and James Darnell; Freeman & Co., New York, NY, 2000, 1084 pp., list price $102.25, ISBN 0-7167-3136-3, Biochemistry and Molecular Biology Education 29, 2001, עמ' 126–128 doi: 10.1016/s1470-8175(01)00023-6
- ^ Juan C Fontecilla-Camps, Nickel and the origin and early evolution of life, academic.oup.com, 16 March 2022
- ^ S. Frank, A.A. Brindley, E. Deery, P. Heathcote, A.D. Lawrence, H.K. Leech, R.W. Pickersgill, M.J. Warren, Anaerobic synthesis of vitamin B12: characterization of the early steps in the pathway, Biochemical Society Transactions 33, 2005-08-01, עמ' 811–814 doi: 10.1042/bst0330811
- ^ Robert J. P. Williams, The symbiosis of metal and protein functions, European Journal of Biochemistry 150, 1985-07, עמ' 231–248 doi: 10.1111/j.1432-1033.1985.tb09013.x
- ^ Enrique Cadenas, Kelvin J.A. Davies, Mitochondrial free radical generation, oxidative stress, and aging11This article is dedicated to the memory of our dear friend, colleague, and mentor Lars Ernster (1920–1998), in gratitude for all he gave to us., Free Radical Biology and Medicine 29, 2000-08, עמ' 222–230 doi: 10.1016/S0891-5849(00)00317-8
- ^ Ei-Ichiro Ochiai, Copper and the biological evolution, Biosystems 16, 1983-01, עמ' 81–86 doi: 10.1016/0303-2647(83)90029-1
- ^ R. J. P. Wiiliams, Zinc in evolution, Journal of Inorganic Biochemistry, Bert Vallee Memorial 111, 2012-06-01, עמ' 104–109 doi: 10.1016/j.jinorgbio.2012.01.004
- ^ S. S. Krishna, Structural classification of zinc fingers: SURVEY AND SUMMARY, Nucleic Acids Research 31, 2003-01-15, עמ' 532–550 doi: 10.1093/nar/gkg161
- ^ R.J.P. Wiiliams, Zinc in evolution, Journal of Inorganic Biochemistry 111, 2012-06, עמ' 104–109 doi: 10.1016/j.jinorgbio.2012.01.004
- ^ Ralf R. Mendel, Cell biology of molybdenum, BioFactors 35, 2009-09, עמ' 429–434 doi: 10.1002/biof.55
- ^ Oliver Einsle, Douglas C. Rees, Structural Enzymology of Nitrogenase Enzymes, Chemical Reviews 120, 2020-06-24, עמ' 4969–5004 doi: 10.1021/acs.chemrev.0c00067
- ^ Enrique Martínez-Carranza, Gabriel-Yaxal Ponce-Soto, Luis Servín-González, Luis David Alcaraz, Gloria Soberón-Chávez, Evolution of bacteria seen through their essential genes: the case of Pseudomonas aeruginosa and Azotobacter vinelandii, Microbiology 165, 2019, עמ' 976–984 doi: 10.1099/mic.0.000833
- ^ Yan Zhang, Jiao Jin, Biyan Huang, Huimin Ying, Jie He, Liang Jiang, Selenium Metabolism and Selenoproteins in Prokaryotes: A Bioinformatics Perspective, Biomolecules 12, 2022-06-29, עמ' 917 doi: 10.3390/biom12070917
- ^ Gregory V Kryukov, Vadim N Gladyshev, The prokaryotic selenoproteome, EMBO reports 5, 2004-05, עמ' 538–543 doi: 10.1038/sj.embor.7400126
- ^ Isabelle J. Schalk, Olivier Cunrath, An overview of the biological metal uptake pathways in P seudomonas aeruginosa: Pseudomonas and metals, Environmental Microbiology 18, 2016-10, עמ' 3227–3246 doi: 10.1111/1462-2920.13525
- ^ Lauren D. Palmer, Eric P. Skaar, Transition Metals and Virulence in Bacteria, Annual Review of Genetics 50, 2016-11-23, עמ' 67–91 doi: 10.1146/annurev-genet-120215-035146
