זכוכית – הבדלי גרסאות
מ בוט החלפות |
Qazplmbgbgbg (שיחה | תרומות) |
||
| שורה 88: | שורה 88: | ||
כללים האלה מנבאים נכון את יצירת הזכוכית לתחמוצות כמו: SiO<sub>2</sub>, GeO<sub>2</sub>, B<sub>2</sub>O3, P<sub>2</sub>O<sub>5</sub>, |
כללים האלה מנבאים נכון את יצירת הזכוכית לתחמוצות כמו: SiO<sub>2</sub>, GeO<sub>2</sub>, B<sub>2</sub>O3, P<sub>2</sub>O<sub>5</sub>, |
||
[[קובץ:Silica.svg|מרכז|ממוזער|250px|מבנה מיקרו של זכוכית על פי מודל של זכריאסן random network]] |
[[קובץ:Silica.svg|מרכז|ממוזער|250px|מבנה מיקרו של זכוכית על פי מודל של זכריאסן random network]] |
||
=== |
===שימושים בתעשייה === |
||
לזכוכיות העשויות מתרכובות יוצרות רשת, יש שימושים מוגבלים. למשל, תחמוצת של בור טהורה (B2O3(Tg~4500C לא עמידה למים. זכוכית המכילה תחמוצת צורן SiO2 אשר שימושית בגלל עמידות כימית גם בטמפרטורות גבוהות במיוחד(עד 0C 1750), בעלת התנגדות לשינוי טמפרטורות ([[thermal shoc]]). זכוכית זאת מוכרחה להיות מעובדת בטמפרטורות שמעל 0C 1500. רוב סוגי הזכוכית השימושיים מכילים תוספים אשר משפרים את היכולת לעבדן ומשפרים את התכונות. תוספים אלה נקראים משני רשת לדוגמה CaOו- Na<sub>2</sub>O וחומרי ביניים,לדוגמה: BeO, Al<sub>2</sub>O<sub>3</sub>, Ga<sub>2</sub>O<sub>3</sub>, Fe<sub>2</sub>O<sub>3</sub>, TiO<sub>2</sub>, V<sub>2</sub>O<sub>5</sub>, Sb<sub>2</sub>O<sub>5</sub>, Nb<sub>2</sub>O5 |
לזכוכיות העשויות מתרכובות יוצרות רשת, יש שימושים מוגבלים. למשל, תחמוצת של בור טהורה (B2O3(Tg~4500C לא עמידה למים. זכוכית המכילה תחמוצת צורן SiO2 אשר שימושית בגלל עמידות כימית גם בטמפרטורות גבוהות במיוחד(עד 0C 1750), בעלת התנגדות לשינוי טמפרטורות ([[thermal shoc]]). זכוכית זאת מוכרחה להיות מעובדת בטמפרטורות שמעל 0C 1500. רוב סוגי הזכוכית השימושיים מכילים תוספים אשר משפרים את היכולת לעבדן ומשפרים את התכונות. תוספים אלה נקראים משני רשת לדוגמה CaOו- Na<sub>2</sub>O וחומרי ביניים,לדוגמה: BeO, Al<sub>2</sub>O<sub>3</sub>, Ga<sub>2</sub>O<sub>3</sub>, Fe<sub>2</sub>O<sub>3</sub>, TiO<sub>2</sub>, V<sub>2</sub>O<sub>5</sub>, Sb<sub>2</sub>O<sub>5</sub>, Nb<sub>2</sub>O5 |
||
זכוכית לתעשייה מכילה לפחות חמש תחמוצות,לדוגמה זכוכית אופטית, מכילה יותר מעשר תחמוצות.<br /> |
זכוכית לתעשייה מכילה לפחות חמש תחמוצות,לדוגמה זכוכית אופטית, מכילה יותר מעשר תחמוצות.<br /> |
||
גרסה מ־01:23, 29 ביולי 2012




זכוכית בצורתה הטהורה היא חומר שקוף, חזק באופן יחסי, עמיד לשחיקה ועמיד בדרך כלל מבחינה כימית וביולוגית. הזכוכית העתיקה הייתה מסיסה (תהליך איטי). ניתן ליצור זכוכית ממגוון רחב של חומרים, אולם רק מספר מצומצם של חומרים אכן נמצא בשימוש.
חומר זכוכיתי הוא מוצק אמורפי אחיד, המיוצר על-פי רוב על ידי קירור (לעתים נדרש קירור מהיר) של חומר צמיגי, כך שלשריג הגבישי אין די זמן להיווצר. חומרים אלו מאופיינים על ידי טמפרטורה אופיינית למעברם ממצב צמיגי (גומי) למצב זכוכיתי ומכונה "מעבר זכוכיתי" ומסומנת בספרות על ידי Tg.
את הזכוכית ניתן לעצב בקלות רבה לגופים בעלי שטח פנים חלק ובלתי חדיר. תכונות אלו הופכות את הזכוכית לחומר בעל מגוון רחב של שימושים. עם זאת, הזכוכית שבירה למדי ועשויה להתנפץ לרסיסים חדים. תכונותיה השונות של הזכוכית עשויות להשתנות על ידי הוספת מרכיבים שונים או טיפול בחום.
היסטוריה
בני אדם מצאו בטבע את הזכוכית בערך לפני 40 אלף שנה. הזכוכית הטבעית היא זכוכית געשית הנקראת אובסידיאן. השתמשו בה ליצור סכינים וראשי חצים. יצור של זכוכית על ידי בני אדם התחיל כי 3-4 אלף שנה לפני הספירה. בשריפה של זרעים האפר שנישאר מהשריפה התחבר עם החול בטמפרטורה גבוהה ונוצרה זכוכית סיליקטית המכילה 60% SiO2. בהוספה של אשלגן חמצני K2O אפשר לקבל זכוכית שקופה. אנשים השתמשו בזכוכית הזאת ליצור תכשיטים ובקבוקונים.
השם "זכוכית" מוזכר כבר במקרא: ”לֹא-יַעַרְכֶנָּה זָהָב, וּזְכוֹכִית; וּתְמוּרָתָהּ כְּלִי-פָז.” (איוב פרק כ"ח, פסוק י"ז), כתיאור לכלים יקרים. מקור המילה הוא עקב תכונת הזכות המאפיינת אותה. החוקר יהושע בראנד, בספרו כלי זכוכית בספרות התלמוד[1], מצביע על מונחים נוספים במקרא, שלדעתו פירושם זכוכית, כגון: "חול", "חלונות אטומות" ועוד.
בשאלת מקור הזכוכית, האם בפניקיה, מצרים או בארם נהרים, סבור בראנד, כי ראשית הזכוכית היא דווקא בארם נהרים ולא בפיניקיה, או במצרים, כפי שמקובל לחשוב. על בסיס מסקנה זו ומקורות נוספים, טוען בראנד כי אברהם אבינו היה אמן זכוכית ומסיבה זו היגר מאור כשדים לחרן.[2]
בלשון חז"ל נקראה הזכוכית גם "סכוכית" (תוספתא מסכת שבת), מכיוון שסוכין בה, כלומר רואים דרכה[3]. בימי חז"ל הייתה הזכוכית יקרה מאד מפני שהיה קשה מאד לזככה וליצר זכוכית שקופה או 'זכוכית לבנה' בלשון חז"ל. הגמרא [4] מספרת שכוס מזכוכית לבנה הייתה שווה 400 זוז.
בתקופה הקלאסית כלי אוכל מזכוכית היו נפוצים מאוד[5] אולם חלונות זכוכית הפכו לנפוצים רק בראשית העת החדשה. בתקופה זו החלה להתפתח גם תעשיית האופטיקה שעשתה שימוש רב בזכוכית.
בחצי השני של המאה העשרים התרחב השימוש בזכוכית כחומר ליצירת המעטפת של בניינים, ובפרט למעטפת של מגדלי משרדים.
במדינת ניו יורק הוקם מוזיאון הזכוכית שבמרכזו היסטוריה ושימושים השונים של זכוכית.
סוגי זכוכית
הזכוכית הנפוצה ביותר בשימוש נקראת Soda-Lime glass עשויה מצורן דו-חמצני (SiO2), אותה תרכובת כימית מהווה את קוורץ, (חומר הגלם - חול), נתרן פחמתי Soda (להורדת טמפרטורת ההתכה ומניעת גיבוש) וגיר (סידן פחמתי) Lime להעלאת היציבות הכימית.
נקודת ההתכה של סיליקה טהורה (SiO2) היא בערך 2,000°C. להקלת ההכנה מוסיפים מספר חומרים כמו נתרן פחמתי ("סודה לכביסה" - סודיום קרבונט: Na2CO3) המורידים את טמפרטורת ההתכה ל-1,000°C בקירוב.
זכוכית שלא תמוחזר תתפרק רק לאחר כמיליון שנים.
זכוכית בידודית (double glazing) היא למעשה חלון המורכב משתי שכבות זכוכית או יותר המחוברות על ידי מסגרת (לרוב מאלומיניום), כאשר המסגרת מכילה סופחי לחות למניעת היווצרות אדים על חלקן הפנימי של השמשות. לעתים בין השמשות יש גז מסוג ארגון להעצמת הבידוד התרמי והאקוסטי. מטרתה לבודד את חלל הבית הפנימי מרעש ומאקלים שבחוץ.
זכוכית משוריינת היא מבנה המשלב זכוכית וחומרים פולימריים שונים בצורת שכבות מתחלפות, על מנת להפוך אותה לעמידה לפגיעת תחמושת של נשק קל (רובים וכדומה). התוצאה היא חלון משוריין ולא זכוכית משוריינת. בעת הפגיעה החלון מתרסק ונהרס, אך שומר על עמידותו בפני מספר מוגדר של פגיעות. בעולם נהוג דירוג של רמות איום, כאשר החלונות הנפוצים עמידים לפגיעת קליעי נק"ל. חלונות משוריינים המשמשים כלי רכב צבאיים כבדים עמידים אף לאש מקלעים כבדים ורסיסים הנוצרים מפצצות ומטענים.
זכוכית מחוסמת היא זכוכית שעברה חימום מבוקר לטמפרטורה של כ-700 מעלות צלזיוס ולאחר מכן קירור מהיר מאוד באוויר. תהליך זה גורם להכנסת מאמצים בזכוכית והופך אותה לבעלת חוזק גבוה פי 3-5 מאשר זכוכית רגילה (מורפית, שעברה הרפיה). החוזק נובע ממאמצי לחיצה שנוצרים בפני השטח של הזכוכית ואלו מקשים על התקדמות סדקים בזכוכית.
פיברגלס (סיבי-זכוכית) מיוצר על ידי דחיסת זכוכית מותכת דרך חורים זעירים בבסיס הכבשן. כך נוצרים חוטים דקים מאוד שאפשר ליצור מהם אריגים קלים וחזקים. פיברגלס גם מגן מפני חום וחסין אש, ולכן בגדי הכבאים עשויים פיברגלס[6]
כלי זכוכית המיוצרים בניפוח עשויים למעשה מזכוכית רגילה, אך טכניקת הייצור שלהם מאפשרת להם להיות דקים ועדינים. כלים אלה משמשים בעיקר לקישוט. במדינת ישראל וברשות הפלסטינית נפוצים כלים כאלה המיוצרים בחברון ומכונים "זכוכית חברון".
בעל המקצוע המכין כלים אלה מכונה "נפח זכוכית". זאת גם משום שהוא מנפח את הזכוכית המומסת באוויר וגם משום שטכניקה זו שאלה כמה מהכלים המשמשים את נפחי המתכת.
יצור זכוכית
זכוכית גולמית מתקבלת כתוצאה מחימום רכיבי התערובת בכור היתוך. את הזכוכית הגולמית בדרך כלל מייצרים מחול SiO2, סודה Na2CO3, וסיד CaO.
את כל הרכיבים מערבבים במיכל ערבוב מיוחד ומחממים לטמפרטורה של 1000°C ומתרחשת הריאקציה הבאה:
Na2CO3 + 2SiO2 + CaO → Na2SiO3 + CaSiO3 + CO2
מהזכוכית הגולמית ניתן להפיק מגוון רחב של זכוכיות שונות.
תחמוצות זכוכית
לפי ההרכב הבסיסי של התחמוצת ניתן למיין את הזכוכית ל:
• זכוכית סיליקטית SiO2
• אלומוסיליקטית Al2O3;SiO2
• בורוסיליקטית B2O3;SiO2
• בורואלומוסיליקטית B2O3;Al2O3;SiO2
• אלומופוספטית B2O3;SiO2
• בורואלומופוספטית B2O3;Al2O3;P2O5
• אלומוסיליקופוספטית Al2O3;SiO2;P2O5
• פוספוונדית P2O5;V2O5
• סיליקוטיטנית SiO2;TiO2
• סיליקוצירקונית SiO2;ZrO
בשנים 1926-1931 קבוצת מדענים מאירופה וארצות הברית (פאולינג, זכריאסן, טילור, ברג) גילו על ידי קרני X את המבנה של זכוכית סיליקטית.
כללי פאולינג (1928) לשריג גבישי – יציבות גבישית
פאולינג חקר את היציבות של מבנים גבישיים ובשנת 1928 הציע את כללים הבאים:
• מרחק בין קטיון ואניון בפיאון תלוי בסכום של רדיוסיהם. מספר ה"שכנים" בפאון תלוי ביחס שבין הרדיוסים
• סכום המטענים של הקטיונים סביב האניון שווה (או כמעט שווה) למטען האניון
• ככל שבפאון יש יותר צלעות ופאות משותפות, כך היציבות של המבנה פוחתת
• קטיונים קטנים עם מטען גבוה לא "רוצים" אניונים משותפים
• מספר יחידות עם מבנים שונים בתוך אותו גביש חייב להיות מינימאלי

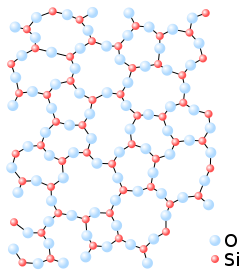
מודל רשת אקראית של זכריאסן (1932)
זכריאסן חקר את המבנה של זכוכיות תחמוצת ועל סמך פיזור קרני X הוא גילה שיש להן סדר לטווח קצר, אך אין להם סדר לטווח הארוך. לכן לפי זכריאסן, בין זכוכית וגביש יש דמיון רק לטווח קצר, אך לטווח ארוך המבנה הזכוכית לא שומר על מחזוריות כמו הגביש. על סמך התוצאות האלה הוא הגיע למסקנה שהזכוכית היא בעלת מבנה של רשת אקראית והציע את המודל שניתן לסכמו בכללים הבאים:
- כל אטום חמצן מחובר ללא יותר משני קטיאונים.
- מספר אטומי חמצן מסביב לקטיון צריך להיות קטן (ארבעה או פחות)
- לפאוני חמצן יש יותר פינות משותפות מאשר צלעות או פאות
- לפחות שלוש פינות של כל פיאוני חמצן הן משותפות
כללים האלה מנבאים נכון את יצירת הזכוכית לתחמוצות כמו: SiO2, GeO2, B2O3, P2O5,
שימושים בתעשייה
לזכוכיות העשויות מתרכובות יוצרות רשת, יש שימושים מוגבלים. למשל, תחמוצת של בור טהורה (B2O3(Tg~4500C לא עמידה למים. זכוכית המכילה תחמוצת צורן SiO2 אשר שימושית בגלל עמידות כימית גם בטמפרטורות גבוהות במיוחד(עד 0C 1750), בעלת התנגדות לשינוי טמפרטורות (thermal shoc). זכוכית זאת מוכרחה להיות מעובדת בטמפרטורות שמעל 0C 1500. רוב סוגי הזכוכית השימושיים מכילים תוספים אשר משפרים את היכולת לעבדן ומשפרים את התכונות. תוספים אלה נקראים משני רשת לדוגמה CaOו- Na2O וחומרי ביניים,לדוגמה: BeO, Al2O3, Ga2O3, Fe2O3, TiO2, V2O5, Sb2O5, Nb2O5
זכוכית לתעשייה מכילה לפחות חמש תחמוצות,לדוגמה זכוכית אופטית, מכילה יותר מעשר תחמוצות.
למשל זכוכית לחלונות ועיצוב הבית מכילה 8 סוגי תחמוצות, ביניהם- סיליקה (72.5%), אלומינה (1.5%), סידן חמצני (7.5%), נתרן חמצני (14.5%), מגנזיום חמצני (3.77%), תחמוצת ברזל (0.1%) ותחמוצת אשלגן (0.7%).
הרכב התוספים בזכוכית, וסוגי התוספים מאפשר קבלת זכוכיות שונות עם תכונות מכניות, אופטיות שונות המתאימות למגוון שימושים.
המשותף לכל הזכוכיות שהמרכיב העיקרי הוא סיליקה, בדרך כלל באחוז גבוה מ- 50% מהרכב הזכוכית.
--Bela816 - שיחה 13:51, 28 ביוני 2012 (IDT)bala816
מבנה סילקאטים
יחידת המבנה של המינרלים הסיליקטים כל אטום צורן מחובר לארבעה אטומי חמצן ל יש דרגת חמצון +4 ודרגת החמצון של חמצן הוא -2 על כן סך דרגת החמצון של יחידת המבנה של הסיליקטים הוא : ייצוגים של - טטראהדרון (nesosilicate)


הטטראדר יכול לקשור פינה- כלומר שאטום חמצן אחד יהיה משותף לשני טטראדר. ולמקרה כזה מבנים רבים.
בדידים : מולקולות sorosilicate
Si2O7-6

טבעות נפרדות (cyclosilicate)
ניתן לראות כי כל טטראדר קשור בפינות כדי ליצור טבעות. מבנה של טבעות נפרדות. Si6O18-12
רשת אחת אינסופית
ניתן לראות שלכל טטרהדר a קשורים שניים נוספים בפינות כדי ליצור רשתות בודדות inosilicate

SiO3-2
שרשראות כפולות אינסופיות (להקות)
Si4O11-6 ניתן לראות שכל טטראדר קשור בפינות כדי ליצור שרשראות כפולות. מבנה בעל מקבילים הנראים כרשתות כפולות של טטראדר סיליקט, inosilicate.
גיליונות אין סופיים
Si2O5-2 ניתן לראות שכל טטראדר קשור בשלוש פינות כדי ליצור דף. מבנה בעל גיליונות מקבילים של טטראדר סיליקט, נקרא phyllosilicate

מבנה מסגרת צורני
ניתן לראות כי כל טטראדר קשור בכל פינה כדי ליצור מסגרת. בגלל מבנה בעל מסגרת תלת ממדית של סיליקט טטראדר, מבנה הקוורץ הוא מסגרת תלת ממדית.
קטיונים
קטיונים הם מתכות בעלות מטען חשמלי, בסיליקטים משתמשים במתכות מטור ראשון ושני כמו +Na,
+K
+Ca
+Mg
דרוש מספר שונה של מטענים חיוביים (קטיונים) על מנת לאזן את המטען של הסיליקט.
לדוגמה, ל- SiO4-4 דרושים שני יוני מגנזיום, Mg+2 והנוסחה היא MgSiO4/
דוגמה נוספת, SiO3-2 דרוש יון מגנזיום אחד- Mg+2, והנוסחא היא MgSiO3
הוספת תרכובות יוניות ותחמוצות לזכוכית
מוסיפים לזכוכית תרכובות יוניות (תחמוצות) ממספר סיבות:
1. לקבלת זכוכית צבעונית:
לדוגמה:
CuO- תחמוצת נחושת- גוון כחול
FeO- תחמוצת ברזל- גוון ירוק
Fe2O3- תחמוצת ברזל- גוון חום
לזכוכית בה הוחלף חלק של סיליקה בתחמוצות בור, יש עמידות רבה לחום וכן עמידות כימית גבוהה.
2. ניתן למצוא כמה סוגי תחמוצות בזכוכית .
התחמוצת ממנה בנויה מטריצת הזכוכית ( לדוגמה- סיליקה) נקראת :
- תוסף הנמצא בזכוכית כחלק מהרשת נקרא intermidiate
- תוסף השובר את אשת הזכוכית נקרא modifier
קטיונים של נתרן ואשלגן הם network-modifier
אינם קשורים קוולנטית לרשת הטטראדרות היוצרת הזכוכית אלא קשורים יונית לחמצנים בלתי מגשרים ויכולים לעבור דיפוזיה או לדלוף מהזכוכית ( חילוף יונים) לתמיסות.

--46.117.214.67 17:51, 26 ביוני 2012 (IDT)sandra84
ישנם יוני חמצן אשר פועלים כגשרים בין יחידות הטטראדרים הנקראים bonding-oxygen.
וישנם גם יוני חמצן שאינם משתתפים ביצירת מבנה הרשת ונקראים : אי גישור, non bonding-oxygen .
ישנם 3 פעילויות עיקריות של מסיימי רשת :
א. שבירת הקשרים A-O-A ויצירת אי גישור.
ב. הגברת התיאום של קטיון וחמצן.
ג. שילוב של שניהם.
• תוספת Na2O מורידה באופן משמעותי את טמפרטורת ההיתוך ואת הצמיגות של הזכוכית
• תוספת של Cao עוזרת להקטין את מסיסות הזכוכית במים
• כאשר היחס חמצן /סיליקון עולה על 2.5-3.0 , קשה מאוד לקבל זכוכית ללא שימוש בתנאי הכנה מיוחדים, כגון קירור מהיר.
זכוכית קרמית
זכוכיות קרמיות מכילות גבישים בניגוד לזכוכית רגילה בעלת מבנה מולקולרי לא מסודר.מה שמייחד זכוכית קרמית הוא מבנה דו פאזי: מיקרו-גבישים שבניהם אזורים אמורפים.הפאזה הגבישית מהווה בין 30% ל 70% מולרי.
השימוש בזכוכית קרמיות החל בשנת 1950 והתגלה על ידי סטוקי (S.D. Stookey)
סטוקי גילה במקרה את הזכוכית הקרמית. הוא השאיר בתנור שפעל בטמפרטורה גבוהה תערובת של זכוכית העשויה מליתיום סילקאט וכסף. שהוא חזר הוא מצא חומר קרמי לבן במקום למצוא "שלולית" של זכוכית מותכת. הדבר קרה בגלל שהכסף היווה מרכז נוקלאציה (מרכז גיבוש), וגרם ליצירת מבנה קריסטלי של הזכוכית.
אלו חומרים שבתחילת דרכם יש להם מבנה זכוכיתי, ולאחר חימום והוספת חומרים שונים הם הופכים להיות חומרים בעלי תכונות קרמיות. לזכוכית רגילה יש מבנה אמפורי, כלומר יש סדר מקומי אך אין מבנה קריסטלי מסודר, אין תאי יחידה שחוזרים על עצמם, בניגוד לזכוכית קרמית שבה פזורים בתווך האמורפי אזורים בהם האטומים מסודרים במבנה מסודר כלומר יש תאי יחידה שחוזרים על עצמם.
על מנת להכין זכוכית קרמית, יש להתיך את הזכוכית, ולשפוך אם החומר המותך לתוך כלי בצורה הרצויה. קצב הקירור צריך לאפשר צמיחת גבישים. הדרישה לזכוכיות קרמית עולה בשנים האחרונות, בעיקר בשל העובדה שניתן לעבד את החומר בקלות כמו זכוכית רגילה, ויחד עם זאת מתקבל חומר בעל תכונות קרמיות רצויות כמו עמידות לזעזוע תרמי, קשיחות, רגישות לאור ועוד.
יתרון נוסף של הזכוכית הקרמית נעוץ בעובדה שניתן ליצור צורות מגוונות עם תכונות קרמיות מה שלא ניתן לעשות עם חומרים קרמיים אחרים. Owens-Corning Fiberglass (OCF) E-glass היא זכוכית העשויה מתרכובת של קלציום- אלומינו-סיליקאט בתוספת של מגנזיום, בור, ברזל, טיטניום וסודיום אוקסיד. לחומר זה יש עמידות גבוהה לחום ועמידות גבוהה למים.

שיטות ייצור של זכוכית קרמית
על מנת ליצור זכוכית קרמית, יש ללחמם זכוכית רגילה, לקרר ולחמם שוב. אך טיפול בחום אינו מספיק. כי צריך להוסיף חומר שיוכל לעשות נוקלאציה ובכך לאפשר את תחילת הגידול הגבישי. במטרה להפוך את הזכוכית לזכוכית קרמית בעלת מבנה קריסטלי, קודם כל יש לטפל בחומר בטמפרטורה של כ-1000°C, בין שעה לשעתיים במטרה ליצור זכוכית רגילה.
לאחר מכן לוקחים גולות במסה בטווח של 25-30gr, ושמים על משטח פלטינה. הגולות מחוממות ל- 1500°C במשך 30 דקות, ולאחר 30 דקות מוציאים את הגולות המותכות ומקררים אותן בטמפרטורת החדר. אם יש צורך בהוספת חומרים נוספים לקבלת חומר בעל תכונות רצויות, אז טוחנים את הזכוכית לאבקה, ומוסיפים לה את התוסף הרצוי, ושמים שוב לחימום באותם התנאים לעיל, למשך 30 דקות נוספות. התוסף הוא בדרך כלל מלח. המלחים הנפוצים שמוסיפים על מנת ליצור זכוכית במבנה קריסטלי הם: ליתיום פחמתי Li2CO3, אלומיניום חמצני Al2O3, סידן חמצני CaO וטיטניום אוקסיד TiO2. ניתן לקבל זכוכיות קרמיות עם תכונות שונות בזכות הוספת תוספים שונים וחימום לזמנים שונים. יעילות התוסף נמדדת בהתאם לעובי שכבת הזכוכית הנוצרת- ככל שהשכבה עבה יותר התוסף הוא יותר יעיל. זכוכית ללא תוספים לא יכולה ליצור מבנה קריסטלי מכיוון שאין חומר שיוכל לאפשר את תחילתו של מרכז הגיבוש.
שימושים
בזכות תכונותיהן של הזכוכיות הקרמיות ניתן להשתמש בהם בסירי בישול, פלטות לבישול חשמלי, מראות טלסקופיות וחלונות מאובטחים.
קצב נוקלאציה(התגרענות)
על מנת שזכוכית תעבור ממצב של מבנה אמפורי למבנה קריסטלני צריך ליצור תהליך נוקלאציה. תהליך זה מתרחש עם חימום הזכוכית, קירור הזכוכית ואז שוב חימום מעל ל- Tg.
קצב הנוקלאציה (התגרענות) תלוי בצמיגות של הזכוכית, באנרגיה החופשית של תהליך הנוקלאציה, בתדירות הויברציה ובטמפרטורה.
N- קצב הנוקלאציה
∆G*- האנרגיה החופשית של תהליך הנוקלאציה.
ω - תדירות הויברציה
C0- צפיפות המולקולות ל- m3
תכונות פיזיקליות של זכוכית
תכונות אופטיות
תכונות אופטיות של חומר מתארות את תגובת החומר למעבר אור דרכו. כאשר אור פוגע בחומר מסוים הוא יכול להיבלע בו, לחזור ממנו, או לעבור דרכו.
העברת אור מבטאת את יכולת החומר להעביר אור דרכו. תכונה זו כמעט הפוכה להחזרה. בליעת אור מתרחשת כאשר אור פוגע בחומר, והאנרגיה שלו נספגת בחומר באופן חלקי או מלא.
חומר שקוף, בדומה לזכוכית שבשמשת החלון, מעביר כמעט את כל האור הפוגע בו. לכן ניתן לראות דמויות הנמצאות מצדו האחר.
הדרישה לזכוכיות בעלות תכונות אופטיות מסוימות הולכת ועולה בשנים האחרונות. תכונות אופטיות של זכוכית הן תכונות פיזיקליות, אך הן תלויות בהרכב הכימי של החומרים מהם עשויה הזכוכית. מרבית הזכוכיות יכולות להעביר דרכן את האור הנראה.זיהומים בזכוכית כגון נחושת או ברזל מורידים את היכולת של הזכוכית להעביר דרכה אור. גוון ירקרק של זכוכית (שניתן לראותו, למשל, כשמסתכלים בזכוכית מראה או חלון מהצד) נובע מהמצאות יוני ברזל.
בזכות יכולתם של הזכוכית להעביר את האור בתחום הנראה והאינפרא אדום הקרוב דרכן יש לזכוכיות שימושים רבים כגון: שמשות לחלונות, סיב אופטי, שימוש ביצירת קישוטים לבית ונברשות, עדשות למשקפיים, מצלמה ועוד.
לזכוכיות שונות יש מקדמי שבירה שונים (refractive index). מקדם שבירה - מקדם שבירה היא תכונה פיזיקלית של חומר שקוף, המציינת את שינוי הזווית של האור המועבר. מקדם השבירה תלוי בהרכב הכימי של הזכוכית ובמאמצים הפועלים בה.
זכוכית פוטוכרומית – היא זכוכית המתכהה כאשר נחשפת לאור השמש כתוצאה מפרוק גבישים של מלחי כסף באור UV ויצירת כסף מתכתי אטום. כאשר הקרינה נפסקת הגוון הכהה של הזכוכית נעלם כיוון שהכסף שוב מתחמצן לקבלת מלחים שקופים.

צבע
צבע זכוכית תלוי בדברים הבאים:
- 1. ביכולת של הזכוכית לבלוע אור.
- 2. פיזור אורכי הגל של האור הנראה.
- 3. רגישות לאור (photosensitivity).
- 4. יכולת פלורסנציה.
כל הדברים לעיל מושפעים כתוצאה ממעבר אלקטרונים בשדה חשמלי, מקיומם של יוני מתכות טעונים או ממעבר של פוטונים. זכוכית צבעונית מקבלים על ידי תוספת מלחים או תחמוצות.
- CuO - תחמוצת נחושת - גוון כחול.
- FeO- תחמוצת ברזל - גוון ירוק.
- Fe2O3 - תחמוצת ברזל - גוון חום.
- יון ניקל Ni+2- כחול סגול או שחור.
- יון כרום Cr+3 - ירוק כהה.
שימושי הזכוכית הצבעונית הן בעיקר בתחום האומנות. ישנן זכוכיות השקופות לחלוטין לאור נראה ואטומות לחלוטין לאור אינפרא אדום. וישנן זכוכיות כמו קוורץ, היכולות להעביר גם את האור הנראה וגם את האור האינפרא אדום.
לקריאה נוספת
- Prindle WR, Danielson PS, and Malmendier JW. (1991). "Glass Processing', in Engineered Materials Handbook: Ceramics and Glasses, Vol. * ASM International, Materials Park, OH, pp. 377-394
- Duan, R.G. and Liang, K.M. (1998) "A Study on the crystallization of CaO-Al2O3-SiO2 system glasses". Journal of Materials Processing Technology, vol. 75, iss. 1-3, pp. 235-239
קישורים חיצוניים
- בלדד השוחי, איך עושים זכוכית?, באתר ערוץ עשר
- תבנית:אנציקלופדיה ynet
- מבוא לאספנות זכוכית עתיקה באתר קולקט
- אורלי פיישטר; בועז גטניו, הזכוכית : שקופה, צבעונית ומתנפחת. הספרייה הווירטואלית של מט"ח
- ביתן הזכוכית במוזיאון ארץ ישראל בתל אביב
- פיטר גוין, מתכת שהיא זכוכית. מדע- עיתון מדעי לכל
- שושנה צובל, "זכוכית", מאי 2004, המרכז להשתלמויות מורים- שלומי

- מה היא זכוכית קרמית? (באנגלית)
- זכוכית קרמית מאנציקלופדיה של טכנוולגי כימית (באנגלית)
- Zanotto, E.D. (2008). Transparent glass - ceramics. International Materials Institute for New Functionality in Glass (באנגלית)
- תכונות אופטיות של זכוכית; הפקולטה למדע החומרים וקרמיקה, אוניברסיטה למדע וטכנולוגיה על שמו של סטניסלב סטאז'ץ'
 (באנגלית)
(באנגלית) - זכוכית באתר אוניברסיטת סטנפורד

- זכוכית באתר של פרופ' א. נלסון מפקוטלה לחומרי כדור הארץ אוניברסיטת טוליין
 (באנגלית)
(באנגלית)
- http://books.ifmo.ru/book/pdf/808.pdf
- http://www.pereplet.ru/obrazovanie/stsoros/60.html
- http://www.ngpedia.ru/cgi-bin/getpage.exe?cn=20&uid=0.612850065575913&inte=3
- http://cryst.geol.msu.ru/courses/crchem/part2.pdf
- http://www.inmetal.ru/244-stroenie-silikatov.html
- http://www.grandinetti.org/Research/Applications/GlassStudies
- http://www.xumuk.ru/encyklopedia/2/4195.html
- http://www.megabook.ru/Article.asp?AID=674822
- http://window.edu.ru/resource/279/21279/files/0103_095.pdf
- http://ngipoteza.narod.ru/glass8.htm
- http://www.fnm.msu.ru/documents/16/4amorph.pdf
- http://www.nanometer.ru/2011/10/02/funkcionalnie_materiali_262483/PROP_FILE_files_1/fumcmat_cer_2011.pdf
- http://www.ptc.tugraz.at/specmag/struct/random.htm
הערות שוליים
- ^ ד"ר יהושע בראנד, כלי זכוכית בספרות התלמוד, בצירוף מחקרים ומאמרים, ירושלים: מוסד הרב קוק, תשל"ח-1978, פרק שלישי, עמ' 16 - 41: "הזכוכית וכלי הזכוכית במקרא".
- ^ ד"ר יהושע בראנד, כלי זכוכית בספרות התלמוד, בצירוף מחקרים ומאמרים, ירושלים: מוסד הרב קוק, תשל"ח-1978, פרק ראשון, עמ' 1 - 13: "ראשית הזכוכית".
- ^ רש"י שבת פ"א. ד"ה סכוכית.
- ^ ברכות לד ע"ב.
- ^ ראו למשל כאן את כלי הזכוכית של בבתא מהמאה ה-2 לספירה שנמצאו במערת האגרות במדבר יהודה.
- ^ בגדי כבאים עשויים גם קוולר וספקטרה.
