גירוי מוחי עמוק

גירוי מוחי עמוק (באנגלית: DBS, Deep Brain Stimulation) הוא טיפול נוירולוגי ופסיכיאטרי, המבוסס על גירוי חשמלי של אזורים במוח. לצורך הטיפול מתבצעת השתלה כירורגית של אלקטרודה באתר המטרה בתוך המוח ומותקן קוצב תת-עורי המשגר אליה אותות חשמליים.
הטיפול נועד להקל על איכות חייהם של אנשים הסובלים מתסמינים מוטוריים טורדניים שאינם חולפים בטיפול תרופתי, או שהטיפול התרופתי מלווה בתופעות לוואי חמורות. הוא משמש לטיפול במחלות שונות בהן מחלת פרקינסון[1], דיסטוניה, אפילפסיה והפרעה טורדנית-כפייתית.[2][3][4]
בשנים האחרונות נעשים מחקרים על מנת להרחיב את הטיפול למגוון רחב יותר של מחלות נוירולוגיות ופסיכיאטריות, כגון: דיכאון, תסמונת טורט ומחלת אלצהיימר.[5]
המערכת המושתלת בגוף מורכבת מקוצב חשמלי המעביר אותות חשמליים ומאלקטרודות המושתלות במוח ויוצרות את הגירוי החשמלי. גירוי זה משנה את האותות במוח אשר יוצרים את תסמיני המחלה, ובכך מביא לשיפור בתסמינים. פעילותו של הקוצב החשמלי נשלטת מבחוץ, ובכך מאפשרת להפסיק או לווסת את השפעת הטיפול במקרה הצורך.
מנגנוני הפעולה שדרכם משפיע הגירוי המוחי העמוק על תפקודו של המוח אינם ברורים לחלוטין, אולם קיימות השערות רבות.[6] אחת ההשערות היא שהתדר הגבוה של מהמכשיר (>100 Hz), גובר על התדר הנמוך הקיים במוח (11–30 Hz) ובכך מוביל לשיפור בתסמינים מוטוריים כגון רעידות וקשיחות שרירים.

מהלך הניתוח[עריכת קוד מקור | עריכה]
הניתוח נעשה בשני שלבים; בשלב הראשון מחדירים חוט דק למוח, אשר בקצוותיו מצויות אלקטרודות. האלקטרודות ממוקמות במדויק באתר המוח הנושא את האותות הלא תקינים המייצרים את הסימפטומים, ולכן מיקום האלקטרודה משתנה בהתאם למחלה המטופלת. משום שמיקום האלקטרודות תלוי בתגובותיו של המטופל לגירוי החשמלי בזמן הניתוח, החלק הראשון של הניתוח נעשה בהרדמה מקומית בלבד. לאחר מכן, בשלב השני, מוחדר קוצב (הנקרא נוירוסטימולטור) מתחת לעור, באזור הבטן או החזה. הנוירוסטימולטור מחובר לאלקטורודות שבמוח ויוצר את הזרם החשמלי המועבר בהן.
אופן פעולת המערכת[עריכת קוד מקור | עריכה]
המערכת בנויה מאלקטרודות, כבל וקוצב חשמלי בו יש סוללה.
כבל[עריכת קוד מקור | עריכה]
כבל שעובר בין הקוצב לאלקרודות ומעביר עליו את הזרם החשמלי.
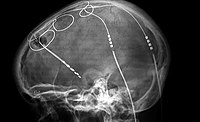
אלקטרודות[עריכת קוד מקור | עריכה]
האלקטרודות ממוקמות באזורים שונים במוח, המהווים צומת מרכזית בתפקוד המוח ולכן לגירוים יכולה להיות השפעה רחבה על המוח. לאלקטרודה המוחדרת למוח פוטנציאל שלילי, ולכן היא מושכת אליה יונים טעונים חיובית, ודוחה יונים טעונים שלילית. משיכת היונים הטעונים יוצרת שדה חשמלי במוח אשר פותח את קולטני הנתרן שנמצאים על הנוירונים. השדה החשמלי שנוצר גורם לפוטנציאל פעולה בסביבת התא, כלומר שינוי מהיר במתח החשמלי שבין פנים התא לסביבתו החיצונית, הקרוי דחף עצבי. בעקבות שינוי זה, נוצר אות חשמלי העובר בתא העצב ומשמש להולכה ועיבוד של מידע בתא. כך, האלקטרודה מאפשרת שליטה על המסר המועבר לנוירונים, ובכך השפעה על פעולות העצבים במוח.
הסוללה[עריכת קוד מקור | עריכה]
הסוללה ממוקמת בקוצב ומייצרת את הזרם הרשמלי. זאת, בעקבות ריאקציה כימית המתרחשת בין אלקטרודות הסוללה, לחומר מוליך (אלקטרוליט) ומאפשרת את יצירת הפרש הפוטנציאלים בין הקתודה (אלקטרודה שלילית), לבין האנודה (אלקטרודה חיובית). הפרש הפוטנציאלים גורם לשחרור יונים חיוביים ושליליים ויצירת זרם חשמלי. היונים החיובים שהשתחררו, נעים לכיוון הקטודה, אולם היונים השליליים לא מסוגלים לעבור דרך האלקטרוליט. לכן, חיבור קצוות הסוללה לחוט תיל ממתכת אשר מוליך חשמל, מוביל לנדידת האלקטרונים דרכו, ובכך נוצר הזרם החשמלי. בתהליך הגירוי, הזרם החשמלי מובל דרך כבל מהסוללה אל האלקטרודות שבמח בקצבים קבועים ומוגדרים.

קוצב חשמלי[עריכת קוד מקור | עריכה]
הקוצב הוא מכשיר הממוקם מתחת לעור באזור הבטן או החזה, ואחראי על שליחת האותות החשמליים המבצעים את הגירוי המוחי. הזרם החשמלי מיוצר על ידי הסוללה, ולאחר מכן מועבר אל המוח דרך הכבל והאלקטרודות באותות קבועים אותם מווסת הקוצב. לשם כך, הקוצב קובע מעגל (cycle) אחד כאשר בחלקו הוא קובע אות חשמלי נמוך ובחלקו הוא קובע אות חשמלי גבוה, שמהווה את האות הנשלח לאלקטרודות. חזרה על ה-cycle יוצרת את שליחת האותות בקצב קבוע. כך, הקוצב שומר על עוצמת האות, תדירות האותות ורוחב הפולס המתאימים, במטרה להביא לשיפור בתסמינים ללא תופעות לוואי משמעותיות. ניתן לשלוט על הקוצב באמצעות שלט הנמצא מחוץ לגוף, ולשנות את התדרים בעת הצורך, עד למציאת התדר הנכון.
פיתוחים ושימושים עתידיים[עריכת קוד מקור | עריכה]
קיימים מחקרים רבים והתפתחויות רבות בתחום הגירוי החשמלי, בין המחקרים השונים:
- שימוש בקוצב חשמלי כדי לחסום פעילות חשמלית לא תקינה המתרחשת בעת התקפים אפילפטיים. לפולסים החשמליים יש יכולות להשפיע על מעגלי העצבים ובכך לסייע בהפסקת ההתקפים, ובבקרה על המחלה.[7]
- גירוי מוחי עמוק ככלי יעיל עבור חולים הסובלים מהפרעה פסיכאטרית, הפרעה טורדנית כפייתית. זאת בזכות הקשר התפקודי של האמיגדלה- אינסולה, אשר דרך גירוי מוביל לירידה בהשפעתן אחת על השנייה. דבר זה הוביל לשיפור במצב הרוח ובחרדה שחשו המטופלים. ניסויים מסוג אלו מצביעים על התקדמות במתן טיפול למחלות פסיכאטריות דרך גירוי מוחי עמוק וצעדי מחקר משמעותיים שנעשים בתחום זה.[8]
- נמצא כי ההליך של גירוי מוחי עמוק אכן מטפל בסימפטומים מוטוריים ומשפר את איכות החיים של החולים בפרקינסון, אך עלול לגרום לתופעות לוואי נוירופסיכאטריות שליליות כמו אימפולסיביות. לכן, ישנן שאלות קליניות שטרם קיבלו מענה, כגון האם התפלגות שדה הגירוי קשורה לאותם תסמינים נוירו- פסיכאטריים, אילו רשתות מוח אחראיות להתפתחות הסימפטומים האלו, והאם ניתן לצפות זאת מראש לפניי הניתוח? מסקנות שעלו מתוך ניסוי שנעשה בנושא ומעקב אחר מטופלים לאחר הניתוח, מציעים להשתמש בטרקטוגרפיה (הדמיה) כדי לחזות את ההשפעות השליליות הניורופסיכאטריות. תוצאות הניסוי מדגישות את חשיבות מיקומן המדויק של האלקטרודות, שנמצא כי מונע את תופעות הלוואי הללו.[9]
קישורים חיצוניים[עריכת קוד מקור | עריכה]
 סמדר רייספלד, ד"ר רננה איתן ופרופ' חגי ברגמן מעניקים תקווה חדשה לסובלים מדיכאון עמוק, באתר הארץ, 6 במרץ 2015
סמדר רייספלד, ד"ר רננה איתן ופרופ' חגי ברגמן מעניקים תקווה חדשה לסובלים מדיכאון עמוק, באתר הארץ, 6 במרץ 2015- איתי עמיקם, אלקטרודה בעומק המוח – הטיפול במחלה הקשה שאף תרופה לא עוזרת לה, באתר ynet, 23 ביוני 2019
- Deep Brain Stimulation, מתוך האנציקלופדיה הכירורגית Surgeryencyclopedia.com
- גירוי מוחי עמוק, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ פרקינסון: מהם הטיפולים הקיימים?, באתר BEOK, 2 ביולי 2011
- ^ Hayriye Cagnan, Timothy Denison, Cameron McIntyre, Peter Brown, Emerging technologies for improved deep brain stimulation, Nature Biotechnology 37, 2019-09, עמ' 1024–1033 doi: 10.1038/s41587-019-0244-6
- ^ רננה איתן ואחרים, טיפול בגירוי עמוק של המוח בהפרעה טורדנית כפייתית: פרשת החולה הראשונה שטופלה בישראל, הרפואה 158, 2019, עמ' 418-422
- ^ הפגיעה המוחית שגורמת להפרעה טורדנית-כפייתית, באתר הקרן הלאומית למדע, 2017
- ^ Cellular, molecular, and clinical mechanisms of action of deep brain stimulation—a systematic review on established indications and outlook on future developments, EMBO molecular medicine (2019) Martin Jakobs, Anton Fomenko, Andres M Lozano, Karl L Kiening, Cellular, molecular, and clinical mechanisms of action of deep brain stimulation—a systematic review on established indications and outlook on future developments, EMBO Molecular Medicine 11, 2019-04-01, עמ' e9575 doi: 10.15252/emmm.201809575
- ^ Andres M. Lozano, Nir Lipsman, Hagai Bergman, Peter Brown, Deep brain stimulation: current challenges and future directions, Nature reviews. Neurology 15, 2019-3, עמ' 148–160 doi: 10.1038/s41582-018-0128-2
- ^ K. T. Elhadd, S. H. Alusi, U. C. Wieshmann, B. Hammersley, Deep brain thalamic stimulation in the simultaneous treatment of generalised epilepsy and dystonic tremor, Seizure 75, 02 2020, עמ' 87–88 doi: 10.1016/j.seizure.2019.12.019
- ^ Egill Axfjord Fridgeirsson, Martijn Figee, Judy Luigjes, Pepijn van den Munckhof, Deep brain stimulation modulates directional limbic connectivity in obsessive-compulsive disorder, Brain 143, 2020-05-01, עמ' 1603–1612 doi: 10.1093/brain/awaa100
- ^ The structural connectivity of subthalamic deep brain stimulation correlates with impulsivity in Parkinson’s disease, academic (2020) Philip E. Mosley, Saee Paliwal, Katherine Robinson, Terry Coyne, Peter Silburn, Marc Tittgemeyer, Klaas E. Stephan, Alistair Perry, Michael Breakspear, The structural connectivity of subthalamic deep brain stimulation correlates with impulsivity in Parkinson’s disease, Brain 143, 2020-07-01, עמ' 2235–2254 doi: 10.1093/brain/awaa148
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
