נפתלן
 | |||
| תרשים קוי | |||
 | |||
| מבנה הגביש המולקולרי (מוצק) | |||
| |||
| שם סיסטמטי |
Bicyclo[4.4.0]deca-1,3,5,7,9-pentaene Bicyclo[4.4.0]deca-2,4,6,8,10-pentaene | ||
|---|---|---|---|
| שמות נוספים | נפטלין | ||
| כתיב כימי |
C₁₀H₈ | ||
| מסה מולרית | 128.17 גרם/מול | ||
| מראה | גבישים לבנים מתפוררים בקלות, לפעמים פתיתים | ||
| מספר CAS | 91-20-3 | ||
| צפיפות |
1.145 (C°15.5) | ||
| מצב צבירה | מוצק | ||
| מסיסות |
במים: | ||
| ממסים | אלכוהול, אמוניה (נוזלית), חומצה קרבוקסילית, בנזן, גופרית דו-חמצנית, טטרה כלורומתאן, פחמן דיסולפיד, טולואן, אנילין | ||
| טמפרטורת היתוך |
78.2 °C 351.35 K | ||
| טמפרטורת רתיחה |
217.97 °C 491.12 K | ||
| טמפרטורת המראה |
80 °C 353.15 K | ||
| מקדם שבירה |
1.5898 | ||
| אנתלפיית התהוות סטנדרטית | 78.53 קילוג'ול למול | ||
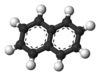
נפתלֶן (באנגלית: Naphthalene, שם מקובל: נפטלין) הוא תרכובת אורגנית ארומטית. נפתלן מורכב משתי טבעות בנזן מאוחות ונוסחתו הכימית היא C10H8.
נפתלן מופיע בטמפרטורת החדר בצורת גבישים לבנים בעלי ריח חריף. החומר עובר המראה (מעבר ישיר ממוצק לגז) בטמפרטורה של C°80, והוא מיוצר בעיקר על ידי זיקוק של זפת פחם.(אנ')
החומר משמש כחומר חיטוי וכן כחומר משמר לצורך שימורם של בדים, פרוות וכדומה מפגיעת עש. במאה ה-21 סווג הנפתלן כחומר מסרטן והשימוש הביתי בו דועך.
היסטוריה
[עריכת קוד מקור | עריכה]בתחילת שנות ה-20 של המאה ה-19 הופיעו שני דיווחים מדעיים על חומר מוצק בצבע לבן ובריח עז ודוחה, אשר הופקו מזיקוק זפת פחם. בשנת 1821 המדען הבריטי ג'ון קיד (אנ') ציטט שני דיווחים אלה כאשר תיאר רבות מתכונותיו של החומר ודרכי הפקתו. הוא הציע לקרוא לחומר בשם נפטליין (naphthaline), כיוון שהופק מסוג של "נפטא" (מונח רחב אשר התייחס אותה עת לכל חומר נוזלי דליק מתערובת פחמימנית, כולל זפת פחם).[1] הנוסחה הכימית של נפתלן תוארה לראשונה על ידי מייקל פאראדיי בשנת 1826. בשנת 1866 אמיל ארלנמאייר (Emil Erlenmeyer) היה הראשון שהציע תיאור למבנה התרכובת,[2] ושלוש שנים מאוחר יותר אושש הכימאי הגרמני קארל גראבה (אנ') את השערתו של ארלנמאייר.[3]
מבנה ותגובתיות
[עריכת קוד מקור | עריכה]ניתן לראות במולקולה של נפתלן היתוך של זוג טבעות בנזן (בכימיה אורגנית טבעות מותכות כאשר קיימים שני אטומים, או יותר, המשותפים לשתי הטבעות.). נפתלן מסווג כחלק מתרכובות פחמימנים ארומטיים רב-טבעתיים. בתרכובת שתי סדרות של אטומי מימן שקולים: עמדות האלפא מסומנות 1, 4, 5, ו-8 (ראו תרשים קווי בראש העמוד משמאל) ואילו עמדות הבטא מסומנות 2, 3, 6, ו-7.
שלא כמו בנזן, קשרי פחמן-פחמן בנפתלן אינם בעלי אורך שווה. הקשרים C1-C2, C3-C4, C5-C6 ו-C7-C8 הם בערך באורך 1.37Å (137 פיקומטר pm), בעוד שקשרי פחמן-פחמן האחרים הם באורך Å1.42 (142pm). הבדל זה נקבע בעזרת קריסטלוגרפיה בקרני רנטגן.[4] הפרש זה מתיישב עם תאוריית הקשר הערכי כשהיא מיושמת לנפתלן.
תגובתיות עם אלקטרופילים
[עריכת קוד מקור | עריכה]בתגובות התמרה עם אלקטרופילים ארומטיים, נפתלן מגיב יותר בקלות לעומת בנזן. לדוגמה, כלורינציה וברומינציה של נפתלן מתקיימת ללא זרז ומניבה, בהתאמה, 1-כלורונפתלן ו-1-ברומונפתלן. באופן דומה, בעוד שבנזן ונפתלן יכולים לעבור אלקילציה בעזרת תגובות פרידל-קרפטס, ניתן לבצע אלקילציה של נפתלן בקלות בעזרת תגובה עם אלקן, או כוהל, על ידי שימוש בחומצה גופריתית או חומצה זרחתית כזרזים.
מבחינת רגיוסלקטיביות, אלקטרופילים תוקפים את עמדת אלפא. העדפת התמרה בעמדת אלפא על פני עמדת בטא ניתנת להסבר במונחים של צורוני הרזוננס של מצב הביניים: עבור מצב הביניים של התמרה בעמדת אלפא, ניתן לצייר שבעה צורוני רזוננס, שמהם ארבעה משמרים את ארומטיות הטבעת. עבור התמרה בעמדת בטא, מצב הביניים בעל שישה צורוני רזוננס, שמתוכם רק שניים משמרים ארומטיות. תוצר הסולפונציה הקינטי הוא נותן התמרה בעמדה אלפא, בעוד שהתוצר התרמודינמי נותן התמרה בעמדה בטא. ב-25 מעלות צלזיוס התוצר העיקרי הוא תוצר התמרה בעמדה אלפא, בעוד שב-160 מעלות התוצר העיקרי הוא תוצר התמרה בעמדה בטא. נוסחת התגובה לסולפונציה היא:
- H2SO4 + C10H8 → C10H7−SO3H + H2O
המשך סולפונציה יוצר התמרה כפולה, משולשת ומרובעת.
חיזור וחמצון
[עריכת קוד מקור | עריכה]נפתלן מגיב עם מתכות אלקליות ליצירת מלחים בצבעי כחול-ירוק כהה, כגון סודיום נפתלניד, NaC10H8. מלחי הנפתלניד הם גורמי חיזור חזקים. ניתן לבצע הידרוגנציה לנפתלן תחת לחץ גבוה בנוכחות זרזי מתכת לקבלת 1,2,3,4-tetrahydronaphthalene (C10H12) הידועה גם כטטרלין (אנ'). הידרוגנציה נוספת מניבה decahydronaphthalene, הידוע גם כדקלין (אנ') (C10H18).
חמצון עם O2 בנוכחות זרז ונדיום יוצר אנהידריד פתלי (אנ'):
- C10H8 + 4.5 O2 → C6H4(CO)2O + 2 CO2 + 2 H2O
תגובה זו היא הבסיס לשימוש העיקרי של נפתלן. ניתן להביא לחמצון על ידי שימוש בכמות סטויכיומטרית של מגיבי כרומט או פרמנגנט.
ייצור
[עריכת קוד מקור | עריכה]נכון לשנת 2015, למעלה מ-90% מהנפתלן בעולם מופק מזפת פחם.[5] בין שנות ה-60 לשנות ה-90 הופקו כמויות גדולות של נפתלן גם מנפט כבד בעת תהליך זיקוק נפט, אולם במאה ה-21 רק חלק קטן מן הנפתלן בעולם מופק בדרך זו.
נפתלן מהווה את המרכיב הבודד הגדול ביותר בזפת פחם. אף שהרכב זפת פחם משתנה בהתאם לסוג הפחם שממנו הוא מופק, בדרך כלל נפתלן מהווה כ-10% ממשקל זפת פחם. בתהליך ייצור תעשייתי של נפתלן, זיקוק זפת פחם יוצר שמן המכיל כ-50% נפתלן, לצד שתים-עשרה תרכובות ארומטיות אחרות. תערובת זו נשטפת בנתרן הידרוקסידי מומס במים כדי להסיר מרכיבים חומציים (בעיקר פנול, בחומצה גופרתית כדי להסיר מרכיבים בסיסיים ועוברת זִקּוּק-הַקְטָעָה (אנ'). הנפתלן הגולמי המופק בתהליך זה מכיל כ-95% ממשקלו בנפתלן. האלחים (impurities) העיקריים בתערובת הם תרכובת אורגנית גופריתית של בנזותאופן (אנ') (פחות מ-2%), אינדן (אנ') (0.2%), אינדין (אנ') (פחות מ-2%) ומתילנפתלן (0.2%). נפתלן המופק מנפט טהור יותר בדרך כלל מזה המופק מזפת פחם. ניתן לזקק נפתלן גולמי עוד יותר בתהליך גיבוש (אנ'), בו ניתן להשיג דרגת טוהר של 99% נפתלן (אחוז משקלי). קשה לקבל הערכה מדויקת של כמויות הנפתלן המיוצרות מדי שנה בעולם, דו"ח ממשלת דנמרק העריך בשנת 2015 כי כמות הייצור השנתית העולמית היא כ-267,000 טון.[5] ייצרניות הנפתלן העיקריות הן בסין, שם מיוצרת למעלה ממחצית תוצרת הנפתלן השנתית בעולם, ארצות הברית, קנדה ומספר מדינות באירופה.
שימושים
[עריכת קוד מקור | עריכה]השימוש העיקרי בנפתלן הוא כקודמן לחומרים אחרים. השימוש הבודד הנרחב ביותר בנפתלן הוא בתהליך הייצור התעשייתי של אנהידריד פתלי, אף שחומר זה מופק יותר על ידי שימוש באורתו-קסילן (אנ') שהוא זול יותר.[5] צבעים רבים מסוג צבעי אזו (אנ') מופקים מנפתלן וכן קוטל חרקים מסוג Carbaryl.
השפעות בריאות
[עריכת קוד מקור | עריכה]חשיפה לכמויות גדולות של נפתלן עלולה לגרום נזק לתאי דם אדומים. סיכון זה גדל אצל אנשים עם המחלה התורשתית חוסר G6PD,[6] בה לוקים למעלה מ-400 מיליון איש בעולם. בני אדם, ובפרט ילדים, פיתחו אנמיה המוליטית לאחר שבלעו כדורי נפתלין, או דאודורנט המכיל נפתלן. תסמיני הפגיעה כוללים עייפות, אובדן תיאבון, עצבנות וחיוורון. חשיפה לכמויות גדולות של נפתלן עלולה לגרום לבלבול, בחילות, הקאות, שלשול, שתן דמי וצהבת (בגלל ירידה בתפקוד הכבד).[7]
הסוכנות הבינלאומית לחקר הסרטן מסווגת נפתלן כגורם מסרטן לבני אדם ולבעלי חיים (קבוצה 2B). הסוכנות אף מציינת כי חשיפה מוגברת לנפתלן עלולה לגרום לקטרקט בבני אדם, בחולדות, בארנבים ובעכברים. אנמיה המוליטית עלולה להיגרם לילדים ותינוקות הבולעים בטעות נפתלין, או אם נחשפו לנפתלין בעת ההיריון.[8]
נגזרות נפתלן
[עריכת קוד מקור | עריכה]זוהי רשימה חלקית של נגזרות נפתלן:
| שם | נוסחה כימית | מסה מולרית [g/mol] | טמפרטורת המראה [°C] | טמפרטורת רתיחה [°C] | צפיפות [g/cm3] | מקדם שבירה |
|---|---|---|---|---|---|---|
| 1-חומצה נפתואית[9] | C11H8O2 | 172.18 | 157 | 300 | – | |
| 1-נפתול כלורידי[10] | C11H7ClO | 190.63 | 16–19 | 190 (35 מילימטר כספית) | 1.265 | 1.6552 |
| 1-נפתול[11] | C10H8O | 144,17 | 94–96 | 278 | 1.224 | – |
| 1-נפתלדהייד[12] | C11H8O | 156,18 | 1–2 | 160 (15 מילימטר כספית) | ||
| 1-ניטרונפתלן[13] | C10H7NO2 | 173.17 | 53–57 | 340 | 1.22 | – |
| 1-פלואורונפתלן[14] | C10H7F | 146.16 | 19- | 215 | 1.323 | 1.593 |
| 1-כלורונפתלן[15] | C10H7Cl | 162.62 | 6- | 259 | 1.194 | 1.632 |
| 2-כלורונפתלן[16] | C10H7Cl | 162.62 | 59.5 | 256 | 1.138 | 1.643 |
| 1-ברומונפתלן[17] | C10H7Br | 207.07 | 2- | 279 | 1.489 | 1.670 |
בתרבות
[עריכת קוד מקור | עריכה]בשפת יום-יום נהוגים הביטויים:
- להוציא מהנפטלין - להחזיר דבר מוחשי או רעיון מיושנים לשימוש[18].
- לשים בנפטלין - להוציא משימוש עצם או רעיון שאבד עליהם הכלח[19].
קישורים חיצוניים
[עריכת קוד מקור | עריכה]- נפתלן, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ John Kidd (1821). "Observations on Naphthalene, a peculiar substance resembling a concrete essential oil, which is produced during the decomposition of coal tar, by exposure to a red heat". Philosophical Transactions. 111: 209–221. doi:10.1098/rstl.1821.0017.
- ^ Emil Erlenmeyer, Studien über die s. g. aromatischen Säuren. Annalen der Chemie und Pharmacie, 1866;137:327-359
- ^ C. Graebe (1869) "Ueber die Constitution des Naphthalins" (On the structure of naphthalene), Annalen der Chemie und Pharmacie, 149 : 20–28.
- ^ Cruickshank, D. W. J.; Sparks, R. A. (18 October 1960). "Experimental and Theoretical Determinations of Bond Lengths in Naphthalene, Anthracene and Other Hydrocarbons". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 258 (1293): 270–285. Bibcode:1960RSPSA.258..270C. doi:10.1098/rspa.1960.0187.
- ^ 1 2 3 Survey Of naphthalene (CAS 91-20-3). Danish Ministry of the Environment 2015
- ^ Santucci K, Shah B (Jan 2000). "Association of naphthalene with acute hemolytic anemia". Acad Emerg Med. 7 (1): 42–7. PMID 10894241
- ^ Naphthalene poisoning. MedlinePlus
- ^ Some Traditional Herbal Medicines, Some Mycotoxins, Naphthalene and Styrene. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, 2002;82
- ^ 1-Naphthoic acid
- ^ 1-Naphthoyl Chloride
- ^ 1-1-Naphthol
- ^ 1-Naphthaldehyde
- ^ 1-Nitronaphthalene
- ^ 1-Fluoronaphthalene
- ^ 1-Chloronaphthalene
- ^ 2-Chloronaphthalene
- ^ 1-Bromonaphthalene
- ^ הוציא מהנפטלין, באתר hebrew.en-academic.com
- ^ שָׂם אותו בּנַפטָלין, באתר מילון אבניאון - מילון עברי עברי