טיוטה:מערכת החיסון הנרכשת
מערכת החיסון הנרכשת (בלועזית: Adaptive Immune System) הינה ענף מרכזי של מערכת החיסון אשר מאופיין בזיכרון חיסוני [1]. משמעות הדבר היא שמערכת זו נוטה להגיב בעוצמה מתגברת עם כל חשיפה חוזרת לאנטיגן מסוים. מערכת החיסון הנרכשת ומערכת החיסון המולדת יחדיו מרכיבות את כלל מערכת החיסון. החלוקה בין המערכת הנרכשת למולדת מבוססת על תכונותיהם של התאים המעורבים בכל אחת מן המערכות, וכן לקצב ומקצב התגובות החיסוניות[2][3]. בעוד שמערכת החיסון המולדת פעילה באופן תמידי, או מופעלת במהירות לאחר חשיפה לאנטיגן (דקות-שעות), תגובה חיסונית נרכשת מתפתחת לאורך ימים רבים לאחר החשיפה. יחד עם זאת, בזכות הזיכרון החיסוני, חשיפות חוזרות לאנטיגן מקצרות את זמן התגובה ומאיצות את פעילותה של המערכת הנרכשת.
זיהוי אנטיגן זר על ידי מערכת החיסון המולדת מתבצע באמצעות מספר מצומצם של קולטנים המתמחים בתבניות פתוגניות כלליות[4]. קולטנים אלו נקראים כמשפחה Pattern Recognition Receptors (PRR). כיום ידועות 5 קבוצות מובחנות של קולטני PRR, כאשר הקבוצה המוכרת מכולם הינה Toll-Like Receptors (TLR)[5].
קולטני PRR שונים מתמקדים בזיהוי אלמנטים פתוגניים ספציפיים: למשל, TLR 4/4 קושר את השומן-המסוכרר LPS, מאפיין בולט של חיידקים גראם-שליליים רבים; הקולטן TLR 5/5 קושר את חלבוני הפלג'לין, מרכיבים ייחודיים לפלג'לה (איבר תנועה של חיידקים); ואילו הקולטן TLR 3/3 קושר RNA דו-גדילי, סממן הדגל של הדבקה ויראלית[4][5][6]. כך קולטנים אלו אינם ספציפיים לחיידק בודד, אלא לקבוצות רבות של פתוגנים שונים.
בניגוד חד לכך, מערכת החיסון הנרכשת קושרת אנטיגנים זרים על ידי קולטנים ספציפיים; לכל אנטיגן רצפטור ייחודי לו ורק לו. קולטנים אלו ממוקמים על גבי תאי T ותאי B בלבד, ולכן נקראים TCR ו-BCR בהתאמה (T-Cell Receptor ו-B-Cell Receptor). נוגדנים הינם קולטני BCR אשר מתנתקים מתאי ה-B ומופרשים לסביבה - חלקם נישאים בזרם הדם, חלקם בעלי יכולת חציית שלייה, וחלקם ממוקמים במערכות הפרשה כגון מערכת העיכול והנשימה [7]. יכולת הקישור והזיהוי של מערכת החיסון הנרכשת לאנטיגנים ממוקמת בסדרי גודל אסטרונומיים, עם הערכות הנעות בין אנטיגנים שונים. תכונות אלו - הכוללות את המגוון העצום, יכולת שיפור הזיהוי בכל חשיפה חוזרת, ושמירת המידע בדבר האנטיגנים השונים הציבו את מערכת החיסון הנרכשת כתחום מחקר מרכזי באימונולוגיה.
ארכיטקטורת מערכת החיסון הנרכשת[עריכת קוד מקור | עריכה]
מערכת החיסון הנרכשת נאלצת להתמודד עם אתגר ייחודי, והוא זיהוי מגוון עצום של פתוגנים שונים. כיצד אפוא ניתן להתמודד עם נגיף, אויב תוך-תאי, ובאותה נשימה עם תולעת, חיידק או פטרייה אשר הינם חוץ-תאיים? בעיה זו נפתרת באמצעות חלוקת עבודה בין תאים שונים של המערכת: תאי T מתמחים בהשמדת תאים-עצמיים-חריגים, כמו למשל אלו אשר עברו התמרה סרטנית או נדבקו בנגיף; ואילו תאי B מתמחים בהשמדת גופים זרים חוץ-תאיים. לפיכך לתאים אלו ישנם קווי דמיון משותפים (כגון זיכרון חיסוני וקולטנים ספציפיים לאנטיגן מסוים), אך גם שוני רב שיפורט בהמשך. בין היתר ניתן למנות את תהליכי התפתחות נפרדים, דרכי זיהוי אנטיגן, מנגנוני פעילות "אפקטוריים" (מנגנוני השמדת פתוגנים), יכולת שינוי והשבחת הקולטנים לאורך זמן, ועוד.

תאי B, באמצעות קולטן ה-BCR שלהם, נקשרים באופן ישיר לאנטיגן התואם להם. קולטנים אלה מזהים את המבנה התלת-ממדי והנאטיבי של האנטיגן במבנה שלישוני. לאחר הקישור, קולטני ה-BCR יופרשו בכמויות גדולות, ולמעשה יהפכו לנוגדנים. על פי עדויות מעבדתיות, תא B משופעל אשר מפריש נוגדנים (נקרא 'תא פלזמה') מסוגל לייצר 2,000-10,000 נוגדנים בשנייה[2]. נוגדנים מסייעים להשמדת פתוגנים במספר רב של מנגנונים אשר יפורטו בהמשך.
להבדיל, תאי T אינם מייצרים נוגדנים ואינם קושרים באופן ישיר את האנטיגן, אלא רק לאחר שהוא עובר תהליך של עיבוד (processing) והצגה (presentation) על ידי תאים אחרים. למעשה, תאי T אינם מזהים אנטיגן נאטיבי כלל וכלל, אלא רק שברים או מקטעים קטנים של פפטידים במבנה ראשוני מתוך האנטיגן המקורי. פפטידים זרים אלו מוצגים על גבי קומפלקס חלבוני אשר נעוץ בממברנות של תאים עצמיים ונקרא Major Histocompatability Complex) MHC) [8]. כפי שיתואר בהמשך, ישנם שני סוגים של מולקולות MHC הנבדלים במספר תכונות. חלקם נפוצים בכל תאי הגוף (MHC Class I), ואילו אחרים ממוקמים אך ורק על חלק מתאי מע' החיסון (MHC Class II). ביטוי בלתי שיוויוני זה מרמז על פעולות ייעודיות שונות של תאי T, בהתאם לקישור ל-MHC. בעוד שתאי B נאבקים בפתוגן על ידי יצירת נוגדנים, תאי T מבצעים את פעולתם באמצעות הפרשת ציטוקינים ומולקולות נוספות אשר מובילות לעיצוב התגובה החיסונית, ולהרג של תאים מודבקים, בהתאמה [9].

תאי מערכת החיסון[עריכת קוד מקור | עריכה]
 ערך מורחב – תא דם לבן
ערך מורחב – תא דם לבן
כל תאי מע' החיסון, גם זו הנרכשת וגם זו הנלמדת, מקורם בתאי גזע משותפים. תאי גזע אלו נקראים HSC - (Hematopoietic Stem Cells) והם בעלי יכולת התמיינות מגוונת [10]. בתחילת תהליך ההתמיינות, תאים אלו מתחייבים לאחת משתי שושלות: מיאלואידית או לימפואידית. תאים מיאלואידיים בוגרים כוללים את מרבית תאי מע' החיסון המולדת, וכן טסיות דם ותאי דם אדומים [11]. תאים לימפואידיים מבשילים לכדי כלל תאי מע' החיסון הנרכשת, והם: לימפוציטים מסוג T; ולימפוציטים מסוג B. ישנם גם תאים לימפואידיים שאינם שייכים למערכת החיסון הנרכשת, כגון תת-סוגים ספציפיים של תאים דנדריטיים, תאי NK ותאי NKT [12][13][14].
תאי HSC ממוקמים במח העצם (Bone Marrow), ובמשך כל חייהם עוברים חלוקה מיטוטית. תאי ה-B נוצרים לראשונה במח העצם, וגם נותרים בו עד להשלמת התפתחותם. שמם של תאי ה-B נגזר מן האיבר בו הם התגלו לראשונה, 'הבורסה על שם פבריציוס' (Bursae of Fabricius), מבנה אנטומי הקיים בעופות [15]. תאי T לעומתם נוצרים במח העצם אך נודדים בשלב מוקדם אל עבר בלוטת התימוס (Thymus), שם הם משלימים את תהליך ההבשלה וההתבגרות. אלו הסובלים מפגיעה מולדת בבלוטת התימוס, למשל עקב תסמונת די-ג'ורג', נאלצים להתמודד עם פעילות ירודה של מע' החיסון הנרכשת בכל ימי חייהם [16].
האתרים בהם מתבצעת ההתמיינות וההבשלה של תאי T ו-B, התימוס ומח העצם, נקראים איברים לימפואידיים ראשוניים - Primary Lymphoid Organs.
התפתחות לימפוציטים - איברים לימפואידיים ראשוניים[עריכת קוד מקור | עריכה]
בניגוד לתאי מע' החיסון המולדת, ללימפוציטים מסוג T ו-B ישנה תכונה ייחודית; על פני הממברנה שלהם מוצבים קולטנים המסוגלים להבדיל באופן ספציפי בין גורם זר לבין מרכיב עצמי (Self and Nonself). הקולטנים הללו נוצרים באופן רנדומי על ידי שחלוף (רקומבינציה) של מספר מקטעים גנטיים המרכיבים יחדיו את הקולטן [2]. במידה והתפתחות הקולטנים של תאי T ו-B היא אכן רנדומית, כיצד נמנעת יצירתם של קולטנים המובילים לפגיעה עצמית? אם כל קולטן רנדומי מזהה רק אנטיגן ספציפי ובודד, כיצד ניתן לעורר במהירות מספקת תגובה חיסונית בין פתוגן ללימפוציט נדיר - בטרם הזיהום הופך לבלתי נשלט?
כפי שנראה בהמשך, המבנה והתפקוד של איברי הלימפה הראשוניים מסייע במניעת הופעת תאים אוטו-ריאקטיביים, ואילו המבנה והתפקוד של איברי הלימפה השניוניים (היכן שמתבצע האימון החיסוני לאחר חשיפה לאנטיגן) מסייע ליצירת תגובה חיסונית מהירה ומספקת כנגד פולשים זרים [2].
התפתחות תאי B[עריכת קוד מקור | עריכה]

תאי B מתפתחים במח העצם בלוח זמנים צפוי, אשר כולל ביטוי גנים ספציפיים באופן סדרתי, וכן שינוי המקטעים הגנטיים האחראיים ליצירת קולטן ה-BCR. התפתחות זו כוללת שלושה שלבים מרכזיים: שלב מוקדם בשם Pro-B Cells; שלב ביניים המכונה Pre-B Cells; ולבסוף Mature B Cells. מדובר בתאי B בוגרים אך נאיביים - כלומר בשלב זה התאים מוכנים לפגוש אנטיגן זר, אך עוד לא עשו כן [17]. במהלך ההתמיינות וההבשלה של תאי ה-B מתעצב קולטן ה-BCR הרנדומי, כפי שיתואר מיד.
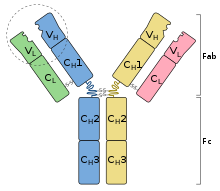
כל קולטן של תא B מורכב מ-4 שרשראות חלבוניות, כאשר 2 הן כבדות (Heavy) ו-2 קלות (Light). בתורן, כל שרשרת מכילה אזור קבוע (Constant) ומשתנה (Variable). האיזור המשתנה הוא זה אשר יהיה במגע ישיר עם האנטיגן ויקשור אותו. ישנה גם חלוקה מרחבית נוספת לקולטן ה-BCR, אשר מסווגת בהתאם לאיזור הציר (Hinge Region): בסיס הנוגדן, שמכיל רק איזור קבוע, נקרא "המקטע הקריסטבילי" (Crystable Fragment), או בקיצור Fc. לעומת זאת המקטע העליון אשר כולל גם איזור קבוע אוגם איזור וריאבילי נקרא "מקטע קשירת האנטיגן" - או בלועזית Antigen Binding Fragment (בקיצור Fab).
גנטית, האזור המשתנה (Variable) מקודד ברמת ה-DNA מקסטה אשר נקראת V(D)J Cassette. כל קסטת V(D)J מורכבת ממקבץ של שלושה גנים (D, V ו-J), אשר נבחרים באופן רנדומלי. מכיוון שישנם מקטעים V/D/J רבים, ניתן בקומבינציות שונות לייצר מגוון רב מאוד של קולטני BCR ספציפיים. הגנום האנושי מכיל כ-40 מקטעי VH, כ-25 DH ו-6 JH (אשר ירכיבו שרשרת כבדה רנדומית), ובמקביל כ-70 VL ו-10 JL (אשר ירכיבו שרשרת קלה רנדומית)[2][18]. ביתר פירוט, בכל תא B מתפתח תיווצר שרשרת כבדה אשר תכיל מקטע VH בודד, מקטע DH בודד ומקטע JH בודד. לשרשראות כבדות אלו תתחבר שרשרת קלה המכילה מקטע VL בודד ומקטע JL בודד. תהליך ההרכבה הנ"ל, בו נבחרים מקטעי V(D)J לכדי יצירת BCR מסוים נקרא V(D)J Recombination, והחלבונים אשר מבצעים את ה-V(D)J Recombination נקראים RAG1/2 [19]. באמצעות תהליך זה ניתן ליצור כ-107 קומבינציות שונות של BCR כבר בשלב מוקדם של התפתחות התאים.
| שרשרת כבדה | שרשרת קלה | |
|---|---|---|
| V | 38-44 | 67-81 |
| D | 23 | |
| J | 6 | 10 |
בהסתמך על אסטרטגיה זו בלבד, עלולים להיווצר קולטנים אוטו-ריאקטיביים, ויש לסלקם. סילוקם מתבצע באמצעות סלקציה-שלילית. תא-B אשר יקשור אנטיגן עצמי במהלך התפתחותו יושמד, או שיכנס למצב בלתי-פעיל הנקרא אָנֵרְגִּיָּה (Anergy). רק תאים אשר ישרדו את הסלקציה השלילית במח העצם יוכלו לנוע אל עבר הטחול לסיום תהליך ההבשלה, ולאחר מכן ישתחררו לזרם הדם כלימפוציטים נאיביים ובוגרים. תאים אלו נעים בין איברי לימפה שניוניים (בלוטות לימפה) בחיפוש מתמיד אחר האנטיגן המתאים להם [20].
יש לציין כי ישנם מנגנונים נוספים המגבירים את מגוון יצירת קולטני ה-BCR מלבד V(D)J Recombination, כמו למשל הוספת נוקלאוטידים באתרים הוריאביליים באמצעות החלבון TdT, וכן הצלת נוגדנים ריאקטיביים באמצעות Receptor Editing. במנגנון זה, תא אשר כבר עבר V(D)J Recombination, אך התוצר מזהה מרכיבים עצמיים, עשוי לעבור סבב רקומבינציה נוסף. במידה ולאחר הרקומבינציה הקולטן יאבד את יכולת הקישור לאנטיגן עצמי, הוא יינצל ותא ה-B ישלח לפריפריה. מנגנונים נוספים יתוארו בהמשך.
סוגי שרשראות קלות וכבדות[עריכת קוד מקור | עריכה]

השרשראות הכבדות והקלות של הנוגדנים מסווגות למספר מחלקות. בבני אדם ומכרסמים ידועים 2 סוגים של שרשראות קלות, המסומנות באותיות קאפא (κ) ולמדא (λ). מסתמן כי אין הבדל פונקציונלי בין שרשראות קלות אלו, אך בעכברים נוצרות שרשראות קלות מסוג קאפא לפני שרשראות למדא. שרשראות כבדות בתורן מחולקות ל-5 משפחות: דלתא (δ), מיו (μ), גאמא (γ), אלפא (α) ואפסילון (ε). כפועל יוצא ישנם חמישה סוגים ראשיים של קולטני BCR ונוגדנים, המסומנים בהתאם לשרשראות הכבדות אותם הם מכילים: IgE, IgA, IgG, IgM, IgD (בהתאמה). הקידומת Ig מציינת 'אימונוגלובולין' (מילה נרדפת לנוגדן). כל משפחה או סוג של נוגדנים מציגה תכונות ביולוגיות ייחודיות, וחבריה מסומנים במספרים (לדוגמה, IgG1 ו-IgG3) [21].
נוגדני IgM הינם הנוגדנים הראשונים שמיוצרים על ידי תאי B, ובתחילת התפתחותם כל קולטני ה-BCR הינם מסוג IgM. גם נוגדני IgM וגם נוגדני IgG נישאים בזרם הדם, וכן שני סוגים אלו מסוגלים לשפעל את חלבוני מערכת המשלים. יחד עם זאת, רק נוגדני IgG מסוגלים לחצות את השלייה; אלו הם הנוגדנים היחידים שמבצעים פעולה זו, וכל הנוגדנים האמהיים איתם נולד תינוק הינם מסוג IgG. נוגדני IgA מופיעים בעיקר בנוזלי הפרשה, כגון במערכת העיכול, מערכת הנשימה ובחלב אם. נוגדני IgE קיימים בכמות קטנה בגוף האדם, ופעילותם קשורה לוויסות תגובה חיסונית כנגד טפילים, וכן באלרגיה. לבסוף נוגדני IgD מבוטאים על פני השטח של תאי B נאיביים, אך מלבד זאת פעילותם הפונקציונלית עדיין לא ברורה דיה. מרבית תאי ה-B הנאיביים אשר משתחררים ממח העצם לפריפריה מבטאים גם IgM וגם IgD.
התפתחות תאי T[עריכת קוד מקור | עריכה]

תאי T מתפתחים באופן סדרתי וצפוי, באופן דומה למדי להתפתחותם של תאי B. גם קולטנים אלו מציגים מגוון רחב מאוד בזכות V(D)J Recombination, וישנה סלקציה שלילית במהלך התפתחותם אשר מסייעת להפחתת פעילות אוטו-ריאקטיבית. יחד עם זאת, ישנם מספר הבדלים אותם נציין כעת. ראשית, בשלב מוקדם של ההתפתחות, לימפוציטים אשר התחייבו להיותם תאי T נודדים ממח העצם אל עבר בלוטת התימוס. כאן תאים אלו יתבגרו ויבשילו, ורק לאחר מכן ינועו דרך זרם הדם לאיברי לימפה שניוניים. קולטן של תאי T, בניגוד ל-BCR, לעולם נותר צמוד לממברנה של הלימפוציט ואיננו משתחרר כנוגדן.
קולטן ה-TCR מורכב משתי שרשראות פפטידיות אשר מכילות אזור קבוע (Constant) ומשתנה (Variable). ידועים ארבעה סוגים של שרשראות פפטידיות בקולטני TCR: אלפא (α), ביטא (β), גאמא (γ) ודלתא (δ). כל TCR בתורו הוא הטרודימר אשר מכיל שתי שרשראות שונות. רוב תאי ה-T, כ-80%, מכילים קולטן +α+β, והיתר מכילים קולטן המורכב משרשראות +γ+δ. מרבית הידע שהצטבר בדבר תאי T מקורו בתאי +α+β, ולכן ערך זה יתייחס בעיקר לתאים אלו. יש לציין כי תאי +γ+δ מציגים תכונות חריגות בנוף המחקרי, כמו למשל קישור לאנטיגן שאיננו מוצג על גבי MHC, והם נפוצים במיוחד במוקוזה של מערכת העיכול.

בדומה ל-BCR, האתר הוריאבילי של כל שרשרת TCR עובר V(D)J Recombination. שרשראות אלפא וגאמא עוברות VJ Recombination בדומה לשרשראות קלות ב-BCR, ואילו ביטא ודלתא עוברות V(D)J Recombination בדומה לשרשראות כבדות.
במהלך השהות של הלימפוציטים בתימוס, מפתחים התאים באופן רנדומי קולטן TCR אשר מסוגל לקשור אנטיגן מסוים. קולטן זה מסוגל אמנם לקשור אנטיגנים, אך קישור שכזה איננו מתווך אותות תוך-תאיים. איתות תוך-תאי מתרחש רק לאחר קישור הקולטן לשתי שרשראות זיטא (ζ) בצד הפנימי של הממברנה התאית, וכן לקומפלקס חלבוני בשם CD3 אשר מכיל 4 שרשראות חלבוניות נוספות (דלתא, גאמא ושתי שרשראות אפסילון). יתרה מכך, פעילותם של קולטני ה-TCR תלויה גם בקו-רצפטור נוסף שיכול להיות אחד משני סוגים, או CD4 או CD8. תאי T מסווגים בהתאם לסוג הקו-רצפטור אותם הם מבטאים, ולכן נקראים גם תאי +CD4 או +CD8 בהתאמה.

בתחילת ההתפתחות של תאי T בתימוס הם אינם מבטאים אף קו-רצפטור, ולכן נקראים double-negative. בהמשך יבטאו התאים גם CD4 וגם CD8 (ולכן יקראו double-positive), ולבסוף יתחייבו רק לאחד מהקו-רצפטורים (single-positive).
מולקולות אלה, CD4 ו-CD8, קושרות אתרים שמורים במולקולות ה-MHC אשר עליהן מוצג אנטיגן לקישור על ידי ה-TCR. ישנו קישור ספציפי בין CD8 לבין MHC Class I, ובאופן דומה קישור ספציפי בין CD4 לבין MHC Class II. מכיוון ש-MHC Class I מבוטא בכל תאי הגוף, תאי T המבטאים CD8 מסוגלים לעבור אינטראקציה עם כלל תאי הגוף; לעומת זאת MHC Class II מופיע רק בקרב חלק מתאי מע' החיסון, ולכן תאי T מסוג +CD4 מסוגלים לעבור אינטראקציה אך ורק עם תאים ייחודיים אלה.
תהליכי סלקציה בבלוטת התימוס[עריכת קוד מקור | עריכה]

כאמור, קולטני ה-TCR נוצרים ברקומבינציה סומטית רנדומלית (V(D)J Recombination). כיצד אם כן נמנעת הופעתם של תאי T אוטוריאקטיביים? התשובה לכך נעוצה בתהליכי סלקציה באזורים שונים של בלוטת התימוס. ראשיתו של דבר במעטפת החיצונית של התימוס שנקראת ה'קורטקס'. באזור זה ממוקמים תאים אשר מבטאים אנטיגנים-עצמיים, וכ-80% מתאי ה-T המתפתחים אינם מסוגלים לקשור אותם. בשלב זה תאי ה-T, שהינם double-positive, עוברים סלקציה חיובית, כך שבהיעדר קישור לאנטיגן עצמי תאי ה-T מושמדים. כעת כל תאי ה-T ששרדו הינם אוטו-ריאקטיביים. בהתאם לקישור ל-MHC, זונחים התאים את אחד הקו-רצפטורים והופכים ל-single-positive. מעתה ואליך תאים אלו יהיו מסוגלים לקשור אנטיגנים אך ורק בקישור ל-MHC תואם, תכונה המכונת MHC Restriction. מכאן התאים נעים למרכז בלוטת התימוס (medulla), שם מתהפת הסלקציה. כעת התאים יחוו תהליך של סלקציה שלילית (בנוכחות אנטיגנים עצמיים גם כן), ורק אלו אשר ימנעו מקישור אנטיגן ישרדו. כל התאים השורדים את השלב הנוכחי אינם קושרים אנטיגנים עצמיים - או לפחות אינם קושרים אנטיגנים אלו בעוצמה רבה.
בסופו של דבר רק כ-2% מתאי ה-T צולחים את תהליכי הסלקציה, ומשתחררים כתאי T בוגרים (single-positive) לזרם הדם ואיברי לימפה שניוניים. זאת בניגוד לסלקציה השלילית הבלעדית במח העצם אשר נצפית במהלך התפתחותם של תאי B.
תאי T רגולטוריים[עריכת קוד מקור | עריכה]
בשנים האחרונות התגלה כי ישנם תאי T אשר קושרים באופן חריג אנטיגנים עצמיים. יחד עם זאת, תוצאת הקשירה היא איננה תקיפה עצמית והיווצרות מחלה אוטואימונית, אלא הפחתה של תגובות חיסוניות. תאים אלו מבצעים את פעילותם באמצעות הפרשת ציטוקינים מדכאי-דלקת, כפי שיתואר בהמשך. חלק מתאי ה-T הרגולטוריים מתפתחים כבר בתימוס, על בסיס הסלקציה החיובית בקורטקס. תאים אלו נקראים גם Natural Regulatory T cells, או בקיצור nTregs. מנגד, ישנם תאי T רגולטוריים אשר נוצרים לראשונה בפריפריה, לאחר שעברו גם סלקציה חיובית וגם סלקציה שלילית בתימוס. תאים אלו נקראים Inducible Regulatory T cells, או בקיצור iTregs. מסתמן כי תאים אלו לוקחים תפקיד מכריע בעיקר במניעת הופעת מחלות אוטואימוניות, אך גם בסיום תגובות חיסוניות כנגד פתוגנים. ישנן עבודות אשר הדגימו פגיעה דיפרנציאלית בתאי T רגולטוריים לאחר הידבקות ב-SARS CoV 2, ולכן ישנו חשש כי מגפת הקורונה תעלה את שכיחותן של מחלות אוטואימוניות באוכלוסייה [22][23][24][25].
איברים לימפואידיים שניוניים[עריכת קוד מקור | עריכה]

הלימפוציטים הבוגרים, אשר צולחים את תהליכי הסלקציה באיברי הלימפה הראשוניים (תימוס ומח עצם), נכנסים לזרם הדם ומשם ממשיכים לאיברים לימפואידים שניוניים. אתרים אלו נקראים גם Secondary Lymphoid Organs (SLO), והידועים שבהם כוללים את בלוטות הלימפה, הטחול, ואת ה-MALT (רקמה לימפתית הטבועה במוקוזה, Mucosa Associated Lymphoid Tissue). קשריות הלימפה הן מבנים מסודרים אשר תפקידם הוא ניקוז אנטיגנים מאיברי הגוף השונים באמצעות הנוזל הלימפתי, איגרתם והעלאת ריכוזם. אגירת אנטיגנים מהווה סוגיה מכרעת ביצירת תגובה חיסונית אדפטיבית יעילה, שכן כך מתבצע הממשק בין הלימפוציטים הבוגרים לבין האנטיגנים התואמים להם. הטחול הוא מבנה אנטומי ייחודי אשר מבצע תפקיד דומה לקשריות הלימפה, אך מנקז באופן ישיר את זרם הדם. לבסוף ה-MALT מהווים מקבצים של רקמה לימפתית הממוקמים במשטחים מוקוזליים (כגון מערכת העיכול, המערכת הגניטו-אורינרית ומערכת הנשימה). ישנם איברי MALT רבים, וביניהם אפשר למנות את השקדים, האדנואידים, האפנדציט, Peyer's Patch במעי הדק, ועוד.
המאפיין המשותף לכלל אתרי ה-SLO הוא ארכיטקטורה פנימית סדורה, המציבה אזור נפרד לכל תת-סוג של תאים ממערכת החיסון הנרכשת. למשל, מרבית תאי ה-B מתאגדים לכדי גופיפים הנקראים פוליקולות בחלקו החיצוני של בלוטות הלימפה (Cortex). במידה ותא B ישופעל על ידי אנטיגן, ייווצר מבנה שנקרא Germinal Center, ובו תחל התרבות מאסיבית של תא זה. תאי ה-T הינם מפוזרים יותר, ונמצאים פנימית ביחס לתאי ה-B, באזור הפארא-קורטיקלי (Paracortex). ישנם תאים נוספים הממוקמים הן בחלקו הפריפרי של הקורטקס, והן במרכז המדולרי של בלוטות לימפה תקינות. אלו כוללים תאים בולעניים כמו מקרופאג'ים ותאים דנדריטיים, לצד תאים סטרומליים (מבניים) המרכיבים את הבלוטה ותומכים בה. התאים הללו, ובעיקר תאים דנדריטיים, משחקים תפקיד מרכזי בשפעול לימפוציטים להתחלת התגובה החיסונית כפי שיתואר בהרחבה בהמשך. תאים אלו גם מסייעים כדרך קבע בשינוע תאי T ו-B לאזורים המתאימים להם בתוך ה-SLO השונים. שינוע זה מתבצע באמצעות הפרשה מתמדת של חלבונים קטנים המעודדים תנועת תאים חיסוניים - חלבונים אשר נקראים כימוקינים.
סריקת אנטיגנים ב-SLO[עריכת קוד מקור | עריכה]
גוף האדם מכיל כ-109 לימפוציטים נאיביים בוגרים. יחד עם זאת, ההסתברות של לימפוציט להימצא כמתאים לפתוגן ספציפי היא נמוכה ביותר, ומשוערת בכ-1/106[2]. רק לאחר מפגש של לימפוציט עם אנטיגן תצא לפועל התגובה החיסונית הנרכשת. כיצד אם כן צולח לימפוציט מסוים את מציאת האנטיגן הנדיר אשר תואם לו? התשובה לכך נעוצה בְּמִחְזוּר תנועתם של הלימפוציטים בין ה-SLO השונים באופן תמידי. הלימפוציטים הנאיביים אשר חדרו לאיברים לימפואידיים שניוניים אינם נחים במקומם, אלא הם נודדים שוב ושוב דרך זרם הדם לאתרי SLO נוספים. התאים הסטרומליים (מבניים) הממוקמים בכניסה ל-SLO מפרישים כימוקינים המאותתים ללימפוציטים לנוע לעברם, וכן מולקולות אדהזיה המאפשרות ללימפוציטים לשהות זמן קצר באתר לימפואידי זה. במידה וימצא אנטיגן תואם, תיעצר תנועת הלימפוציטים ותוכל לצאת לפועל תגובה חיסונית, אך במידה ולא יהיה בנמצא אנטיגן זמין - ינועו הלימפוציטים מהקורטקס/פאראקורטקס אל עבר פנים הבלוטה, ומשם יצאו חזרה לסירקולציה במערכות הלימפה והדם.
כפי שנכתב לעיל, תפקיד מרכזי של אתרי SLO הינו אגירת אנטיגנים והעלאת ריכוזם - אך כיצד מגיעים אנטיגנים לאתרים אלו? מתברר אפוא כי ישנם שני מנגנונים מרכזיים להשלמת משימה זו. חלק מן האנטיגנים מגיעים לבלוטות לימפה באופן חופשי דרך הנוזל הלימפתי (או דם במקרה של הטחול); ואילו אחרים נישאים על גבי תאי מערכת החיסון המולדת מן הפריפריה אל תוך הבלוטה. שני המנגנונים הללו יתוארו בהמשך.
תאי APC ומולקולות MHC[עריכת קוד מקור | עריכה]

לאחר פלישת פתוגן לרקמות הגוף, חלק תאי מערכת החיסון המולדת אשר מוצבים מבעוד מועד ברקמה מגיבים במהרה. תאים אלו, הנקראים גם תָּאִים סֶנְטִינָלִיִּים (Sentinel Cells), כוללים בין היתר פאגוציטים כמו מקרופאג'ים ותאים דנדריטיים. כאמור, תאים אלו כולאים אנטיגנים ונושאים אותם אל עבר האיבר הלימפואידי השניוני הקרוב אליהם ביותר. על מנת שתא T ישופעל ויתרבה, יש צורך בראש ובראשונה בהצגת האנטיגן על גבי מולקולות MHC. תאים דנדריטיים, אך גם מקרופאג'ים ותאי B, הם ייחודיים בכך שביכולתם להציג אנטיגנים הן על גבי MHC Class I, וגם על מולקולות MHC Class II. כפועל יוצא, מסוגלים תאים אלו לעורר גם תאי +CD8, אך גם תאי +CD4. הצגת אנטיגן לתאי +CD4 היא איננה טריוויאלית, ולמעשה מאפיינת אך ורק את התאים הללו. לכן נהוג לכנות את התאים הללו כ"תאים מומחים בהצגת אנטיגן" - Professional Antigen Presenting Cells, או APC/pAPC. מבין שלושת סוגי ה-APC's (תאי B, מקרופאג'ים ותאים דנדריטיים), תאים דנדריטיים נחשבים ליעילים ביותר, ובעלי תפקיד מכריע באקטיבציה הראשונה של לימפוציטים נאיביים.
MHC Class I[עריכת קוד מקור | עריכה]

מולקולות MHC Class I בנויות משרשרת פפטידית ארוכה, אליה מוצמדת באופן לא-קוולנטי מולקולה נוספת בשם ביטא-2-מיקרוגלובולין (β2M). בקצה של קומפלקס זה מופיע שקע ייעודי, שם נח האנטיגן אשר יוצג בהמשך לתאי ה-+CD8. מולקולות אלו אינן מציגות את האנטיגן המקורי בשלמותו, אלא רק מקטע קטן ממנו, לרוב בן 8–10 חומצות אמינו. כל תאי הגוף מבטאים מולקולות אלו כדרך קבע, לא רק תאי APC, והקישור בין ה-MHC I לבין האנטיגן מתבצע כדלהלן: בכל רגע נתון, מבטאים תאים חלבונים חדשים, שכן תוחלת החיים הממוצעת של חלבון תוך-תאי עומדת על כ-2 ימים. חלבונים אלו מפורקים לבסוף בציטופלזמה על ידי הפרוטאזום, לאחר סימון בשרשרת יוביקוויטין. הפרוטאזום מבקע את החלבונים, אך תוצרי הפירוק הם אינם חומצות אמינו בודדות, כי אם פפטידים בני 3–20 חומצות אמינו. חלק מבין תוצרי פירוק אלו, אשר נבחרים באופן רנדומי, מועברים מהציטוזול ל-ER דרך מערכת הטרנספורטים TAP-1/TAP-2. חלבוני ה-TAP מרכיבים יחדיו תעלה בדופן ה-ER המאפשרת מעבר תלוי-ATP לפפטידים באורך 8–16 חומצות אמינו. במקביל, מולקולות MHC I חדשות קושרות כבר במהלך היווצרותן ב-ER את מולקולות ה-β2M. קומפלקס זה איננו יציב ללא אנטיגן, ולכן מיוצב על ידי מספר צ'פרונים עד להשלמת הקישור לאנטיגן. צ'פרונים אלו כוללים מספר חלבונים, וביניהם קלנקסין, קלרטיקולין, טפסין, PDI, ERp57 ועוד. הקומפלקס היציב, המורכב מ-MHC I, β2M והצ'פרונים, מאפשר את העמסת האנטיגן. יחד עם זאת, לא כל שברי-החלבונים ב-ER מוצגים על גבי MHC I, אלא מתוכם נבררים רק אלו המציגים מוטיף המתאים לקישור למולקולות אלה (ראה: Structural Motif)[2]. לאחר השלמת העמסת האנטיגן, משתחררים הצ'פרונים מן הקומפלקס. קומפלקס האנטיגן/MHC מועבר בסופו של דבר לממברנה של התא - ובשלב זה מוכן התא להצגת האנטיגן ללימפוציטי T מסוג +CD8.
תאים בריאים, שאינם נדבקו בנגיף (או עברו התמרה סרטנית), מציגים בכל עת אנטיגנים עצמיים על גבי MHC I. כך נוצר באופן נורמלי מעין 'פסיפס אנטיגני' הנסרק כדרך קבע, וללא הרף, על ידי לימפוציטים בוגרים. במידה ותא נדבק על ידי וירוס, בנוסף לאנטיגנים העצמיים - יוצגו כעת גם אנטיגנים זרים. תאים אלו יזוהו ויושמדו על ידי תאי +CD8 אפקטוריים. הזיהוי של התאים הנגועים נשען על הצגת אנטיגנים זרים, אך נתמך גם על ידי מרכיבים נוספים.
תא מודבק בוירוס נוטה לסבול מהצטברות של חלבונים מקופלים-למחצה ב-ER. מצב זה מעורר תגובה קשה המכונה ER Stress. בשל כך כמות רבה יותר של חלבון תועבר לפירוק בפרוטאזום, ויותר שברי חלבונים יועברו להצגה על גבי מולקולות MHC. במקביל, חשיפה לציטוקינים מסוימים - ובראשם אינטרפרון גאמא - תוביל לשינוי הרכב הפרוטאזום ולהגברת פעילותו. הפרוטאזום המוגבר עקב חשיפה לאינטרפרון נקרא אימונו-פרוטאזום. מבחינה מבנית מתאפיין האימונו-פרוטאזום בתוספת של שלוש תת-יחידות הנקראות LMP-2, LMP-7 ו-MECL-7. כל אלו מגבירים את כושר הצגת האנטיגן של התא הנגוע.
MHC Class II[עריכת קוד מקור | עריכה]

כפי שצוין לעיל, כל תאי הגוף מסוגלים ליצור מולקולות מסוג MHC Class I. על מנת שתא יציג אנטיגן על גבי MHC I, יש צורך ביצירה של חלבונים בתוכו, לאחר מכן לפרק ולחתוך אותם בציטוזול באמצעות הפרוטאזום, ולבסוף להעבירם ל-ER דרך הקומפלקס TAP 1/2. להבדיל מכך, רק מקצת מתאי הגוף, ולמעשה רק חלק קטן מתאי מערכת החיסון, מסוגלים לבטא MHC Class II. תאים אלו נקראים pAPC's, והם כוללים מקרופג'ים, תאים דנדריטיים ותאי B.
מולקולת ה-MHC Class II מורכבת משתי שרשראות חלבוניות, אשר בראשן מופיע שקע שבתוכו ינוח האנטיגן העתידי. בדומה ל-MHC Class I, גם כאן לא מוצג אנטיגן בשלמותו, אלא רק לאחר עיבודו לכדי פפטידים קצרים יותר. למרות הדמיון הרב ל-MHC Class I, ישנם מספר הבדלים מהותיים בתצוגה בין שני סוגי ה-MHC. ראשית, MHC II מתמקד בהצגת אנטיגנים אשר לא נוצרו בתא, אלא חדרו לתוכו באמצעות אנדוציטוזה/פאגוציטוזה. אנטיגנים אלו נשמרים בתוך וסיקולות בתוך התא (אנדוזום/ליזוזום), ואינן נעות באופן חופשי בציטוזול. שנית, ביקוע החלבונים מתבצע בתנאים חומציים בתוך אותן וסיקולות, ולא בפרוטאזום תחת pH ניטרלי. שלישית, הצגת האנטיגן על גבי MHC Class II איננו תלוי ביצירה של מולקולות MHC חדשות בלבד, אלא קיים גם מִחְזוּר של מולקולות ישנות. לבסוף, למולקולות MHC Class I יש מגבלה חריפה על אורך האנטיגן, ואילו MHC Class II מאפשר הצגת אנטיגנים ארוכים יותר, לרוב למעלה מ-13 חומצות אמינות.
מולקולות ה-MHC II נוצרות, בדומה ל-MHC I, בתוך ה-ER. מכיוון שהקומפלקס איננו יציב בהיעדר אנטיגן, ישנו קישור לשרשרת פפטידית שנקראת Ii Chain. פפטיד זה מונע את הקישור לאנטיגן ב-ER, ומכוון את ה-MHC II אל עבר המערכת האנדוזומלית של התא - שם כאמור מתבצע עיבוד (חיתוך) האנטיגנים הזרים. על מנת ש-MHC II יקשור את האנטיגן באנדוזום, יש להשלים את עיבוד האנטיגן, וכן להפריד את שרשרת ה-Ii מן ה-MHC. חיתוך האנטיגן מתבצע על ידי מגוון פרוטאזות התלויות ב-pH. ישנן גם פרוטאזות נוספות אשר ניתנות לגיוס לאחר חשיפה לציטוקינים מסוימים - כמו אינטרפרון גאמא. שחרור ה-MHC מן הקישור ל-Ii מתבצע כדלהלן. ראשית, שרשרת ה-Ii עוברת ביקוע על ידי מספר פרוטאזות אנדוזומליות, וביניהן AEP, Cathepsin S ו-Cathepsin L. בשלב זה נותרת מאחור חתיכה קטנה משרשרת ה-Ii, הממוקמת בשקע האנטיגני בראש ה-MHC. תת-שרשרת זו נקראת כעת CLIP. שחרור ה-CLIP מתבצע באמצעות מולקולה דמוית MHC הנקראת DM. לצד שחרור מלא של ה-MHC מן ה-CLIP, מולקולת ה-DM גם מייצבת את ה-MHC עד אשר יושלם הקישור לאנטיגן. בדומה לנעשה ב-MHC I, גם כאן ישנה ברירה של אנטיגנים בהתאם למוטיף ייחודי, ובהיעדר אנטיגנים זרים מולקולות ה-MHC II מציגות אנטיגנים עצמיים.
הצגת אנטיגנים על גבי MHC Class II מהווה סוגיה מרכזית בתגובה חיסונית, שכן היא מתווכת את פעילותם של תאי +CD4. תאי +CD4 אמנם לא תוקפים באופן ישיר פתוגנים, אך הם משפיעים בצורה מרחיקת לכת על שאר תאי מערכת החיסון. בהיעדרם, מרבית תאי ה-B לא ישופעלו - ולכן לא ייווצרו נוגדנים; מרבית תאי ה-+CD8 לא ישופעלו, כך שתאים סרטניים או מודבקים בווירוס יוכלו להמשיך לשגשג ולהתרבות; גרנולוציטים של מערכת החיסון המולדת לא יפרישו את חומרי ההרג שלהם; ותאים בולעניים יוותרו בפעילות בינונית-נמוכה.
Cross Presentation[עריכת קוד מקור | עריכה]

תאים דנדריטיים, וגם מקרופאג'ים במידה פחותה יותר, לוקחים תפקיד משולש של (1) זיהוי פתוגן וקליטתו, (2) נשיאתו ל-SLO, וכן (3) תפקוד כ-APC. לפני קליטת פתוגן, תאים אלו מאופיינים בביטוי מופחת של MHC Class II ונחשבים לצעירים (Immature). התבגרות התאים הדנדריטיים, ואיתה התגברות יכולת הצגת האנטיגן, יכולה להתבצע באחד משלושה מנגנונים:
- פגיעה ישירה בתאים דנדריטיים (למשל על רקע של הדבקה ויראלית).
- קליטת אנטיגן מהסביבה באמצעות אנדוציטוזה/פאגוציטוזה.
- אקטיבציה באמצעות ציטוקינים מעודדי דלקת מסביבתם הקרובה.
הצגת אנטיגן על גבי MHC Class I עקב הדבקה ישירה של תא בווירוס נקראת "Direct Presentation" - הצגה ישירה [2]. וירוסים מצידם מאופיינים בטרופיזם מארח ספציפי, כלומר נטייה להדביק תאים ספציפיים ולא את כלל תאי הגוף. במידה ופאגוציט יבלע את הנגיף המדובר, האנטיגנים שלו יעוכלו באנדוזום ויוצגו על גבי MHC Class II. כיצד יכול תא דנדריטי, שאיננו חלק מטרופיזם צר של נגיף כזה או אחר, להציג אנטיגנים מנגיף זה על גבי מולקולות MHC Class I? כיצד יוכל תא APC לגייס תאי +CD8 במקרה שכזה? מתברר אפוא כי לתאי APC ישנה תכונה ייחודית לפיה לא רק שביכולתם לבטא MHC Class II, אלא גם להציג אנטיגנים שנקלטו באופן אנדוציטי/פאגוציטי על גבי MHC Class I. הצגה על גבי MHC במסלול שאיננו תואם את המנגנונים שתוארו לעיל נקראת Cross Presentation. כך תאי APC מסוגלים להאיץ את התגובה החיסונית על ידי שפעול במקביל של הן תאי +CD8 והן תאי +CD4.
גנטיקה של מולקולות MHC[עריכת קוד מקור | עריכה]
 ערך מורחב – MHC
ערך מורחב – MHC

מולקולות ה-MHC, אשר נקראות גם HLA, לוקחות תפקיד מרכזי בפעילות מערכת החיסון, הרי הן מהוות נקודת הממשק של תאי T עם העולם החיצון. דוגמה בולטת המרמזת על חשיבותן היא השפעתן המכרעת על התאמה חיסונית בהשתלת איברים. במידה ומולקולות ה-MHC של תורם האיבר ומקבל האיבר יהיו שונים, יתפס האיבר המושתל כ'זר' ויותקף על ידי מערכת החיסון. כפועל יוצא, הפכו מולקולות אלה לנושא מחקר מרכזי ועליהן נצבר מידע רב.
בגנום, הלוקוס האחראי ליצירת MHC ממוקם על כרומוזום 6 בבני אדם, וכרומוזום 17 בעכברים. מרבית האנשים מבטאים 12 גנים של MHC - חצי מן האב, וחצי מן האם. עבור כל כרומוזום (6 גנים), מבוטאים שלושה תת-סוגי MHC Class I, ושלושה תת-סוגים של MHC Class II. הגנים הללו, אשר מסומנים באותיות A, B, C עבור MHC Class I ובאותיות DP, DQ, DR עבור MHC Class II נקראים כמכלול "מולקולות MHC קלאסיות" (Classical MHC Molecules). בנוסף להן, אנשים שונים מבטאים מולקולות MHC נוספות, לא-קלאסיות (Nonclassical), אשר מציגות תכונות ביולוגיות שונות; מופיעות בחלק מן התאים בגוף, משפיעות על האופי הייחודי של התגובה החיסונית של כל אדם ואדם, ועוד.
אף על פי שמרבית בני האדם מבטאים את הגנים הקלאסיים של ה-MHC, לא מדובר באותם גנים בדיוק. הלוקוס ל-MHC הינו פולימורפי במיוחד, וידועים מאות אללים שונים של גנים אלו. ידוע כי לאללים שונים יכולת קישור מעט שונה לאנטיגנים, ועל כן ישנה שונות ביולוגית ניכרת בתפקוד אלמנטים אלו. הקומבינציה הייחודית של הגנים והאללים אותם אדם מבטא נקראת הפלוטיפ (Haplotype); המגוון ההפלוטיפי של לוקוס ה-MHC משפיע באופן ישיר על פעילותם של תאי T, וישנן עבודות רבות הקושרות בין הפלוטיפים ספציפיים, לבין הפרעות בריאותיות שונות. מסתמן גם שהמגוון המולקולרי בהפלוטיפ ה-MHC משחק תפקיד בתהליך בחירת בן או בת זוג. סוגיה זו נחקרה בהרחבה בהקשר לאבולוציה של רבייה זוויגית.
אקטיבציה של לימפוציטים[עריכת קוד מקור | עריכה]
שפעול תאי T ב-SLO[עריכת קוד מקור | עריכה]
המיקום המדויק של תאי T, תאי B ותאים דנדריטיים בתוך SLO נקבע בעיקר על ידי כימוקינים, אשר מופרשים בתורם על ידי התאים הסטרומליים של האיבר הלימפואידי השניוני. לימפוציטים נאיביים החודרים לקשרית לימפה ינועו בקרבה רבה לתאי APC הנושאים אנטיגנים. מרבית הלימפוציטים לא יזהו את האנטיגנים, ולכן יתעלמו מאותם תאי APC. כפועל יוצא ינדדו הלימפוציטים אל עבר ליבת ה-SLO, ומשם חזרה לזרם הלימפה והדם.
הלימפוציטים הנאיבים הנדירים, אשר כן מזהים אנטיגן מעובד על גבי פלטפורמת MHC, עושים זאת באמצעות קולטן ה-TCR שלהם. אינטראקציה פורייה בין TCR לבין אנטיגן מהווה תנאי מרכזי לשפעול תאי ה-T ולפרוץ תגובה חיסונית אדפטיבית. יחד עם זאת, שפעול של לימפוציטים הינו תהליך מסועף ורב שלבי, הן ברמה המולקולרית והן ברמה התאית. היה ואחד מן השלבים לא הושלם כהלכה, התא המעורב עלול לעבור אפופטוזיס (מוות תאי), או להיכנס לאָנֵרְגִּיָּה (מצב בלתי פעיל).
שפעול לימפוציטים נאיביים[עריכת קוד מקור | עריכה]

מהם השלבים, אם כן, הדרושים לשפעול תאי T נאיביים?
ראשית, נחוצה אינטראקציה בין האנטיגן המעובד על גבי ה-APC לבין קולטן ה-TCR. אינטראקציה זו צריכה להיות מלווה בקישור בין ה-MHC לבין ה-CD4 או ה-CD8 התואם, ועליה להיות בעוצמת קשר (Avidity) שאיננה חזקה או חלשה מדי. לשפעול מלא של הלימפוציט יש צורך באיתות נוסף אשר מכונה כיום 'קו-סטימולציה' (Co-Stimulation). ישנן מולקולות קו-סטימולנטיות רבות, אך המוכרות שבהן כוללות את הקולטן CD28 על גבי תאי ה-T הנאיביים, לבין המולקולות CD80/86 על גבי תא ה-APC. תאים דנדריטיים מאוקטבים מבטאים כמויות גדולות של CD80/86, ובכך ערוכים לביצוע קו-סטימולציה אפקטיבית. הממשק העדין שבין קומפלקס ה-TCR/קו-רצפטור, ומיד לאחר מכן קו-סטימולציה התלויה ב-CD28, הם שני שלבים קריטיים בשפעול תאי T נאיביים. הקישור הראשוני לאנטיגן מכונה 'סיגנל 1' בלקסיקון של אקטיבציית לימפוציטים, ואילו הקו-סטימולציה דרך CD28 נקראת 'סיגנל 2'. כתוצאה משני שלבים אלה נעצרת תנועת תאי ה-T, והם מתחייבים - לפחות לזמן מוגבל - לשהות באיבר הלימפואידי הנוכחי. עצירה זו מתווכת על ידי שינוי בביטוי קולטנים לכימוקינים, וביתר פירוט, ירידה בביטוי הקולטן S1P1R1 על גבי הלימפוציטים.
השלמת סיגנל 1 ו-2 היא הכרחית, אך לא מספיקה על מנת להבטיח את השפעול המלא של תא ה-T. יש צורך גם בסיגנל 3, אשר מתבצע על ידי חשיפת הלימפוציט לציטוקינים וכימוקינים המיוצרים בעיקר על ידי תאי מערכת החיסון המולדת. תאים אלו, הכוללים בין היתר תאים דנדריטיים, תאי NK ותאי NKT, חודרים ל-SLO בעקבות הצבת האנטיגן הזר בו. IL-2 ו-IL-12 הינם דוגמאות בולטות של ציטוקינים חיוניים לסיגנל 3, כאשר IL-2 מעודד את התרבות הלימפוציטים, ו-IL-12 מאיץ את התמיינותם לתאים אפקטוריים. הציטוקינים המופרשים בשלב 3 נחשבים לכאלה המעצבים את התגובה החיסונית ומתאימים אותה לסוג הפתוגן הפולש (הרי מאבק בנגיף תוך-תאי איננו זהה למאבק בפטרייה חוץ-תאית). דוגמאות לציטוקינים נוספים המעורבים בסיגנל 3 כזה או אחר הינם אינטרפרון אלפא, אינטרפרון ביטא, אינטרפרון גאמא, IL-1, IL-4, IL-6, IL-10, ועוד.

בדומה למגוון הקיים בקרב ציטוקינים בסיגנל 3, כך ישנה גם וריאציה בקרב השחקנים המעורבים בסיגנל 2. בעוד ש-CD28 מהווה קולטן הדגל של לימפוציטים בשלב זה, כיום ידועות מולקולות נוספות השייכות לאותה משפחה של 'קולטנים דמויי נוגדן' (Ig Receptor Gene Family). ניתן למשל למנות את המולקולות CTLA-4, ICOS, CD27, OX40, PD-1, 4-1BB, CD40L, ועוד. בעוד שחלקן אחראיות לאיתות חיובי, כלומר מעודדות את השלמת שפעול התאים (CD28, CD27, ICOS) - אחרות מובילות דווקא לאיתות שלילי, כזה המדכא ומונע את אקטיבציית הלימפוציטים (PD-1, CTLA-4). תרופות המווסתות את סיגנל 2 הולכות ותופסות תאוצה בקרב טיפולים למחלות הסרטן. כך למשל ניתן למנות את התרופה מבוססת הנוגדנים קיטרודה - תכשיר המונע קישור של הקולטן PD-1 על תאי T, לבין הליגנד שלו PD-1L אשר מבוטא ביתר על גבי תאי סרטן. תרופות אלה מציגות פרופיל יעילות מצוין, והשימוש בהן הופך לתדיר יותר מדי יום.
השפעול של תאי +CD4 דומה באופן עקרוני לזה של +CD8, למעט הדרישה לקישור ראשוני לאנטיגן על גבי MHC Class II. תוצאה מוקדמת וחשובה אחת של שפעול תאי +CD4 היא הגברת הביטוי של המולקולה CD154, או בשמה המוכר יותר CD40L. כפי ששמה מרמז, מולקולה זו היא הליגנד לקולטן CD40. הרצפטור הנ"ל מתבטא על פני השטח של תאים דנדריטיים בוגרים וכן על הממברנה של תאי B שעברו שפעול לאחר חשיפה לאנטיגן. אינטראקציה בין הקולטן CD40 של תאים דנדריטיים עם הליגנד CD40L של תאי +CD4 מוביל להפרשה מאסיבית של IL-12, ציטוקין הלוקח חלק מרכזי בסיגנל 3 של כלל תאי ה-T. עבור תאי B, אינטראקציה בין הקולטן CD40 לבין הליגנד CD40L של תאי +CD4 משופעלים מהווה שלב קריטי בהתמיינותם לתאים אפקטוריים מפרישי-נוגדנים (תאי פלזמה).
תוצאת השפעול - תאים אפקטוריים ותאי זיכרון[עריכת קוד מקור | עריכה]
לאחר השלמת שפעול תא T נאיבי, הוא יחל בהתרבות מהירה. למעשה, בנוף של תאים אנושיים, קצב ההתרבות של לימפוציטים משופעלים הוא גבוה באופן חריג. מחזור תא של לימפוציט משופעל תואר בספרות כקצר מ-6 שעות (ואף יש תיעוד לְפָּחוֹת משעתיים)[2]. להשוואה, מחזור תא של אנטרוציט במערכת העיכול עומד על כ-17 שעות במכרסמים, ומחזור תא של קרטינוציט ברקמת עור של בני אדם עומד על מספר ימים. חלק גדול מתאי הבת יתמיינו לתאים אפקטוריים אשר ישתתפו במאבק החיסוני כנגד הפתוגן, או הגידול הסרטני. משך החיים של התאים האפקטוריים הוא לרוב קצר, ימים-שבועות. חלק מתאי הבת יתמיינו לתאי זיכרון. תאי זיכרון לא משתתפים באופן ישיר במאבק החיסוני, אך משך החיים שלהם ארוך (לעיתים למשל כל חייו של הפרט), ושפעול חוזר שלהם הוא קל ומהיר יותר בהשוואה לתאים נאיביים.
תאים אפקטוריים מסוג +CD8, המסוגלים לקשור אנטיגן בכל תאי הגוף (בזכות התצוגה על MHC Class I), יבצעו פעולה "ציטוטוקסית" - כזו המובילה להרג התאים. זו גם הסיבה שתאים אפקטוריים אלו נקראים גם לימפוציטים הורגים או לימפוציטים ציטוטוקסיים (בלועזית Cyotoxic T Lymphocytes - CTL), והם לרוב יפעלו לסילוק תאים אשר נדבקו בווירוס או עברו התמרה סרטנית.
תאים אפקטוריים מסוג +CD4 מסוגלים לקשור אנטיגן המוצג על גבי תאי APC בלבד. תאים אלו מאופיינים ביכולת הפרשה משמעותית של ציטוקינים, ועל כן יסייעו בשפעול של תאי +CD8 בסיגנל 3. תאי +CD4 אחראיים גם לשפעול של לימפוציטים מסוג B, כפי שיתואר בהמשך. כמו כן, הפרשת אינטרפרונים על ידי תאי +CD4 אפקטוריים מגבירה את הפעילות הפאגוציטית של מקרופאג'ים, ובכך תאי +CD4 מנצחים על התזמורת החיסונית כולה. בשל הממשק הייחודי של תאי +CD4 עם שאר מרכיבי מערכת החיסון, תאים אלו קיבלו את השם תאי T מסייעים (Helper T cells).
כפי שצוין לפני, כל תא T נאיבי מסוגל לקשור אנטיגן בודד - ולכן הקישור של לימפוציט לאנטיגן הינו מאורע נדיר. השכיחות של מציאת לימפוציט נאיבי מתאים לאנטיגן מסוים מוערכת בכאחד למיליון (1/106). תאי זיכרון, מלבד שפעולם המהיר, גם שכיחים יותר מאשר תאים נאיביים. העלאת השכיחות משפרת את הסבירות למצוא לימפוציט מתאים בחשיפה הבאה לאנטיגן, ולכן מאיצה באופן משמעותי את התפתחות התגובה החיסונית. נושא זה יתואר בהמשך בהרחבה.
שפעול תאי B ב-SLO[עריכת קוד מקור | עריכה]
תהליך האקטיבציה של תאי B נאיביים ב-SLO מכיל קווי דמיון רבים לתהליך השפעול של תאי T. ראשית, לימפוציטים אלה נעים בין SLO אחד למישנהו בדומה לתאי T, אך תנועתם מווסתת בעיקר על ידי הכימוקין CXCL13 ולא CCR7. ציטוקין זה מופרש על ידי תאים ייחודיים הנקראים תאים דנדריטיים פוליקולריים (follicular DC); שמם ניתן להם עקב הדמיון המורפולוגי לתאים דנדריטיים, אם כי מקורם התפתחותי שונה (אינם תאים ממקור המטופואטי). ה-CXCL13 נקלט על ידי הרצפטור CXCR5 על גבי תאי ה-B, והממשק בין הלינגד לרצפטור מוביל להתמקמות תאי B ב-B Cell Zone של איבר לימפואידי שניוני (בקורטקס). בהיעדר אינטראקציה עם אנטיגן, ינוע הלימפוציט אל עבר המדולה של ה-SLO, ולאחר מכן חזרה לסירוקלציה הסיסטמית במערכות הלימפה והדם. שנית, אקטיבציה של תאי B היא תהליך רב-שלבי, הכולל מספר סיגנלים שונים. העברת הסיגנלים באופן חלקי או פגום עלולה להוביל להרג הלימפוציט, או לכניסה לאָנֵרְגִּיָּה. עם זאת, שאר הסיגנלים הדרושים לשפעול תאי B מגוונים יותר מאשר אלו התוארו בתאי T; לימפוציטים מסוג B יכולים לעבור אקטיבציה באחת משתי קטגוריות - שפעול התלוי בתאי T, ושפעול שאיננו תלוי בתאי T. מרבית תאי ה-B עוברים שפעול התלוי בתאי T, אך שתי הקטגוריות יתוארו כעת.
הצגת אנטיגן לתאי B[עריכת קוד מקור | עריכה]

בניגוד לתאי T, לימפוציטים מסוג B אינם זקוקים לעיבוד אנטיגנים, פירוקם, והצגתם על גבי מולקולות MHC. קולטני ה-BCR, וכן נוגדנים, קושרים אנטיגנים במצבם הנאטיבי. אנטיגנים אלו יכולים למשל להיות קשורים ישירות לממברנה של תאים, או מסיסים בזרם הדם.
איך אם כן תא APC, אשר נושא אנטיגן מהפריפריה אל עבר SLO, מציג אנטיגן עבור תאי B מבלי להציגו על גבי MHC?
התשובה לכך מכילה שלושה אלמנטים נפרדים. איברי ה-SLO, ובייחוד קשריות לימפה, מכילים תעלות אנטומיות ייחודיות הנקראות קונדואיטים (conduits). קונדואיטים אלו מורכבים מתאים מבניים וכן מתאי B המתמקמים בדפנותיהם. במידה ואנטיגן מסיס ימצא מתאים על ידי תאי ה-B, הוא יקלט מיד מזרם הלימפה באמצעות שלוחות הלימפוציט - ללא צורך בתא APC. אנטיגנים מסיסים אחרים, אשר יזרמו עם הנוזל הלימפתי לתוך ה-SLO, עלולים לפגוש תאי APC ייחודיים המתגוררים כדרך קבע בבלוטות אלו. דוגמה אחת לתאים כאלו הינם תאי SSM, תת-סוג של מקרופאג'ים אשר הינם בעלי יכולת פאגוציטוזה נמוכה. במידה ותאים אלו יזהו אנטיגן זר בנוזל הלימפתי, ביכולתם לקשור אותו בשלמותו לממברנה שלהם - ללא אינטרנליזציה והצגה על מולקולות MHC. ישנן עדויות כי תאי ה-SSM אמנם כולאים אנטיגנים, אך אינם מציגים אותם באופן ישיר לתאי ה-B. במקום זאת, תאים אלו מעבירים את האנטיגנים לתאים אחרים ב-SLO, כגון תאים דנדריטיים פוליקולריים. לבסוף, יכולת העברת האנטיגן הזו ככל הנראה משחקת תפקיד גם בקרב תאי APC אשר מגיעים מהפריפריה. התאים אשר נושאים את האנטיגן ממקום חדירתו לגוף ועד לבלוטת הלימפה הקרובה חולקים אותו עם תאי ה-APC השייכים לאיבר ה-SLO. כך מוצגים אנטיגנים במקביל הן לתאי B והן לתאי T, למרות דרישות שונות בכדי הצגת אנטיגן של כל לימפוציט.
שפעול לימפוציטים נאיביים[עריכת קוד מקור | עריכה]
במידה וימצא לימפוציט B נאיבי נדיר אשר כן מסוגל לקשור את אנטיגן, אינטראקציה בין האנטיגן לבין קולטן ה-BCR תהווה סיגנל 1. סיגנל 1 יכול להתחזק משמעותית במידה ומספר רב של קולטני BCR על גבי הלימפוציט יקשרו בבת אחת את האנטיגן, או לחלופין, במידה והאנטיגן יהיה מצופה מבעוד מועד על ידי נוגדנים או חלבוני מערכת המשלים. ההשפעות המולקולריות והתאיות של סיגנל 1 על תאי ה-B הן מרחיקות לכת, וכוללות בין היתר את הפסקת הנדידה בין איברים לימפואידים שניוניים, תנועה קלה בתוך ה-SLO מהקורטקס (B Cell Zone) אל עבר הפראקורטקס (T Cell Zone), ואינטרנליזציה של האנטיגן. תאי B, בדומה לתאים דנדריטיים ומקרופאג'ים, הינם תאי APC, כך שביכולתם לעבד ולהציג אנטיגנים על גבי MHC Class II. השפעות נוספות של סיגנל 1 על תאי B כוללות עלייה בביטוי CD40, קולטן חיוני להמשך התמיינותם של תאי ה-B הנאיביים.
T Dependent Activation - שפעול התלוי בתאי T[עריכת קוד מקור | עריכה]

תאי ה-B אשר קיבלו סיגנל 1 באמצעות קולטן ה-BCR נעים מהקורטקס של ה-SLO אל עבר ה-T Cell Zone. שם תאי TH (CD4+) ייחודיים, הנקראים תאי T פוליקולריים (TFH) יספקו את סיגנל 2 ו-3 לתאי ה-B.
סיגנל 2 מתקבל באמצעות הקישור של תאי B לתאי TFH בשני אתרים נפרדים במקביל:
- דרך האנטיגן המוצג על MHC Class II של תא B, עם קולטן ה-TCR והקו-רצפטור CD4 של תאי ה-T.
- דרך הקולטן CD40 הממוקם על פני תאי ה-B, והליגנד שלו CD40L אשר מבוטא על פני השטח של תאי ה-TFH.
לאחר מכן תאי ה-T יפרישו מגוון רחב של ציטוקינים אשר יהוו סיגנל 3, ויעודדו את תאי ה-B להתרבות ולהתחיל בשינוי לקראת היותם תאים-מפרישי-נוגדנים. ציטוקינים נפוצים הלוקחים חלק בסיגנל 3 של תאי B כוללים IL-2, IL-4, IL-5, IL-21 ואינטרפרון גאמא.
תוצאת שפעול תלוי תאי T[עריכת קוד מקור | עריכה]
בתחילה נוצרים מבנים פשוטים הנקראים Primary Foci. בתוך מבנים אלו תאי ה-B יתמיינו לתצורתם הסופית כתאי פלזמה אשר מפרישים כמויות אדירות של נוגדנים. תהליך התמיינות זה נמשך לרוב כ-4 ימים. מרבית תאי הפלזמה הללו מתים זמן קצר לאחר היווצרותם (סדר גודל שכ-10 ימים), ולכן מכונים גם Short-Lived-Plasma Cells. מנגד, חלק מתאי הפלזמה נודדים בחזרה למח העצם, ושם נותרים פעילים לפרקי זמן ארוכים - לעיתים למשך כל חייו של האדם. תאים אלו נקראים באופן בלתי מפתיע Long-Lived Plasma Cells, והם נושא מחקר פופולרי בשנים האחרונות. עוד לא ברורים לחלוטין הגורמים אשר מווסתים את התחייבות הלימפוציטים למסלול אחד על פני האחר.
לא כל תאי ה-B יכנסו ל-Primary Foci. אחרים יצרו מקבצים מיוחדים הנקראים Germinal Center בפוליקולות של איברי ה-SLO. בדומה ל-Primary Foci, כאן יתרבו הלימפוציטים וכן ישתנו מתאי B לכדי תאי פלזמה. מנגד, Germinal Centers מחזיקים מעמד לפרק זמן ארוך (כ-30 ימים), וכן הם מעמידים את התנאים הנחוצים עבור ההשבחה ושיפור ההתאמה של קולטני ה-BCR לאנטיגנים שלהם. כעת ישתנו בתהליך אבולוציוני מזורז האתרים הוריאביליים בתוך קולטני ה-BCR והנוגדנים. באמצעות סדרה של מוטציות נקודתיות באזור הוריאבילי, ייווצרו נוגדנים בעלי אפיניות (זיקה) משתנה לאנטיגן; חלקם יקשרו חזק יותר את האנטיגן, וחלקם חלש יותר. תהליך זה נקרא גם "היפרמוטציה סומטית" (Somatic Hypermutation, SHM). תהליך זה הינו מאפיין ייחודי של תאי B בלבד, ואיננו מתרחש כלל בתאי T.
הלימפוציטים המוטנטיים מועמדים לתהליך של סלקציה חיובית התלויה באנטיגן; רק אלו אשר הקושרים באפיניות גבוהה את האנטיגן שורדים. אחרים המכילים קולטנים באפיניות נמוכה, או אוטו-ריאקטיביים, מושמדים. בכל חשיפה חוזרת לאנטיגן, נשמרים הלימפוציטים בעלי הקולטנים המותאמים ביותר לאנטיגן, ואלו בתורם חווים תהליך נוסף של Somatic Hypermutation. כפועל יוצא בכל אינטראקציה נוספת עם אותו האנטיגן מתחזקים תאי ה-B, ומגמת שיפור זו מכונה Affinity Maturation. לצד ה-SHM מתרחשת גם רקומבינציה בשרשראות הכבדות של הנוגדנים. כעת חלק מתאי הבת יחליפו את האיזור הקבוע משרשרת מיו לשרשרת מסוג אחר: אלפא, גאמא או אפסילון. במילים אחרות, בעוד שהנוגדנים הראשונים אותם תאי B מפרישים הינם מסוג IgM, לאחר הכניסה ל-Germinal Center יווצרו תאי פלזמה בעלי נוגדנים ממשפחה אחרת: IgG, IgA או IgE בהתאמה. תופעה זו נקראת Class Switch Recombination, או בקיצור CSR. ברמה המולקולרית, גם SHM וגם CSR מתווכות על ידי אותו חלבון - AID.
מכיוון שכל התהליך כולו התחיל מההתרבות של לימפוציט מסוג B בודד - בהיעדר SHM כל תאי הבת יבטאו את אותו קולטן ה-BCR ואת אותם הנוגדנים. התרבות זו יוצרת שבט (clone) של תאים זהים הקושרים באפיניות זהה את אותו האנטיגן, ולכן נקראת גם Clonal Expansion. מבין השבט, תאים אוטו-ריאקטיביים שנוצרים באופן מקרי מושמדים, ותהליך זה נקרא Clonal Deletion. לבסוף, הבחירה או הברירה בשבט מסוים של לימפוציטים מבין כל שאר הלימפוציטים והשבטים האחרים בגוף מכונית Clonal Selection. את היסודות לתורה זו ניתן למצוא במאמר שפורסם בשנת 1957 בכתב העת Australian Journal of Science על ידי פרנק מקפרלן בורנט [26][27]. בורנט תיאר נכונה את התפתחותם של תאי B בתקופה שעוד קשה היה להבדיל בין תאי B לבין תאי T, ועוד לפני הניסוח הראשון של הַדּוֹגְמָה הַמֶּרְכָּזִית של הביולוגיה המולקולרית (The central Dogma)[28]. על עבודתו זו ואחרות הוענק לבורנט פרס נובל בפיזיולוגיה (1960). כיום נהוג להתייחס לתורת הסלקציה הקלונלית בתור המאפיין הבודד החשוב ביותר בהקשר של חיסוניות נרכשת [29].
בהיעדר סיוע של תאי T, כלומר בהינתן תאי B אשר עברו אקטיבציה עם סיגנל 1 אך ללא סיגנלים 2 ו-3 מתאי T, לא ייווצר Germinal Center. במקרה כזה, במידה והלימפוציט לא ימות/יושתק, הנוגדנים שייווצרו יהיו באפיניות נמוכה ומסוג IgM בלבד.
T Independent Activation - שפעול שאיננו תלוי בתאי T[עריכת קוד מקור | עריכה]
השפעול של תאי B נאיביים דורש את סיגנל 1 המגיע דרך קולטן ה-BCR, ולאחר מכן סיגנלים נוספים. סיגנלים אלו עשויים להגיע מלימפוציטי T כפי שתואר לעיל, או מהאנטיגן עצמו כפי שיותאר מיד. האנטיגנים הללו, אשר משפעלים תאי B ומאפשרים יצירת נוגדנים ללא סיועם של תאי T, נקראים Thymus Independent (מסומנים בקיצור TI). בעוד שמרבית האנטיגנים החלבוניים מחייבים סיוע של תאי T ליצירת נוגדנים, אנטיגני TI הם לרוב אינם חלבוניים, אלא סוכריים או שומניים. מאפיין בולט של אנטיגנים כאלו הינו חוזרניות גבוהה, ולא בכדי מדובר בפולימרים. ישנן שתי משפחות ראשיות של אנטיגנים מסוג זה: TI-1 ו-TI-2.
על פי רוב, שפעול תאי B ללא סיוע של תאי T מוביל להפרשת נוגדנים מסוג IgM בלבד, ובאפיניות נמוכה. זאת מכיוון שללא סיוע תאי T לא נוצר Germinal Center, ולכן גם לא מתרחשים תהליכי ה-Somatic Hypermutation ו-Class Switch Recombination.
אנטיגן TI[עריכת קוד מקור | עריכה]

משפחת ה-TI-1 כוללת אנטיגנים אשר נקשרים לתאי ה-B במקביל בשני סוגי קולטנים: גם קולטני BCR וגם קולטני PRR. אף על פי שקולטני PRR ידועים כקולטנים השייכים למע' החיסון המולדת - כל תאי מע' החיסון מבטאים קולטני PRR מסוימים. לא ידועים תאים אשר מבטאים את כל סוגי ה-PRR במקביל, אך מאפיין בולט של תאי מע' החיסון המולדת הינו ביטוי רחב היקף ומגוון של קולטני PRR, יותר מאשר תאים שאינם שייכים למע' זו. קישור משולב זה, המערב גם קולטן לימפוציטי ספציפי וגם קולטני PRR בלתי ספציפיים מוביל להתרבותם של תאי B, וכן להתמיינותם לתאי פלזמה המפרישים נוגדנים. לכן נאמר על אנטיגני TI-1 כי הם מיטוגניים, קרי משרים על התאים פקודת התרבות. לחיידקים גראם-שליליים ישנה מעטפת הכוללת את השומן-המסוכרר LPS; זהו מרכיב אימונוגני במיוחד אשר ביכולתו לעורר גם תגובת TI-1.
מנגד משפחת ה-TI-2 איננה מיטוגנית, וכוללת אנטיגנים חוזרניים במיוחד. דוגמה בולטת לאנטיגן TI-2 היא המעטפת הסוכרית שקיימת על גבי חיידקים מסוימים. אנטיגנים אלו מאפשרים קישור במקביל של מספר רב של קולטני BCR, תהליך שנקרא Cross-Linking. לעיתים קרובות הקישור לקולטני ה-BCR מוגבר בקרב אנטיגני TI-2 באמצעות קומפלקס הקו-רצפטור של תאי B. קו-רצפטור זה מורכב משלושת החלבונים CD19, CD21 ו-CD81. הקולטן CD21 (נקרא גם CR2) הינו קולטן של מרכיב מערכת המשלים C3dg, תוצר פירוק של C3. כתוצאה מכך משופעל CD19 ומספר מסלולי אותות תוך-תאיים מגויסים. השימוש בקפסולה סוכרית כמעטפת לאנטיגנים חלבוניים היא טקטיקת בריחה חיסונית ידועה של חיידקים רבים - כך מונעים החיידקים היווצרות נוגדני IgG בעלי אפיניות גבוהה, ועליהם להתמודד עם נוגדני IgM באפיניות נמוכה בלבד.
תגובות אפקטוריות של לימפוציטים[עריכת קוד מקור | עריכה]
לאחר השלמת שפעול הלימפוציטים הנאיביים, מתרבים התאים באופן מאסיבי. עקב כך נוצרים שבטים (clones) של לימפוציטים בעלי קולטן זהה. במקרה של תאי B, בכל שפעול חוזר נוטה הקולטן לשפר את ההתאמתו לאנטיגן באמצעות Affinity Maturation. גם בתאי T וגם בתאי B, חלק מתאי הבת יתמיינו לתאים אפקטוריים אשר ישתתפו במאבק החיסוני, וחלק יתמיינו לכדי תאי זיכרון שאמנם לא משמידים את הפתוגן, אך ניתנים לעירור מהיר במידה ויחשף המארח לפתוגן זה בשנית.
פעילויות אפקטוריות של תאי B[עריכת קוד מקור | עריכה]

מנגנוני השמדת הפתוגנים של תאי B מתווכים ברובם על ידי נוגדנים. נוגדנים נבדלים מן הפעילויות האנטי-מיקרוביאליות של תאי T בכך שביכולתם לקשור פתוגנים גם תוך-תאיים (ללא קישור ל-MHC), וגם חוץ-תאיים. במידה וישנם נוגדנים בטרם חדירת הפתוגן לגוף, לא פעם נוגדנים אלו מהווים קו ההגנה הראשון, על אף היותם חלק ממערכת החיסון הנרכשת. תאי ה-B אשר מפרישים נוגדנים מכונים תאי פלזמה, ומרבית תאי הפלזמה הינם בעלי אורך חיים קצר. קישור נוגדנים לפתוגן תוך-תאי עשוי למנוע כליל את חדירתו לתא. תכונה זו מכונה נטרול (Neutralization), ויעילותה גבוהה במיוחד כאשר הנוגדן תוקף את אתרי הממשק של הפתוגן עם התא. לעיתים נוגדנים לא מונעים כליל את חדירת הפתוגן לתוך התא, אך מעוררים מנגנוני השמדה תוך-תאיים. לדוגמה, בווירוסים רבים, אתר ה-Fc של נוגדני IgG נקשר לחלבון ציטוזולי בשם TRIM21. חלבון זה מתווך את סימון הקומפלקס פתוגן/נוגדן, ומוביל להשמדת הנגיף על ידי הפרוטאזום. ישנים מנגנוני הגנה נוספים אשר תלויים באתר ה-Fc. ראשית, נוגדני IgG, ובמידה פחותה גם IgM, מגייסים את חלבוני מערכת המשלים במסלול הקלאסי. ישנן עדויות כי האינטראקציה המשותפת של נוגדנים וחלבוני מערכת המשלים עשויה להגביר את יכולת הנטרול של הנוגדנים. נוסף על כך, חלבוני מערכת המשלים מרכיבים תעלות ממברנליות הנקראות MAC. תעלות אלה נטמעות בדפנותיהם של הפתוגנים ומובילות לפיצוצם. שנית, נוגדנים מגרים את התאים הבולעניים לעכל ולהשמיד פתוגנים. מנגנון זה מכונה אופסוניזציה (Opsonization). יש לציין כי גם חלק מחלבוני מערכת המשלים פועלים באמצעות אופסוניזציה. מנגנון זה מתווך על ידי קולטני-אופסונונים המצויים על גבי תאים פאגוציטים (קולטני Fc וקולטני מערכת המשלים). נוגדנים מסוגלים לקשור אנטיגנים חופשיים, אך גם כאלה המבוטאים על פני השטח של תאים נגועים. ישנם מנגנוני Fc אשר ביכולתם להוביל להשמדת תאים פגומים אלו. מנגנון אחד תואר, והוא באמצעות גיוס מערכת המשלים ויצירת תעלות MAC. תופעה זו מכונה CDC, ראשי תיבות עבור 'ציטוטוקסיות-מתווכת-משלים' (Complement Dependent Cytotoxicity). מנגנון נוסף הינו באמצעות גיוס תאי NK (אך גם תאים נוספים) אשר יפרישו רעלנים הקטלניים לתא המודבק. תופעה זו מוכרת בשם Antibody-Dependent-Cell-Cytotoxicity, או בקיצור ADCC.
פעילויות אפקטוריות של תאי T[עריכת קוד מקור | עריכה]
השיוך של תאי T לקטגוריות נפרדות בהתאם לקו-רצפטור +CD8 ו-+CD4 לא רק מציין את הממשק עם מולקולות MHC, אלא חלוקה זו הינה גם בעלת משמעות פונקציונלית. תאי +CD8 אפקטוריים משמידים תאים המציגים אנטיגן זר על גבי MHC Class I, והרג זה מתבצע באמצעות ממשק ישיר איתם (cell-to-cell contact). האנטיגן הזר שמוצג על גבי תאים אלו יכול להגיע ממקור נגיפי (תא מודבק בוירוס), או מהתמרה סרטנית. נוסף על כך, תאי +CD8 גם מפרישים מספר ציטוקינים בעלי פעילות אנטי-ויראלית לאחר הקישור של קולטן ה-TCR לאנטיגן (לדוגמה, אינטרפרון גאמא, ו-TNF-α).
מנגד, פעילותם המרכזית של תאי +CD4 אפקטוריים הינה באמצעות הפרשה מאסיבית של ציטוקינים שונים לאחר שפעולם, בייחוד אינטרפרון גאמא, IL-4 ו-IL-5. תאי +CD4 עוברים תהליך התמיינות נוסף במהלך שפעולם, כזה המוביל להתמחותם בהפרשת מקבצים של ציטוקינים ספציפיים. בין היתר ניתן למנות תאי TH1 אשר מתמקדים בהפרשת ציטוקינים אנטי-ויראליים (אינטרפרון גאמא, ו-TNF-α), תאי TH2 המתמחים בשפעול תאי B, ותאי TH17 המפרישים את הציטוקין מעודד-הדלקת IL-17. התמיינות תאי ה-TH תלויה במגוון גורמים אשר יפורטו בהמשך.
תאי +CD8[עריכת קוד מקור | עריכה]
תאי ה-+CD8 האפקטוריים (נקראים גם CTL - Cytotoxic T Cells) משמידים תאי מטרה כגון אלו המודבקים בווירוס, באמצעות אינטראקציה ישירה עם תאים אלו. ישנם שני מנגנוני הרג בהם תאי CTL משתמשים: המסלול האינטרינזי והמסלול האקסטרינזי. למען האמת, תאי T אינם הורגים תאי מטרה פר סה, אלא מעודדים אותם להתאבדות מבוקרת כפי שנראה מיד. לאחר מכן, יסולקו התאים המתים על ידי פאגוציטים.
המסלול האינטרינזי[עריכת קוד מקור | עריכה]

לימפוציטי +CD8 מאוקטבים מכילים גרנולות (שקיקי הפרשה) עשירות ברעלנים - מעין ליזוזומים הניתנים להפרשה. לאחר קישור אנטיגן-TCR, נצמד תא ה-T בחוזקה לתא המטרה בעזרת אינטגרינים רבים, ונקודת המגע הזו נקראת סינפסה אימונית. לתוך הסינפסה האימונית, מפריש הלימפוציט את גרנולות ההרג אשר מכילות לפחות שלושה מרכיבים שונים: פרפורין, גרנזימים וגרנוליזין. חלבון הפרפורין הינו בעל הומולוגיה לחלבון מערכת המשלים C9 אשר יוצר את טבעות ה-MAC, ולפיכך חלבון זה מרכיב תעלות המנקבות את דפנות תא המטרה. באמצעות תעלות אלה חודרים הגרנזימים והגרנוליזין לציטוזול, שם הם משרים פקודת התאבדות אפופטוטית על התא. ישנן עדויות כי הפרפורין איננו מנקב את הממברנה של תא המטרה באופן ישיר. במקום זאת, תכולת הגרנולות ראשית נקלטת על ידי תא המטרה באנדוציטוזה, ולאחר מכן משופעל הפרפורין בתוך אנדוזומים - כך משוחררים הגרנזימים והגרנוליזין לתוך הציטופלזמה.
כיצד משרים הגרנזימים פקודת התאבדות אפופטוטית לתא המטרה? ובכן, ישנם מספר גרנזימים בבני אדם, המחולקים ל-5 משפחות, מהם גרנזים A ו-גרנזים B הם הנפוצים ביותר. מולקולות אלה מובילות להרג התא הן באמצעות שפעול ישיר של קספאזות, והן באמצעות פגיעה במיטוכונדריה. פגיעה מיטוכונדריאלית זו מתווכת על חלבונים פרו-אפופטוטיים ממשפחת ה-Bcl-2 כגון BID ו-BAX. קספאזות מצידן הן פרוטאזות אשר מבקעות חלבונים רבים, ופעילותן מובילה להתאבדות התא.
נהוג לחלק קספאזות לראשוניות (Initiator Caspases) ואפקטוריות (Executioner Caspases). לרוב קספאזות ראשוניות קולטות את סיגנל הנזק לתא, ותפקידן הוא לעורר את הקספאזות האפקטוריות; ואילו הקספאזות האפקטוריות בתורן מעוררות מספר רב של חלבוני מוות שונים. תוצאת פעולתן היא חיתוך ה-DNA, פגיעה ביציבות הממברנה של התא, ביקוע בשלד התא, חלוקת התא לבועיות נפרדות, ועוד.
דוגמאות לקספאזות ראשוניות כוללות את 2, 8, 9 ו-10, ודוגמאות לקספאזות אפקטוריות הן 3, 6 ו-7. גרנזים B משפעל את קספאז 9, ולעיתים גם את קספאז 3 באופן ישיר. אחת ההשפעות הבולטות של שפעול זה היא האקטיבציה של האנדונוקלאז CAD - Caspase Activated DNase. חלבון ה-CAD מבקע את ה-DNA למקטעים בני 200 בסיסים, סימן היכר של אפופטוזיס.

המסלול האקסטרינזי[עריכת קוד מקור | עריכה]
תאי המטרה המועמדים להרג מבטאים קולטן בשם CD95, או בשמו הנפוץ יותר Fas. קשירת הקולטן Fas מובילה לשפעול קספאזות תוך-תאיות ולהרג התא. תאי CTL מבטאים את הליגנד לקולטן זה, חלבון בשם FasL. בדומה להרג האינטרינזי, גם Fas/FasL מוביל לשפעול קספאזות. בעוד שגרנזים B משפעל את קספאז 9, הקולטן Fas משפעל את קספאזות הראשוניות 8 ו-10. כמו כן, ניתן לעורר את המסלול האקסטרינזי בעזרת קולטנים נוספים מלבד Fas, למשל באמצעות קולטנים ל-TNF-α ו-TNF-β (TNF-β ידוע גם בשם LT-α) [2].
גיוס פאגוציטים לסילוק התאים האפופטוטיים[עריכת קוד מקור | עריכה]
הממברנות של תאי הגוף מורכבות משתי שכבות של פוספוליפידים, מולקולות המורכבות ביסודן ממקבצים של חומצות שומן. ישנם בגופינו מאות סוגים של חומצות שומן, ופיזורן בתא איננו שווה; חלקן מתרכזות בממברנות של אברונים ספציפיים, אחרות מתרכזות בממברנה של התא, וכו'. יתרה מכך, ישנו פיזור לא סימטרי של חומצות שומן בתוך הממברנה של התא עצמה - הן מבחינת אזורים שונים ברחבי התא, והן מבחינת השכבות המרכיבות את הממברנה. סידור בלתי-סימטרי של חומצות שומן בין העלה החיצוני לעלה הפנימי של קרום התא מתבצע באמצעות משפחה של חלבונים הנקראים פליפאזות, פלופאזות וסקרמבלאזות [30]. פליפאזות משנעות חומצות שומן מן העלה החיצוני אל עבר העלה הפנימי, פלופאזות מבצעות את התנועה ההפוכה, וסקרמבלאזות משנעות חומצות שומן בשני הכיוונים. באופן שגרתי, חומצת השומן פוספטידיל-סרין ממוקמת בשכבה הפנימית של הממברנה התאית בלבד. בתנאים אפופטוטיים, ישנו עיכוב של פליפאז בשם ATP11C ושפעול של סקרמבלאז בשם Xkr8 [31][32]. הימצאות חומצת השומן פוספטידיל-סרין בעלה החיצוני של הממברנה של התא מהווה סיגנל אכילה (Eat-me Signal) לפאגוציטים, ומובילה לבליעת התא האפופטוטי [33].

תאי +CD4[עריכת קוד מקור | עריכה]
התפקיד המרכזי של תאי +CD4 משופעלים הינו מתן סיוע לתאי B לייצר נוגדנים באתר לימפואידי שניוני. לכן תאים אלו נקראים גם Helper T Cells, או בקיצור תאי TH. תאי TH משפיעים על פעילותם והתמיינותם של תאים רבים השייכים למערכת החיסון, כולל תאי B, תאי T מסוג +CD8, מקרופאג'ים, מונוציטים, תאים דנדריטים, תאי NK ועוד.
לאחר הקישור של קולטן ה-TCR עם האנטיגן המוצג על גבי MHC Class II, מפריש תא ה-TH ציטוקינים לתא המטרה והסביבתו הקרובה. מסורתית תאי TH סווגו לאחת משתי קבוצות בהתאם לציטוקינים שהם הפרישו: תאי TH1 מפרישים כמויות גדולות של IFN-γ ו-TNF-α, ואילו תאי TH2 מפרישים בעיקר IL-4, IL-5 ו-IL-13. הציטוקינים אותם מפריש תא TH1 חיוניים לתפקודם של תאי CTL ומקרופאג'ים, ולכן מהותיים בעת מאבק הגוף בפתוגנים תוך-תאיים, כמו וירוסים. הציטוקינים המופרשים על ידי תאי TH2 תומכים בהתמיינותם של תאי B לתאי פלזמה ובהפרשת נוגדנים. ציטוקינים אלה משחקים תפקיד גם באקטיבציית גרנולוציטים (אאוזינופילים, באזופילים ותאי מאסט), ולכן מהווים אלמנט מרכזי במאבק בטפילים חוץ תאיים, וכן בפתופיזיולוגיה של אלרגיה. ישנם תאי T נוספים התומכים בהתמיינות תאי B, והם כוללים את תאי ה-T הפוליקולריים (נקראים TFH). תאים אלו ממוקמים באיברי SLO, והם חיוניים להבשלת תאי B ב-Germinal Center. לאחרונה תת-קבוצות נוספות של תאי TH התגלו ותוארו בהרחבה, כגון תאי TH17 אשר מפרישים את הציטוקין מעודד-הדלקת IL-17, אך גם IL-6 ו-IL-21. מלבד ביסוס דלקת, תאי TH17 מובילים להפרשת כימוקינים המגייסים ניוטרופילים רבים לאתר הפגוע. בהתאם, מסתמן כי תאי TH17 מסייעים להתמודדות כנגד בקטריות ופטריות חוץ-תאיות, וכן בפתופיזיולוגיה של מספר מחלות אוטואימוניות שנחשדו בעבר כי הן נובעות מתאי TH1 [34].
גורמים רבים משפיעים על התמיינותם של תאי ה-+CD4 לכדי TH ספציפיים. בין היתר ניתן למנות את: סוג וכמות האנטיגן אליו נחשפים התאים; תגובת תאי ה-APC לאנטיגן ומגוון חלבוני המעטפת אותם הם מבטאים לאחר האינטראקציה עם האנטיגן; הציטוקינים אותם תאי APC, ובראשם תאים דנדריטיים, מפרישים לסביבתם עם קליטת הפתוגן. ראו תמונה למידע נוסף.
תאי Treg[עריכת קוד מקור | עריכה]

קבוצה מרכזית נוספת של תאי TH הינם תאי T רגולטוריים, או בקיצור Treg. מדובר בקבוצה של תאים אשר מדכאים פעילות חיסונית, ולמעשה מלמדים את מערכת החיסון את מה לא-לתקוף. פעילותם של תאים אלו אחראית למניעת נזקים חיסוניים עודפים, אך גם מקושרת למגוון רחב של מחלות: הפרעות אוטואימוניות, סרטן, דחיית שתלים, אלרגיה ועוד. מקורם של חלק מתאי ה-Treg הוא עוד בבלוטת התימוס, ועל כן נקראים Natural Regulatory T cells, או nTreg. אחרים מופיעים במהלך השפעול של תאי T בפריפריה, ולכן נקראים Inducible Treg (או iTreg). תאי ה-iTreg מסווגים לשלוש קבוצות מרכזיות: תאי -CD4+CD25 (להבדיל מתאי ה-nTreg אשר מסווגים כ+CD4+CD25), תאי TH3 ותאי +CD8 [2]. סיווג זה מבטא שונות רבה בחלבוני המעטפת המבוטאים על פני הממברנה, בציטוקינים המופרשים לסביבה, ובמנגנוני הדיכוי החיסוני.
חלק מתאי ה-Treg מפרישים את הציטוקין מדכא הדלקת IL-10, אחרים מתמחים בהפרשה של ציטוקין מדכא דלקת אחר בשם TGF-β, ואילו קבוצה שלישית של תאים מפרישים בעיקר IL-35. טקטיקה נוספת של תאי Treg הינה ספיחה של ציטוקינים מעודדי דלקת מסביבת התא - אשר יועדו לתאים חיסוניים אחרים. הדוגמה המרכזית למנגנון זה היא ספיגת הציטוקין IL-2, אשר חיוני להתרבות לימפוציטים, וכן להישארותם בחיים. כמו כן, ביכולתם של חלק מתאי ה-Treg להמיר כמויות גדולות של ATP בסביבת התא לכדי אדנוזין או AMP, מולקולות המשרות דיכוי חיסוני [35]. תוארו בספרות גם מנגנוני עיכוב התלויים במגע ישיר בין התאים (Cell-to-cell contact); הן על ידי ביטוי מולקולות אשר מדכאות קו-סטימולציה (לדוגמה, CTLA-4) והן על ידי הרג ציטוטוקסי של תאים חיסוניים. מסתמן כי הביטוי של CTLA-4 מדכא בעיקר תאי APC, ולכן מפחית פעילות לימפוציטית באופן עקיף. מנגד, עיקר הפעילות הציטוטוקסית של תאי Treg ככל הנראה תלוי במסלול האינטרינזי (פרפורין וגרנזים B), ולא במסלול האקסטרינזי של Fas/FasL [36].
מרבית תאי ה-Treg הינם מסוג +CD4, אך כאמור ישנם גם תאי +CD8 רגולטוריים, ואף תאי B רגולטוריים המכונים תאי Breg או B10 - בשל יכולתם להפריש את הציטוקין IL-10.
זיכרון חיסוני[עריכת קוד מקור | עריכה]

שני מאפייני הדגל של מערכת החיסון הנרכשת, אשר מבדילים אותה ממערכת החיסון המולדת, הם (1) הספציפיות הגבוהה של קולטני התאים המעורבים לאנטיגנים התואמים להם ו-(2) ביסוס זיכרון חיסוני לאחר החשיפה לאנטיגן. כתוצאה מהתרבות הלימפוציטים אשר נושאים קולטני BCR ו-TCR ספציפיים, וכן בזכות סף שפעול נמוך יותר, בעת החשיפה הבאה לאנטיגן מוכר - תפעל מערכת החיסון במהירות וביעילות גבוהה יותר מאשר בפעם הראשונה. הפער בעוצמה של התגובה החיסונית הראשונה לבין אלו שמגיעות לאחריה מונצח בטרמינולוגיה עקבית וקבועה; התגובה החיסונית הראשונה לאנטיגן מכונה Primary Immune Response, ואילו התגובות הבאות לאותו האנטיגן נקראות Secondary Immune Response. תכונה זו של תאי T ו-B ללמוד אנטיגנים ולהגיב אליהם בעוצמה מתגברת היא הבסיס הפיזיולוגי לחיסונים, אך גם לנטייתן של אלרגיות להחמיר עם הזמן.
תאי זיכרון שנוצרים לאחר התחסנות או זיהום הינם לרוב ארוכי-חיים ושקטים. בבני אדם, תאי זיכרון של לימפוציטי T עשויים להימצא עשורים רבים לאחר החשיפה לאנטיגן. כמו כן, גם נוגדנים נותרים לעיתים פרק זמן ממושך בזרם הדם, כפי שנצפה בקרב מחוסני אבעועות-שחורות למעלה משמונה עשורים לאחר שהתחסנו. מבחינה מספרית, תאי זיכרון לרוב שכיחים פי 100-1000 מאשר הלימפוציטים הנאיביים לאותו האנטיגן. עוד לא ברורים דיים הפקטורים אשר מאפשרים לתאי זיכרון לחיות פרק זמן כה ארוך, ובכמות כה רבה, אך מספר ציטוקינים חשובים זוהו ויפורטו בהמשך.
זיכרון חיסוני של תאי T[עריכת קוד מקור | עריכה]
לאחר השפעול של תאי T נאיביים, מתרבים הלימפוציטים לכדי שבטים (clones) של תאי-בת בעלי קולטן TCR זהה. חלק מתאי הבת מתמיינים לתאי +CD8 ו-+CD4 אפקטוריים, ואילו אחרים מתמיינים לתאי זיכרון. מערכת היחסים בין תאי T נאיביים, תאי T אפקטוריים ותאי זיכרון עדיין לא ברורה לחלוטין: כיום לא ידוע אם תאי זיכרון נוצרים במקביל לתאים אפקטוריים או לאחריהם; האם תאי הזיכרון מהווים שלב התמיינות נוסף לאחר הפיכת הלימפוציטים הנאיביים לאפקטורים; והאם ישנו יחס ישר בין כמות התאים האפקטוריים לבין תאי הזיכרון הנוצרים.

מבחינה פונקציונלית, תאי הזיכרון (נקראים גם Memory T Cells או TM) מגיבים במהרה לאחר אינטראקציית TCR-אנטיגן: חלקם מפרישים מולקולות אפקטוריות שעות ספורות לאחר קשירת האנטיגן, אחרים בשלב זה מתחילים להתרבות. בעוד שלימפוציט נאיבי זקוק לשלושה סיגנלים להשלמת השפעול (TCR/אנטיגן, קו-סטימולציה, וציטוקינים) - תאי זיכרון עשויים לסיים את שפעולם גם ללא קו-סטימולציה, או לפחות דרישתם לקו-סטימולציה על ידי CD28 איננה כה נוקשית כמו של לימפוציטים נאיביים. ישנן עדויות מעבדתיות לפיהן משך חייהם של תאי ה-Memory T Cells תלוי בשלושה ציטוקינים מרכזיים: IL-7, IL-2 ו-IL-15. ככל הנראה תפקידם של IL-2 ו-IL-15 הינו לתמוך בהתרבות התאים, ואילו תפקידו של IL-7 הינו לספק סיגנל חיות אשר מונע את כניסת התאים לאפופטוזיס.
תאי ה-TM משתייכים לאחת משתי תת-קבוצות זמן קצר לאחר היווצרם. תת-קבוצה אחת מתאפיינת בכך שלימפוציטים אלו מהגרים כדרך קבע לאיברים לימפואידיים שניוניים, ומתמחים בהתרבות מהירה לאחר שפעולם. למעשה תאים אלו, אשר נקראים גם Central Memory T Cells, או TCM, מחכים את פעילותם של הלימפוציטים הנאיביים, אך עולים עליהם בכמותם ובמהירות פעולתם. מנגד, תת-הקבוצה השנייה של תאי ה-TM ממוקמת בזרם הדם, ובאיברים פריפריים. אף על פי שתאים אלו מחזיקים ביכולת התרבות נמוכה, פעילותם האנטי-מיקרוביאלית מהירה למדי. תת-קבוצה זו מכונה Effector Memory T Cells, או TEM.
תאים נאיביים, תאים אפקטוריים, תאי זיכרון מרכזי ותאי זיכרון אפקטורי נבדלים אלה מאלה בחלבוני מעטפת שונים אותם הם מבטאים, רגישות שונה לכימוקינים, מהירות תגובה משתנה, יכולת התרבות שונה - ועוד. בדומה לתאים נאיביים, מיקומם של תאי הזיכרון בגוף נקבע על פי תבנית קולטני הכימוקינים אותם הם מבטאים.
זיכרון חיסוני של תאי B[עריכת קוד מקור | עריכה]
ההגנה החיסונית הממושכת שמקורה בתאי B משויכת לאחד משני צירים: תאי זיכרון מסוג B (נקראים גם Memory B Cells, או BM) שאינם מפרישים נוגדנים, אך מסוגלים להתרבות במהירות רבה לאחר חשיפה לאנטיגן; ותאי פלזמה ארוכי-חיים (Long Lived Plasma Cells), אשר ממוקמים במח העצם, ומפרישים נוגדנים בכל עת. הנוגדנים הללו ממתינים לאנטיגן התואם להם מבעוד מועד, ולכן במידה ואנטיגן זה יחדור לגוף בשנית - הוא ינוטרל בטרם ייווצר נזק לרקמות ולאיברים השונים. כעת נסקור ביתר פירוט את התאים הללו.
Memory B Cells[עריכת קוד מקור | עריכה]

תאי הזיכרון מסוג B מבטאים קולטן BCR אשר עבר לפני כן תהליך של Class Switching (החלפת השרשראות הכבדות מסוג M לסוג אחר) וכן תהליך של היפרמוטציה סומטית (SHM). כאמור, תהליכים אלו התרחשו ב-Germinal Center, לאחר שפעול תאי B נאיביים על ידי תאי +CD4.
בניגוד לתאי פלזמה, תאי הזיכרון נמצאים במצב מנוחה, ואינם מפרישים נוגדנים, אלא אם כן יעברו גירוי על ידי אנטיגן. לאחר סילוק האנטיגן במפגש הראשוני, תאי הזיכרון מתמקמים בטחול וברקמות לימפואידיות נוספות. חשיפה חוזרת לאנטיגן מובילה לשפעול התאים הללו, ולהפרשה מהירה ומאסיבית של נוגדנים. התאוצה בשפעול תאי הזיכרון נובעת הן מכמות התאים המוגברת, אשר מעלה את הסיכוי של האנטיגן לפגוש לימפוציט תואם, וכן בזכות תאי זיכרון מסוג +CD4 - אשר בעצמם חווים אקטיבציה מואצת. בדומה לתאים נאיביים, תאי הזיכרון המשופעלים מתרבים ומתמיינים בתורם לתאי זיכרון ולתאי פלזמה אשר מפרישים נוגדנים. מכיוון שתאי TH מסייעים לאקטיבציית תאי הזיכרון, לאחר השפעול נוצרים בשנית אתרי Germinal Centers; ובאתרים אלו עוברים קולטני ה-BCR השבחה באמצעות Somatic Hypermutation - SHM. תהליך שיטתי זה של השבחה בכל אקטיבציה נוספת נקרא Affinity Maturation, וכפועל יוצא נוגדנים נקשרים ביעילות גוברת עם כל חשיפה חוזרת לאנטיגן.
תאי פלזמה ארוכי-חיים[עריכת קוד מקור | עריכה]
תאי פלזמה הינם תאים בשלב התמיינות סופי, אשר אינם מתחלקים, ומאופיינים בהפרשת נוגדנים. ישנם שני סוגים של תאי פלזמה. הסוג הראשון הינו תאי פלזמה קצרי-חיים (Short Lived Plasma Cells), שלרוב מחזיקים מעמד ימים ספורים, עד כדי שבועיים. מרבית תאי הפלזמה הינם קצרי חיים, ונוגדנים המופרשים מתאים אלו הינם בעלי זמן מחצית חיים ממוצע של שלושה שבועות. לכן החלק הארי של הנוגדנים המופיעים לאחר מפגש עם אנטיגן מסולקים בתוך פרק זמן של כ-15 שבועות. מנגד, ישנם גם תאי פלזמה ארוכי-חיים (Long Lived Plasma Cells), אשר נפלטים מה-Germinal Center, ובשלב מוקדם נודדים אל עבר מח העצם. בשל תכונה זו, נקראים התאים הללו גם Bone-Marrow B Cells, או BMBC בקיצור. תאים אלו מפרישים ללא הרף נוגדנים לזרם הדם, וכן ישנן עדויות כי זמן מחצית החיים של תאים אלו מתארך גם הוא. סיגנל החיים של תאי ה-BMBC מתקבל ממגוון רחב של תאים הנמצאים בנישת מח העצם. משך החיים של תאי BMBC עשוי לעיתים להשתוות אפילו למשך החיים של האדם, כפי שהודגם בקרב מחוסני אבעבועות שחורות 8 עשורים לאחר התחסנותם (ו-4-5 עשורים לאחר מיגור הנגיף).
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ Janeway CA Jr, The importance of immunological memory in fixing adaptive immunity in the genome, 2001
- ^ 1 2 3 4 5 6 7 8 9 10 11 9, Fields Virology, Sixth Edition, Philadelphia, PA 19103 USA: LIPPINCOTT WILLIAMS & WILKINS, 2013, ISBN 978-1-4511-0563-6
- ^ Lewis L. Lanier & Joseph C. Sun, Do the terms innate and adaptive immunity create conceptual barriers?, Nature Reviews Immunology, 2009 doi: https://doi.org/10.1038/nri2547
- ^ 1 2 Charles A. Janeway, Jr. and Ruslan Medzhitov, Innate Immune Recognition, Annual Review of Immunology, 2002 doi: https://doi.org/10.1146/annurev.immunol.20.083001.084359
- ^ 1 2 Danyang Li & Minghua Wu, Pattern recognition receptors in health and diseases, nature - signal transduction and targeted therapy, 2021 doi: https://doi.org/10.1038/s41392-021-00687-0
- ^ 8, Fields Virology, Sixth Edition, Philadelphia, PA 19103 USA: y LIPPINCOTT WILLIAMS & WILKINS, 2013, ISBN 978-1-4511-0563-6
- ^ Janeway CA Jr, Antigen Recognition by B-cell and T-cell Receptors, 2001
- ^ Jacques Neefjes et al, Towards a systems understanding of MHC class I and MHC class II antigen presentation, Nature, 2011 doi: https://doi.org/10.1038/nri3084
- ^ Anaya JM, Shoenfeld Y, Rojas-Villarraga A, et al, Autoimmunity: From Bench to Bedside, El Rosario University Press, 2013
- ^ Ashley P Ng & Warren S Alexander, Haematopoietic stem cells: past, present and future, Nature - cell death discovery, 2017 doi: https://doi.org/10.1038/cddiscovery.2017.2
- ^ Gerard J. Tortora & Bryan Derrickson, 19, ANATOMY & PHYSIOLOGY, 14, John Wiley & Sons, Inc, 2014, עמ' 665-668, ISBN 978-1-118-34500-9
- ^ Li Wu & Yong-Jun Liu, Development of Dendritic-Cell Lineages, Cell, 2007 doi: https://doi.org/10.1016/j.immuni.2007.06.006
- ^ Alex M. Abel et al, Natural Killer Cells: Development, Maturation, and Clinical Utilization, Frontiers in Immunology, 2018 doi: https://doi.org/10.3389/fimmu.2018.01869
- ^ Sabrina Bianca Bennstein, Unraveling Natural Killer T-Cells Development, Frontiers in Immunology, 2018 doi: https://doi.org/10.3389/fimmu.2017.01950
- ^ Max D. Cooper, The early history of B cells, Nature Reviews Immunology, 2015 doi: https://doi.org/10.1038/nri3801
- ^ M. Louise Markert et al, Transplantation of Thymus Tissue in Complete DiGeorge Syndrome, The New England Journal of Medicine, 2000 doi: 10.1056/NEJM199910143411603
- ^ Takashi Nagasawa, Microenvironmental niches in the bone marrow required for B-cell development, Nature Reviews Immunology, 2006 doi: https://doi.org/10.1038/nri1780
- ^ Judith A. Owen & Jenni Punt & Sharon A. Stranford, Kuby Immunology, 7, 41 Madison Avenue New York, NY 10010: W. H. Freeman and Company, 2013,ISBN : 978-14641-3784-6
- ^ Min-Sung Kim et al, Crystal structure of the V(D)J recombinase RAG1–RAG2, Nature, 2015 doi: https://doi.org/10.1038/nature14174
- ^ Kenneth Murphy & Casey Weaver, Janeway's Immunobiology, 9th Edition, 711 Third Avenue, New York, NY, 10017, USA, and 3 Park Square, Milton Park, Abingdon, OX14 4RN, UK: Garland Science, Taylor & Francis Group, LLC, 2017, ISBN 978-0-8153-4505-3
- ^ Harry W Schroeder, Jr, M.D., Ph.D. & Lisa Cavacini, Ph.D, Structure and Function of Immunoglobulins, J Allergy Clin Immunol, 2010 doi: 10.1016/j.jaci.2009.09.046
- ^ Sonia André et al, T cell apoptosis characterizes severe Covid-19 disease, Nature, 2022 doi: https://doi.org/10.1038/s41418-022-00936-x
- ^ Feargal J. Ryan et al, Long-term perturbation of the peripheral immune system months after SARS-CoV-2 infection, BMC Medicine, 2022 doi: https://doi.org/10.1186/s12916-021-02228-6
- ^ Bahire Kalfaoglu et al, T-cell dysregulation in COVID-19, Biochemical and Biophysical Research Communications, 2021 doi: 10.1016/j.bbrc.2020.10.079
- ^ Xu-Rui Shen et al, ACE2-independent infection of T lymphocytes by SARS-CoV-2, Nature, 2022 doi: https://doi.org/10.1038/s41392-022-00919-x
- ^ F. M. Burnet M.D, Ph.D, A Modification of Jerne's Theory of Antibody Production Using the Concept of Clonal Selection, Australian Journal of Science, 1957
- ^ Philip D Hodgkin, William R Heath & Alan G Baxter, The clonal selection theory: 50 years since the revolution, Nature Immunology, 2007 doi: https://doi.org/10.1038/ni1007-1019
- ^ 12, Kuby Immunology, 7, New York, NY 10010: Susan Winslow, W. H. Freeman and Company, 2013, עמ' 385-386, ISBN 978-14292-1919-8
- ^ Chapter 1, Janeway's Immuno-Biology, 9th edition, Garland Science, Taylor & Francis Group, LLC, 2017, עמ' 15-16, ISBN 978-0-8153-4505-3. (בenglish)
- ^ Joost C. M. Holthuis & Tim P. Levine, Lipid traffic: floppy drives and a superhighway, Nature Reviews, 2005 doi: https://doi.org/10.1038/nrm1591
- ^ Hanayo Nakanishi et al, Transport Cycle of Plasma Membrane Flippase ATP11C by Cryo-EM, Cell, 2020 doi: https://doi.org/10.1016/j.celrep.2020.108208
- ^ Jun Suzuki & Eiichi Imanishi & Shigekazu Nagataa, Xkr8 phospholipid scrambling complex in apoptotic phosphatidylserine exposure, PNAS, 2016 doi: 10.1073/pnas.1610403113
- ^ Valerie Depraetere, “Eat me”signals of apoptotic bodies, Nature, 2000 doi: https://doi.org/10.1038/35014098
- ^ José Francisco Zambrano-Zaragoza el al, Th17 Cells in Autoimmune and Infectious Diseases, International Journal of Inflammation, 2014 doi: 10.1155/2014/651503
- ^ Marco Romano et al, Past, Present, and Future of Regulatory T Cell Therapy in Transplantation and Autoimmunity, Frontiers in Immunology, 2019 doi: https://doi.org/10.3389/fimmu.2019.00043
- ^ Dario A. A. Vignali & Lauren W. Collison & Creg J. Workman, How regulatory T cells work, Nature, 2008 doi: https://doi.org/10.1038/nri2343

