ניוון מקולרי
 | |
| תחום |
רפואת עיניים |
|---|---|
| קישורים ומאגרי מידע | |
| MeSH | D008268 |



ניוון מקולרי או ניוון רשתית (מאנגלית: Macular degeneration) הוא מחלת עיניים המתפתחת לאורך שנים, כאשר שומנים וחלבונים שונים מצטברים מתחת לרשתית עד שהם פוגעים באופן משמעותי בחדות הראייה. נ"ר היא גורם העיוורון הראשון בשכיחותו בעולם המפותח וכן בישראל[1][2]. במהלך התקדמות המחלה נפגע תפקודם של הפוטורצפטורים ושל ה"אפיתליום של פיגמנט הרשתית" (RPE - Retinal Pigment Epithelium)(אנ') בעיקר באזור מרכז הראייה הנקרא מקולה והפוביאה (Fovea centralis) בתוכה, שבה הראייה היא הכי מפוקסת . עם התקדמות המחלה מפסיקים הפוטורצפטורים לפעול.
מופעה הנפוץ של המחלה קשור לגיל, הנקרא ניוון רשתית גילי (נר"ג, או AMD, ראשי תיבות של Age-related Macular Degeneration).
אבחון עצמי מוקדם לחשד למחלה יכול להיעשות באמצעות אמצעי פשוט כדוגמת לוח אמסלר(אנ'), שהוא למעשה רשת פסים שתי וערב עם נקודת פיקסציה שחורה במרכז בה מתמקדים. המלצת הרופאים היא לבצע בדיקה זו, גם כשלא עולה חשד למחלה, על מנת לאבחנה מוקדם ככל האפשר[3][4].
לעיתים המחלה יכולה להתפתח רק בעין אחת, ולאחר תקופה מסוימת יכולה להתפתח גם בעין השנייה. לפיכך חשוב לעשות אבחנה לעין השנייה, גם במקרה שרק עין אחת חולה וגם על מנת לנטר את התדרדרות המחלה[5][6].
חלק מתסמיני המחלה מזכירים את המחלה בצקת מקולרית על רקע סוכרת, בהם אזורים מתים או מטושטשים באזור המקולרי, וכן בצורת הטיפול והאבחנה[7].
סיווג[עריכת קוד מקור | עריכה]
באופן כללי נהוג לחלק את המחלה ל-AMD "יבש" (non neovascular) ול-AMD "רטוב" (neovascular). ההבדל בין שני הסוגים הוא בנוכחות כלי דם פתולוגיים הצומחים מתחת לרשתית, וכן בחומרת תסמיני המחלה.
ניוון רשתית "יבש"[עריכת קוד מקור | עריכה]
בשלב מוקדם של ניוון רשתית קשור לגיל מופיעים משקעים צהובים או לבנים של חומר חוץ תאי (חומר היאליני) באזור המקולה המכונים דרוזן (Drusen). המשקעים מצטברים בין האפיתל הצבעני של הרשתית (RPE) לבין הממברנה ע"ש ברוק שהיא השכבה הפנימית של הדמית. כמות גדולה של דרוזן משמעה סיכוי גדול להתפתחות של ניוון רשתית. הצטברות זו של דרוזן גורמת לפעילות רדיקלים חופשיים ופגיעה ברשתית, קיים אובדן של פוטורצפטורים ושל תאים תומכים בפוטורצפטורים. התקדמות המופע היבש איטית יחסית אך אין בנמצא טיפול יעיל למחלה. לרוב האנשים בשלב זה אין פגיעה בראיה. במקרים חמורים של נר"ג יבש, מופיעה אטרופיה אזורית, שבה מתרחש ניוון של קולטני אור, אפיתל צבעני ודמית באזור נרחב במקולה. אטרופיה תהיה בדרך כלל מלווה בפגיעה בראייה.
ניוון רשתית "רטוב"[עריכת קוד מקור | עריכה]
בסוג ה"רטוב", המחלה נגרמת כתוצאה מגדילה של כלי דם חדשים מתחת לפוביאה. חלקם, כ-25%, חודרים מהדמית לתוך הרשתית ומדממים (CNV- Choroidal Neovascularization). מצב זה גורם בתוך זמן קצר לניוון ואובדן ראייה בחלקה הגדול של הפוביאה (שנמצאת במרכז המקולה). הסיבה לדימומים נעוצה בכך שכלי הדם החדשים הם בעלי דופן חלשה יותר. כתוצאה מהדימום נוצרת רקמת צלקת במרכז הראייה הגורמת להופעת כתם שחור. ברוב המקרים המחלה מתבטאת בירידה בראייה המתבטאת באיבוד יכולת קריאה, יכולת אבחון פנים, יכולת קריאת שעון וראייה תפקודית.

גורמי סיכון[עריכת קוד מקור | עריכה]
- גיל מתקדם - בעוד שיעור התחלואה הכללי בכלל האוכלוסייה בשלבים המתקדמים של נמ"ג עומד על כ-1.5%, באוכלוסייה מעל 75 השיעור הוא מעל 7%[8].
- תורשה - סיפור משפחתי של ניוון רשתית מעלה את הסיכון של קרוביו לפתח את המחלה. ממצאים אלו חוזקו במחקרי תאומים.
- גזע - גם משפיע על המחלה, בארצות הברית שיעור התחלואה בקרב שחורים נמוך מאוד ביחס ללבנים[9].
- מין - נשים נמצאות בסיכון מוגבר.[דרוש מקור]
- עישון - מחקרים רבים הצביעו על עישון כעל גורם סיכון חד משמעי להתפתחות נמ"ג. הסברים אפשריים להשפעת העישון על התפתחות נמ"ג הם עליה ברמות של עקה חמצונית ברקמות, עליה ברמות צבירת טסיות, ועליה ברמת פיברינוגן ובנוסף - ירידה ברמת נוגדי החמצון בדם. גם זרימת הדם בדמית עשויה להיפגע בגלל העישון[10].
- תזונה - השמנת יתר נקשרה עם סיכון גבוה לחלות בנמ"ג. לעומת זאת צריכת לוטאין, זיאקסנטין, שומן מסוג אומגה-3 ודגים מפחיתות את הסיכון לחלות במחלה.[11]
אבחנה[עריכת קוד מקור | עריכה]

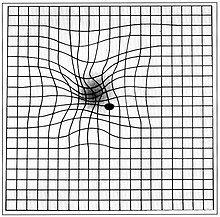
אבחון עצמי[עריכת קוד מקור | עריכה]
ניתן להיעשות בבית באמצעות "מבחן אמסלר" (AMSLER grid): הקווים הישרים של המשבצות צריכים להראות ישרים ומקבילים וללא קפיצות וריצודים הן בשתי העיניים והן בהסתכלות בכל עין בנפרד. אם אין הדבר כך, יכולה עובדה זו להוות חשד ראשוני לבעיית ניוון מרכז הראיה, אם כי ייתכן שהבעיה נובעת מגורמים אחרים.
אבחון בבדיקה אצל רופא עיניים מומחה[עריכת קוד מקור | עריכה]
אבחון אצל רופא עיניים יכול להתבצע בכמה אמצעים ושיטות :
- הסתכלות על הרשתית באמצעות מנורת סדק או אמצעי עזר אחרים המאפשרים הסתכלות על קרקעית העין, שם יחפש אחרי משקעי דרוזן, כלי דם פתולוגיים, דימומים ובצקות.
- צילום פלורוסצאין - הזרקת חומר פלואורסצנטי המאפשר לראות את כלי הדם ונוכחות דלף מאותם כלי דם פתולוגיים.
- צילום אינדוציאנין ירוק (ICG) - הזרקת חומר פלואורסצנטי החודר לשכבות עמוקות יותר של הרשתית, יכול לדמות גם אזורים הנמצאים מתחת לדימום. בשימוש כשיש דימום נרחב.
- OCT) Optical Coherence Tomography) - צילום המראה את עובי הרשתית ובעזרתו ניתן להעריך את מידת הדימום. הבדיקה קלה ואינה דורשת הזרקה.
טיפול[עריכת קוד מקור | עריכה]
טיפול בניוון רשתית יבש[עריכת קוד מקור | עריכה]
בסוג היבש ניתן לטיפול באמצעות ויטמינים (B, C, E) ובנוסף אבץ, חומרים אלו פועלים כנוגדי חמצון (אנטי-אוקסידנטים) ומנטרלים את פעילות הרדיקלים החופשיים שהצטברו. הטיפול מוריד ב-25% את התקדמות המחלה ל-5 שנים.
טיפול בניוון רשתית רטוב[עריכת קוד מקור | עריכה]
טיפולים נוגדי אנגיוגנזה: מאז שנת 2006, נעשה שימוש גובר בהזרקת תרופות נוגדות אנגיוגנזה (יצירת כלי דם חדשים) לעין. תרופות אלו עוצרות את תהליך יצירת כלי הדם החדשים בשלב הרטוב של נמ"ג. לעיתים התרופות מצליחות גם להביא לנסיגה בכלי הדם שכבר נוצרו ואף להביא לשיפור בחדות הראייה אצל חולים. תרופות אלה הביאו לפריצת דרך בטיפול בניוון רשתית בצורה ה"רטובה" ובאחוז גבוה יש עצירת ההידרדרות בראייה ואפילו שיפור. השימוש בתרופות גרם לירידה ניכרת בטיפול ה-PDT. תרופות עיקריות בקטגוריה זו:
- אווסטין (Avastin) - האווסטין לא מאושרת על ידי מנהל המזון והתרופות האמריקאי (ה-FDA) או על ידי משרד הבריאות בישראל למטרה זו, אולם למרות זאת נהוג להשתמש בה על ידי הזרקתה בכמויות קטנות לעין. האווסטין הוא חומר הפועל על VEGF - Vascular Endothelial Growth Factor (הורמון גדילה האחראי על התפתחות כלי דם) ומונע את פעולתו ובכך מונע יצירת כלי דם חדשים. אבסטין נמצא בשימוש גם בטיפול במחלות ממאירות כדוגמת סרטן המעי הגס. לא נערך בה מחקר לטיפול בניוון מקולרי.
- לוסנטיס (Lucentis) - החברה המייצרת את האווסטין (נוברטיס), פיתחה תרופה דומה לאווסטין, עם מולקולה קטנה יותר בשם Lucentis, אשר קיבלה ביולי 2006 אישור ("התוויה") של מנהל המזון והתרופות האמריקאי עבור טיפול ב-AMD רטוב[14] לוסנטיס יקרה פי 20 ויותר מן האווסטין למרות שמדובר באותה מולקולה כמעט[15].
- אייליה (Eylea) - תרופה שפותחה במיוחד לטיפול במחלות רשתית, הרשומה לשימוש בישראל (כמו גם בארצות הברית ובאירופה) לטיפול בניוון מקולרי גילי, בצקת מקולרית על רקע סוכרת ומחלות רשתית נוספות[16]. אייליה פועלת באמצעות חסימת חלבון VEGF – חלבון המהווה "פקטור צמיחה" ומעודד צמיחה פתולוגית של כלי הדם הלא תקינים ברשתית. על מנת לחסום את פעילותו, אפליברספט נקשרת לחלבון משני צדדיו (כמו "שתי ידיים על הכדור") ובכך חוסמת את יכולתו של החלבון להיקשר לרצפטור שלו[17] ביעילות גבוהה פי 140 ויותר מתכשירים הנקשרים אל החלבון רק בצד אחד שלו. כתוצאה מכך ניתן להזריק אייליה בתדירות נמוכה יותר[18]. בנוסף, אפליברספט לוכד גם את מולקולת PlGF (placental growth factor) שמעורבת אף היא בפתוגנזה של המחלה. בניוון מקולרי רשתי מטפלים באפליברספט בזריקות אחת לחודשיים (לאחר 3 מנות העמסה חודשיות). הפחתת תדירות ההזרקות תורמת להפחתה בסיכון לתופעות לוואי כתוצאה מזריקות עיניות, והפחתת העומס על הרופאים והמטופלים. מינהל המזון והתרופות האמריקאי (FDA) אישר ב-2011 את הטיפול באייליה לניוון מקולרי גילי[19]. הרשות האירופית לרישוי תרופות (EMA) אישרה ב-2012 את הטיפול באייליה לניוון מקולרי גילי[20]. משרד הבריאות אישר את השימוש באייליה בארבע התוויות: ניוון מקולרי גילי (wAMD), בצקת מקולרית על רקע סוכרת (DME), צמיחת כלי דם פתולוגיים ברשתית במטופלים הסובלים מקוצר ראייה חמור (myopic CNV), בצקת מקולרית בעקבות חסימה בווריד הרשתית המרכזי (CRVO) או בסעיף וריד הרשתית (BRVO) (ראו ). התרופה אינה כלולה בסל הבריאות של מדינת ישראל אולם היא כלולה בסל המשלים של כל קופות החולים.
- צריבה בעזרת לייזר תרמי: בעבר נהגו לצרוב את כלי הדם המדממים בלייזר, קרן הלייזר הורסת את כל שכבות הרשתית ואת כלי הדם וכאן חסרונה, על כן, טיפול זה נמצא בשימוש במקרים בהם הנגעים רחוקים מהפוביאה. במחקרים הוברר שהטיפול הזה מזיק יותר ממועיל ומקדים את העיוורון. לכן הופסק בראשית שנות ה-2000 הטיפול הזה בנוון מקולרי.
- טיפול פוטודינמי: מאז ראשית שנות ה-2000 פותח טיפול פוטודינמי בעזרת לייזר 'קר' שבו מוחדר דרך וריד היקפי נוזל פוטודינמי לכלי הדם ברשתית. הלייזר מכוון לכלי הדם הפתולוגיים, וגורם לעירור החומר הפוטודינמי. העירור גורר שחרור רדיקאלים חופשים אשר פוגעים בכלי הדם בהם נמצא החומר הפוטודינמי, וכך נעצרת הדליפה מכלי דם אלו (PDT).
- כירורגיה: הסרת כירורגית של ממברנה פיברווסקולרית וטרנסלוקציה של מרכז הראיה הם שני ניתוחים אשר לעיתים נדירות מבוצעים בחולי נמ"ג בשלב הרטוב של המחלה. בטרנסלוקציה של מרכז הראיה, הרשתית מנותקת מנקודות העגינה שלה לגלגל העין, ומסובבת סביב הציר של עצב הראיה, כך שבמרכז האופטי של העין ממוקמת עתה רשתית שלא עברה ניוון.
מניעה[עריכת קוד מקור | עריכה]
כדרכי מניעה אפשריות למחלה, נהוג להמליץ על הימנעות מעישון, ועל צריכת אנטיאוקסידנטים כחלק מהתזונה. ההמלצה היא בעיקר על הקרוטנואידים לוטאין וזיאקסנטין, היחידים המצויים הן במקולה והן בעדשות העין, וביכולתם לספוג חלק מעודפי האור (בעיקר הכחול)[21][22][23].
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- "לוח אמסלר", והסבר שימוש בעברית-1
- "לוח אמסלר", והסבר שימוש בעברית-2
- הדפסת "לוח אמסלר", והסבר שימוש באנגלית
- ניוון מקולרי, ניוון כתמי - מידע רפואי באתר "מכבי"
- אתר עמותת נמ"ג - ניוון מקולרי גילי
- "כואב אבל פחות", גילה לוי-הוברמן, "ידיעות אחרונות" 17.11.2013
- ליאת רותם מלמד, בני 65? כך תצילו את הראייה שלכם, באתר ynet, 01 ביולי 2014
 אם היו מציעים לכם תרופה ב-50 דולר או ב-2,000 דולר, מה הייתם לוקחים?, באתר TheMarker, 8 בדצמבר 2014
אם היו מציעים לכם תרופה ב-50 דולר או ב-2,000 דולר, מה הייתם לוקחים?, באתר TheMarker, 8 בדצמבר 2014- רוני לינדר, מחקר: לוסנטיס יקרה פי 40 מאווסטין - אך יעילות התרופות זהה, באתר TheMarker, 2 במאי 2011
- מוסף בריאות העין, עמותת "לראות"
- Reuters: Eylea works better vs Avastin and Lucentis in study
- רוני לינדר גנץ, התרופה לוסנטיס יקרה פי 40 מאווסטין - אך לא יעילה יותר, באתר הארץ, 04 באוקטובר 2010
- מידע לציבור אודות אייליה והשימוש בה - רשות התרופות האירופית
- דף הסבר בנוגע לטיפולים מאתר שירותי בריאות כללית
- כתבה על ניוון מקולרי באתר כללית - מאת פרופ דב וינברגר
- ד"ר יוסי פיקל, ניוון הרשתית: איך למנוע עיוורון?, באתר וואלה!, 23 באוקטובר 2012
- ניוון מקולרי, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ ניוון מקולרי גילי, באתר "המרכז הרפואי הדסה"
- ^ World blindness: a 21st century perspective https://bjo.bmj.com/content/85/3/261#:~:text=related%20macular%20degeneration-,Age%20related%20macular%20degeneration%20(AMD)%20is%20now%20the%20leading%20cause%20of%20blindness%20in%20developed%20countries.,-The%20prevalence%20of
- ^ https://www.ncbi.nlm.nih.gov/books/NBK538141/
- ^ https://www.akupunktur-noll.de/en/macular-degeneration/macular-degeneration-diagnosis/amsler-grid-test-for-the-diagnosis-and-early-detection-of-macular-degeneration-amd/
- ^ https://www.camoni.co.il/ניוון-מקולרי--שאלות-לשאול-את-הרופאים#:~:text=איך%20אוכל%20לעקוב%20אחר%20מצב%20הראייה%20שלי%3F
- ^ https://www.itaysharf.com/בדיקת-אמסלר-גריד/#:~:text=למה%20חשוב%20להיבדק%20גם%20כשרק%20עין%20אחת%20פגועה%3F
- ^ https://www.healthcentral.com/article/dme-vs-amd-whats-the-difference#:~:text=SIMILARITIES-,What%20Are%20the%20Similarities%3F,-Both%20conditions%20involve
- ^ Klein R, P.T., Bird A, Vannewkirk MR., The epidemiology of age-related macular degeneration. Am J Ophthalmol., 2004. 137(3): p. 486-95.
- ^ Seddon, J., Ajani, UA, Mitchell, BD., Familial aggregation of age-related maculopathy. Am J Ophthalmol., 1997. 123 (2): p. 199-206.
- ^ Seddon, J.M., S. George, and B. Rosner, Cigarette smoking, fish consumption, omega-3 fatty acid intake, and associations with age-related macular degeneration: the US Twin Study of Age-Related Macular Degeneration. Arch Ophthalmol, 2006. 124(7): p. 995-1001
- ^ האם ג'אנק פוד גורם לעיוורון?, באתר ynet, 15 באוגוסט 2001
- ^ https://www.clalit.co.il/he/your_health/Preventive_medicine/Documents/amd.pdf
- ^ https://www.camoni.co.il/ניוון-מקולרי-גילי-–-מה-שצריך-לדעת#:~:text=יש%20לפנות%20במהירות%20לרופא%20עיניים%20לבירור%20האפשרות%20להתפתחות%20ניוון%20מקולרי.
- ^ ראו למשל דיווח חדשותי
- ^ ד"ר דויד האוזר, "אווסטין או לוסנטיס": מחקר CATT שפורסם ב-2011 הראה כי בתקופת של שנה אחת, אין הבדל משמעותי ביעילות של אווסטין ולוסנטיס כטיפול בניוון מקולרי רטוב
- ^ אישור ורישום אייליה, אגף הרוקחות במשרד הבריאות
- ^ European Medicines Agency Summary for the public - Eylea
- ^ [https://www.maccabi4u.co.il/13195-he/Maccabi.aspx?TabId=13197_13198_13203 ניוון מקולרי מידע רפואי - טיפול, באתר מכבי שירותי בריאות
- ^ FDA approves new treatment for diabetic retinopathy in patients with diabetic macular edema
- ^ European Medicines Agency Authorisation detailsv התוויות ואינדיקציות באירופה
- ^ http://www.tandfonline.com/doi/abs/10.1080/10408390802066979
- ^ https://www.ncbi.nlm.nih.gov/pubmed/17344498
- ^ http://www.webmd.com/eye-health/macular-degeneration/age-related-macular-degeneration-treatment#1
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
