התפלגות מקסוול-בולצמן
| פונקציית צפיפות ההסתברות | |
 | |
| פונקציית ההסתברות המצטברת | |
|---|---|
 | |
| מאפיינים | |
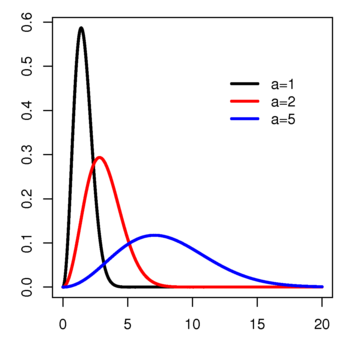
| פרמטרים | a |
| תומך | |
|
פונקציית צפיפות הסתברות (pdf) | |
|
פונקציית ההסתברות המצטברת (cdf) | |
| תוחלת | |
| סטיית תקן | |
| ערך שכיח | |
| שונות | |
| צידוד | |
| גבנוניות | |
התפלגות מקסוול-בולצמן היא התפלגות המשמשת בפיזיקה ובכימיה לתיאור התפלגות גודל של וקטור, שכל אחד מרכיביו מתפלג באופן נורמלי ובלתי תלוי. השימוש הנפוץ ביותר שלה הוא לתיאור התפלגות המהירויות של חלקיקים בגז אידיאלי, אך היא יכולה לתאר, בשינוי הפרמטרים, גם, לדוגמה, את התפלגות התנע או האנרגיה שלהם.
ההתפלגות קרויה על שם הפיזיקאי הסקוטי ג'יימס קלרק מקסוול והפיזיקאי האוסטרי לודוויג בולצמן.
באופן פורמלי, אם הם משתנים מקריים נורמליים בלתי-תלויים בעלי תוחלת 0 וסטיית תקן אז המשתנה המקרי המוגדר על ידי מתפלג לפי התפלגות מקסוול-בולצמן עם פרמטר . במקרה זה, מתפלג התפלגות כי בריבוע עם שלוש דרגות חופש.
נוסחת צפיפות ההסתברות הכללית להתפלגות מקסוול-בולצמן מובאת בטבלה, אך לרוב משתמשים בווריאציה המתארת את התפלגות גודל המהירות בגז אידיאלי:
שימושים[עריכת קוד מקור | עריכה]
התפלגות מקסוול-בולצמן משמשת כבסיס לתיאור תופעות מקרוסקופיות של גז, כגון טמפרטורה, לחץ או דיפוזיה. ניתן להסיק את ההתפלגות תוך שימוש בכלים של מכניקה סטטיסטית, תחת ההנחות שהגז בנוי מכמות גדולה של חלקיקים כדוריים קשיחים שאינם משפיעים אחד על השני פרט להתנגשויות ביניהם, ובהזנחת אפקטים קוונטיים. הנחות אלו הן קירוב טוב להתנהגות של גזים אמיתיים בתנאים רגילים, שבהם הלחצים נמוכים והטמפרטורות נמוכות. ואכן, מדידות בתנאים רגילים מראות התאמה טובה מאוד של התפלגות המהירויות לצפי התאורטי.
התפלגויות נוספות[עריכת קוד מקור | עריכה]
עבור המהירות כוקטור, ההתפלגות היא:
- .
ניתן גם להסיק מתוך התפלגות מקסוול-בולצמן של המהירויות את התפלגות האנרגיה. בדוגמה שלהלן מובא חישוב עבור גז המכיל חלקיקים מסוג אחד בלבד, כך שלכל החלקיקים ישנה אותה מסה. אם ההסתברות למצוא מולקולה בטווח מהירויות עד היא:
ניתן להציב: וגם
כשאז יתקבל:
ראו גם[עריכת קוד מקור | עריכה]
| התפלגויות | ||
|---|---|---|
| התפלגויות בדידות כלליות | אחידה בדידה • בינומית • מולטינומית • בינומית שלילית • ברנולי • גאומטרית • היפרגאומטרית • היפרגאומטרית שלילית • מנוונת • פואסון |  |
| התפלגויות רציפות כלליות | אחידה רציפה • בטא • גמא • לוג-נורמלית • מעריכית (אקספוננציאלית) • נורמלית (גאוסית) • לפלס • משולשת • פארטו • ריילי • קושי • כי בריבוע | |
| התפלגויות בפיזיקה סטטיסטית | בולצמן • בוז-איינשטיין • מקסוול-בולצמן • פרמי-דיראק • זטא | |
| התפלגויות נוספות | התפלגות t • התפלגות F • ארלנג • וייבול • לוגיסטית | |
| סוגי התפלגויות | בדידה • רציפה • מותנית • נורמלית מוכללת • זנב עבה • לא פריקה • משותפת | |
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- התפלגות מקסוול-בולצמן, באתר אנציקלופדיה בריטניקה (באנגלית)
- התפלגות מקסוול-בולצמן, באתר MathWorld (באנגלית)
















![{\displaystyle f_{v}(v_{x},v_{y},v_{z})=\left({\frac {m}{2\pi k_{B}T}}\right)^{3/2}\exp \left[{\frac {-m(v_{x}^{2}+v_{y}^{2}+v_{z}^{2})}{2k_{B}T}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6df28f1c5acc373e603e6e8f94d991bd64035b99)





![{\displaystyle f_{E}\,dE=2{\sqrt {\frac {E}{\pi (kT)^{3}}}}~\exp \left[{\frac {-E}{kT}}\right]\,dE}](https://wikimedia.org/api/rest_v1/media/math/render/svg/46dd176523dd242991d5550e4901f102cd7748cd)