סרטן הריאה
 | |
| חתך של ריאה לאורכה, המראה כי היא נגועה בסרטן - קרצינומת תאי קשקש במקרה זה | |
| תחום |
אונקולוגיה |
|---|---|
| מיקום אנטומי |
ריאות האדם |
| גורם |
עישון טבק, רדון, זיהום אוויר, עישון פסיבי, אזבסטוזיס, עישון |
| גורמי סיכון |
עישון |
| תסמינים |
כאב חזה, ירידה במשקל, אנורקסיה, קוצר נשימה, עייפות, שיעול, גניחת דם, צפצופים |
| קישורים ומאגרי מידע | |
| eMedicine | article/280104 article/279960 |
| DiseasesDB | 7616 |
| MeSH | D002283 |
| MedlinePlus | 007194 |
| סיווגים | |
| ICD-10 | C33-C34 |
| ICD-11 |
2C25 |
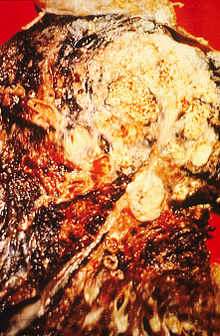
סרטן הריאה הוא אחד הגידולים הממאירים השכיחים ביותר ובין הגידולים הקטלניים ביותר בגברים ובנשים. המחלה מתגלה בדרך כלל בשלבים מתקדמים ולכן, סיכוי ההישרדות לחמש שנים הם נמוכים יחסית. סרטן הריאה הוא קבוצה של מחלות המחולקת באופן כללי לסרטן של תאים קטנים (באנגלית: small cell lung cancer; בראשי תיבות: SCLC) וסרטן של תאים שאינם קטנים (non small cell lung cancer; בראשי תיבות: NSCLC). הקבוצה האחרונה היא השכיחה יותר. קבוצת NSCLC כוללת שלושה סוגים עיקריים: סרטן קשקשי (squamous cell carcinoma), סרטן בלוטי (adenocarcinoma) וסרטן מתאים גדולים (large cell carcinoma). ישנם סוגים נוספים, נדירים יותר. בחולים רבים יש עירוב של יותר מסוג תאי אחד. במסגרת כל סוג היסטולוגי יש התמיינות לפי דרגת הבשלות של התאים, החל מתאים בשלים לחלוטין ועד לתאים חסרי התמיינות לחלוטין.
כתשעים אחוזים מכלל מקרי הסרטן של התאים שאינם קטנים וכמעט כל מקרי הסרטן של תאים קטנים קשורים לעישון עם תלות בגיל התחלת העישון וכמות העישון (כולל סיגריות, סיגרים, נרגילה ועישון פסיבי). קשר זה הוכח מעבר לכל ספק, הן במחקרים אפידמיולוגיים והן בניסויי מעבדה. הפסקת עישון מביאה לירידה בסיכון לפתח את המחלה. גורמים נוספים הקשורים לסיכון לפתח את המחלה הם חשיפה לאדי סולר,[1][2] סיבי אזבסט, גז רדון, קרינה מייננת, כרום, ניקל וחומרים נוספים.
אפידמיולוגיה[עריכת קוד מקור | עריכה]

סרטן הריאות היא מחלה של העידן המודרני, וכמעט לא תוארה טרם 1900 בספרות הרפואית. לאור העובדה שצריכת סיגריות וטבק עלתה מאוד במאה ה-20 ואשר מהווה גורם סיכון עיקרי לחלות בסרטן זה.
ברחבי העולם, סרטן הריאות מהווה כ-13% מכל סוגי הסרטן. יותר מ-1.1 מיליון מקרים של סרטן הריאות מאובחנים מדי שנה, ויותר ממיליון מקרי מוות נגרמים על ידה. בארצות הברית, 28% מכל מקרי מוות מסרטן בשנה (30% אצל גברים, 26% בנשים) הם כתוצאה מסרטן הריאות. סרטן הריאות הוא הגורם העיקרי למוות מסרטן הן בגברים והן בנשים.
השכיחות והתמותה מסרטן הריאות בגברים ונשים אמריקאים משקפים את הרגלי העישון שלהם. מקרי מוות מסרטן הריאות התחילו לעלות בגברים משנות ה-50 ובנשים 10–15 שנים מאוחר יותר. שיעורי תמותה מסרטן הריאות ירדו בקרב גברים ב-37% בין 1990 ל-2005; לעומת זאת, בקרב נשים, שיעור התמותה מסרטן הריאות בין 1991 ל-2005 גדל בכ - 8%. במדינות פחות מפותחות ברחבי העולם, עולה שיעור החולים בסרטן הריאות, כתוצאה מהגדלת שימוש אנדמי של טבק. התוכנית האמריקנית (Surveillance, Epidemiology and End Results (SEER העריכה כי 1 מ-14 גברים ונשים יהיו בסיכון לפתח סרטן הריאות במהלך חייהם.
שכיחות ושיעורי תמותה עשויים להשתנות לפי גזע/מוצא אתני. השכיחות של סרטן הריאות וכן שיעור התמותה אצל גברים אפרו-אמריקאים גבוהה יותר מכל קבוצה אתנית אחרת. שיעורי השכיחות של סרטן הריאות אצל גברים ונשים בארצות הברית בתקופה שבין 2002–2006 הם 77.7 ו-52.5 על כל 100,000 אנשים, בהתאמה. הגיל החציוני בעת האבחנה בשני המינים הוא 71 שנים. תופעת העישון אצל תלמידי תיכון עלתה עד אמצע 1990, אם כי נכון לעשור הראשון של המאה העשרים ואחת תופעה זו נמצאת בנסיגה. למרות ירידה זו, 38% מבוגרי התיכון בארצות הברית מעשנים. עישון בגיל צעיר יותר עשוי בחלקו להסביר את ההתרחשות של סרטן הריאות בחולים צעירים יותר.
בתחילת המאה ה-21 חלה עליה במספר החולים שמעולם לא עישנו, כאשר אחת מכל חמש נשים שאובחנה עם סרטן הריאות, וכן אחד מתוך 12 גברים, מעולם לא עישנו סיגריות. בארצות הברית, מהווה סרטן הריאות את הסיבה הנפוצה ביותר למוות כתוצאה מסרטן, הן אצל גברים והן אצל נשים. הסיכון לחלות הוא בגיל המבוגר, שכן מתחת לגיל 40 נדיר לפתח סרטן מסוג זה.
גורמי הסיכון לסרטן ריאות[עריכת קוד מקור | עריכה]
- עישון סיגריות, אך הפסקת עישון טרם גיל העמידה יכולה למנוע יותר מ-90% סיכון לפתח סרטן הריאה בהמשך. להפחתה בכמויות הסיגריות תועלת מועטה בלבד לעומת הפסקה מוחלטת של העישון.
- חשיפה לאבסבט או חומרי תעשייה מסוימים, או לגז הרדון
- חשיפה לקרינה מייננת
- מחלות ריאה קודמות כגון ברונכיטיס כרונית, אמפיזמה, שחפת - מקושרות לעליה בסיכון לסרטן הריאות.
- גנטיקה: נמצא כי קרובי משפחה מדרגה ראשונה של חולי סרטן הריאות הם בעלי סיכון של פי 2 עד 3 לפתח גם הם סרטן הריאות. על אף שזוהו מעט גנים יחסית הקשורים לעליה זו בסיכון, הרי שבעשור השני של המאה ה-21 ידוע כי התהליך הממאיר מתרחש בין היתר לאור פולימורפיזם גנטי ושבירות של כרומוזומים.
פתולוגיה[עריכת קוד מקור | עריכה]
סרטן הריאות כולל ארבעה תתי סוגים עיקריים המרכיבים כ-90% מכלל סוגי סרטן הריאות, והמסווגים על פי ארגון הבריאות העולמי (WHO):
- סרטן מסוג small cell lung cancer (בראשי תיבות SCLC) - סרטן זה מוגדר כגידול נוירואנדוקריני, אשר מתהווה כמסה מרכזית בתוך הסמפונות (קני הנשימה, או הברונכים - אנדוברונכיאלי) והמקושר באופן חזק לעישון. גידול זה נקרא כך היות שהוא מורכב מבחינה מיקרוסקופית מתאים קטנים בעלי מראה היסטולוגי אופייני. גידול זה נוטה יותר מן האחרים להפריש הורמונים שונים שיכולים להביא לתסמונת פארא-נאופלסטית - כגון הפרשה של ההורמון ACTH, הפרשת וואזופרסין, וכן ההורמונים ANF ו-GRP (gastrin-releasing peptide).
וכן שלושה סוגי סרטן הקרויים non-small cell lung cancer (בראשי תיבות ולהלן - NSCLC) והמחולקים ל:
- סרטן ריאה מסוג אדנוקרצינומה - נחשב לסרטן השכיח ביותר מבחינה היסטולוגית, ולרוב מתהווה באזורים פריפריים יותר בריאות. הוא אמנם קשור לעישון, אך מנגד זהו סוג הסרטן הנפוץ ביותר גם אצל אנשים שמעולם לא עישנו. ישנם תתי סוגים שונים לסוג סרטן זה. אחד מהם הוא קרצינומה ברונכי-אלוואולרית (BAC), הנקרא כך משום שהוא גדל לאורך נאדיות הריאה (אלוואולים).
- סרטן ריאה מסוג squamous cell carcinoma - מקושר לעישון, מתהווה במרכז הריאות לרוב וזהה מבחינה היסטולוגית ל-squamous cell carcinoma של איברים חוץ ריאתיים כגון ראש וצוואר.
- סרטן ריאה מסוג large cell carcinoma - לרוב מתהווה באזורים פריפריים בריאות ונקרא כך היות שהוא מכיל תאים ממאירים גדולים יחסית.
החלוקה העיקרית הזו, לסרטן מסוג SCLC ולסרטנים מסוג NSCLC, קיימת לצורך אמצעים טיפוליים ופרוגנוסטיים, מכיוון שקיים הבדל בין שתי קבוצות אלה. סרטן מסוג SCLC ("סרטן תאים קטנים של הריאה") נוטה להיות כבר מפושט מאוד בזמן האבחון, וגם כאשר הוא ממוקם יחסית, כמעט ולא ניתן לרפאו באמצעות ניתוח. לעומת זאת, סרטנים מסוג NSCLC ניתן לרפא על ידי ניתוח בכ-30% מן המקרים.
יתרת עשרת האחוזים של סרטני הריאה מורכבים מקרצינואידים, גידולים מוקואפידרמואידיים, קרצינומות לא ממוינות וגידולים אחרים.
תסמינים קליניים[עריכת קוד מקור | עריכה]
יותר ממחצית מן המטופלים המאובחנים לראשונה עם סרטן הריאות מגיעים לטיפול עם מחלה מתקדמת, כאשר החולה ה"קלאסי" הוא אדם מעשן או שעישן בעברו, לרוב בעשור השביעי של חייו. מספר תסמינים קליניים צריכים לעורר חשד שמדובר בסרטן ריאות:
- היסטוריה של שיעול כרוני (עם או ללא גניחת דם)
- קוצר נשימה
- ירידה במשקל – ירידה של מעל 10% במשקל מהווה גורם פרוגנוסטי רע.
- כאבים בחזה
- כאבי עצמות
- חום וחולשה, הזעות לילה
- התאלות של האצבעות
- דלקת ריאות עיקשת שאינה מגיבה לטיפול אנטיביוטי רגיל
בבדיקה גופנית של החולה ניתן לעיתים להתרשם מהגדלה של בלוטות לימפה, צרידות (אשר יכולה להעיד על superior vena cava syndrome (מחלה מתקדמת), רגישות על גבי עצמות, הגדלה של הכבד וממצאים נוירולוגיים.
ככלל, התסמינים הקליניים יכולים להיות מקושרים למיקום הגידול בריאה - כך למשל, מטופלים עם גידולים מרכזיים או אנדו-ברונכיאליים יכולים להופיע עם שיעול, גניחת דם, סטרידור, קוצר נשימה וסימנים של דלקת בדרכי הנשימה. מטופלים הסובלים מגידול באזורים פריפריים של הריאה יכולים לציין כאבים המערבים את בית החזה ואת הפלאורה העוטפת את הריאות וסימפטומים הדומים לאבצס ריאתי.
גידול המתפשט לתוך בית החזה יכול להביא לחסימת דרכי הנשימה, ללחץ על הוושט (המביא לדיספאגיה - קושי בבליעה) ולשיתוק של עצבים שונים - למשל, שיתוק עצב ה-recurrent laryngeal המתבטא בצרידות, שיתוק עצב הסרעפת המביא לעלית הסרעפת עם קוצר נשימה באותו אזור, או שיתוק עצבים סימפתטיים המביאים לתסמונת הורנר (המתבטאת בצניחת עפעף, התכווצות אישון, וחוסר הזעה באותו אזור בפנים - enophthalmos, ptosis, miosis, and anhidrosis).
התפשטות של הגידול לבסיס הריאה עלול להביא לתסמונת פאנקוסט- Pancoast syndrome (שלרוב מתרחשת יחד עם תסמונת הורנר) הנובעת מכך שיש מעורבות של קצות עצבים צוואריים ועצבי בית החזה, עם כאב בכתף שבאופן קלאסי מקרין לחלק האולנרי של הזרוע (ולרוב עם ממצאים רדיולוגיים המצביעים על הרס של הצלע הראשונה והשנייה).
תסמינים אחרים המעידים על התפשטות של הגידול יכולים לכלול מעורבות של הלב והפריקארד, חסימת דרכי לימפה וחסימת נאדיות הריאה המביאה לכשל נשימתי ותופעות נוספות, כאשר בחלק מן המקרים, בעיקר בסרטן מסוג SCLC אולם גם בשאר הסוגים, ישנה התפשטות של הגידול אל מחוץ לבית החזה- סרטן ריאות יכול להתפשט כמעט לכל רקמה בגוף ולשלוח גרורות למוח, לעצמות, לכבד, לטחול ולבלוטת האדרנל (אם כי פגיעה בתפקוד הכבד או בבלוטת האדרנל נדירה יחסית).
תסמונת פארא-נאופלסטית היא תסמונת הנפוצה אצל חולים עם סרטן הריאה, בעיקר חולים עם SCLC, כאשר תסמונות אלו יכולות להיות הסימן הראשון למחלה או לחזרת המחלה. סימנים אלו יכולים לכלול את הבאים:
- שחרור מוגבר של הורמון ה-PTH (ייצור אקטופי על ידי רקמת הגידול) המביא להיפרקלצמיה (כלומר יתר סידן בדם) ועלול להיות מסכן חיים, לרוב מצב זה מתקיים אצל חולים הסובלים מסרטן מסוג squamous cell carcinomas והתסמינים הקליניים כוללים בחילות, הקאות, כאבי בטן, עצירות, השתנה מוגברת וצימאון ולעיתים התדרדרות במצב המנטלי.
- היפונתרמיה כתוצאה מהפרשה לא תואמת של הורמון נוגד השתנה (SIADH) היא מאפיין נוסף של תסמונת פראנאופלסטית. מצב זה עובר לאחר התחלת טיפול כימותרפי (לרוב תוך שבוע עד ארבעה שבועות). היפונתרמיה יכולה להתרחש גם כתוצאה מהפרשת יתר של ANP (atrial natriuretic peptide) המביא להצטברות נוזלים וכתוצאה מכך לדילול הנתרן בדם. יש למדוד רמות של ANP בדם אם אין שיפור ברמות ההיפונתרמיה.
- הפרשה אקטופית של ההורמון ACTH (על ידי גידול מסוג SCLC וכן על ידי גידולים נדירים יותר מסוג קרצינואידים) לרוב מביאה להפרעות אלקטרוליטריות שונות, ביניהן היפוקלמיה (ופחות שינויים במבנה הגוף המתרחשים למשל בתסמונת קושינג המאופיינת אף היא בהפרשת יתר של ACTH).
תסמונות הקשורות לרקמת חיבור והקשורות לסרטן הריאה כוללות התאלות של האצבעות, וכן כאבי עצמות ופריאוזיטיס.
תסמונות נוירולוגיות הקשורות לסרטן הריאה אינן שכיחות (1%) וכוללות את תסמונת איטון-למברט (המתבטאת בין היתר בחולשת שרירים פרוקסימלית, לרוב בגפיים התחתונות המשתפרת בביצוע מאמץ) ונוירופתיה פריפרית כמו גם הפרעות נוירולוגיות נוספות. מרבית התסמונות הללו נגרמות בשל יצירת נוגדנים עצמיים וטיפול כימותרפי מביא לרוב להיעלמותן.
אבחנה[עריכת קוד מקור | עריכה]
אבחנה של סרטן הריאות נשענת על שילוב של ממצאים קליניים, ממצאים בהדמיה (כגון צילום חזה ו-CT) וכן ממצאים ציטולוגיים. הממצאים הציטולוגיים יכולים לעזור באבחנה בין מאפיינים נוירואנדוקריניים שונים בגידול, וכן האם הגידול הוא ראשוני או ממקור גרורתי (היות שגידולים רבים נוטים לשלוח גרורות לריאות).
איתור מוקדם[עריכת קוד מקור | עריכה]
מרבית החולים מתגלים בעת האבחנה עצמה ככאלה שבהם סרטן בשלב מתקדם. בדיקות סקר למחלה באוכלוסיה בסיכון גבוה (מעשנים כבדים או מעשנים כבדים בעבר הלא רחוק) מומלצת. בדיקת ct בקרינה נמוכה הוכחה במחקרים אקראיים מבוקרים כמגבירה גילוי מוקדם, מפחיתה תמותה מסרטן הריאה ומפחיתה תמותה כללית במעשנים כבדים כעת או בעבר ובגילאים שבין 55–70 וזו הומלצה כבדיקת סקר למעשנים על ידי ארגוני מומחים שונים, כולל בישראל. עם זאת, הבדיקה עדיין אינה בסל הטיפולים בישראל. אחת מהבעיות בביצוע CT היא איתור שגוי של סרטן ריאה, דהיינו שיעור גבוה של false-positive, המביא לסדרת בדיקות נוספות ולמתח רב המופעל על המטופל.
אם מתגלה במהלך ביצוע CT רגיל ממצא ריאתי ("נודול") שגודלו חשוד (בין 5–10 מ"מ), הגישה היא להעריך האם הוא נראה שפיר (הסתיידויות שפירות, או ללא שינוי בגודל במהלך השנתיים האחרונות - במקרים כאלו החולה ממשיך מעקב באופן רגיל ללא התערבויות נוספות) או לא. אם ממצא זה לא נראה שפיר, יש לבחון האם המטופל מקיים אחר גורמי סיכון לסרטן ריאות. אם לא קיימים גורמי סיכון, ניתן לבצע ניתוח VATS (תורקוסקופיה) ולהסיר את הגידול כמו גם לדגום בלוטת לימפה מבית החזה. כאשר ישנם גורמי סיכון לסרטן, אזי טרם הניתוח יש להעריך את הממצא הריאתי בהדמיות נוספות הכוללות FNA, ברונכוסקופיה ו-CT הכולל חומר ניגוד.
אבחנת סרטן ריאה[עריכת קוד מקור | עריכה]
אבחנת סרטן הריאה נעשית באופן סופי על ידי לקיחת ביופסיה (באמצעות ברונכוסקופיה, FNA, ושיטות נוספות כגון EUS - דגימה מונחית אולטרסאונד דרך הוושט למשל). אצל מטופלים עם בלוטות לימפה מוגדלות, ניתן לקחת FNA מבלוטת הלימפה, ואצל חולים עם מחלה מטסטטית ניתן לדגום ביופסיות מאיברים מעורבים כגון מח העצם, הכבד, עצמות ורקמות רכות המעורבות עם הגידול. FNA (fine needle aspiration, שיטה לדגימת רקמות) היא בעלת רגישות גבוהה יחסית מבחינה דיאגנוסטית לעומת שיטות דגימה אחרות (כגון צביעות, שטיפות וכדומה) מאחר שהיא מכילה כמות גדולה יחסית של תאי גידול, אולם לעיתים נדרשת ביופסיה נרחבת יותר, core-needle biopsy, על מנת לאבחן מוטציות שונות בגידול וכן אפיון היסטולוגי מדויק יותר. דגימות מכיח (Sputum cytology) מהוות שיטה נוספת לאבחנה. הן אינן יקרות ואינן פולשניות, אולם הן רגישות פחות (70% רגישות מבחינת אבחנה). עם זאת, ככל שנעשות יותר דגימות כאמור כך גדלה מידת הדיוק בהן ועל כן אנליזה של לפחות שלוש בדיקות כאלו מומלצת. על מנת למצוא את המוטציה בגן ה-EGFR או ה-ALK ולהתאים לה את טיפול ה-TKI המדויק משתמשים בבדיקה הנקראת FISH. לגילוי מוטציות ב-KRAS וב-BRAF משתמשים בבדיקה הנקראת TaqMan™.
טיפול בגידולי NSCLC[עריכת קוד מקור | עריכה]
טרם הטיפול בחולים עם NSCLC, יש לקבוע את שלב המחלה.
בסטייג'ינג (Staging) מוערך גודלו של הגידול, מוערך עירוב בלוטות הלימפה והתפשטות הגידול - על מנת לנסות ולקבוע דרכי טיפול ופרוגנוזה צפויה. על מנת להעריך את הסטייג'ינג עצמו יש ראשית להעריך פרמטרים אלו (נקרא גם "סטייג'ינג אנטומי") ושנית יש להעריך את יכולות של החולה לעמוד בטיפולים שונים, כמותרפיים, הקרנתיים וניתוחיים ("סטייג'ינג פיזיולוגי"). קביעת הסטייג'ינג הפיזיולוגי חיונית להחלטה על הטיפול, היות שרבים מן החולים סובלים ממחלות נוספות כגון מחלת ריאות חסימתית, מחלות לב וכדומה אשר עלולות להקשות על הליך הטיפול. למשל, מטופלים עם תפקוד ריאה ירוד לא יתאוששו היטב לאחר ניתוח הכולל הסרת אונת הריאה הפגועה (לובקטומי), כמו גם מטופלים אשר עברו אוטם שריר הלב טרם הניתוח ונמצאים בסיכון לאוטם מחודש (על כן, קיימת קונטרה-אינדיקציה לעבור את הניתוח אצל מטופלים שעברו אוטם לבבי עד 3 חודשים טרם הניתוח).
סטייג'ינג אנטומי קריטי לצורך קבלת ההחלטה על ניתוח (בגידולים מסוג NSCLC). על כל החולים עם סרטן מסוג NSCLC לעבור בדיקות הדמיה הכוללות PET-CT על מנת להדגים גרורות, אם ישנן, בשילוב עם ביופסיה (היות שייתכנו מצבים שהם False positive, או להפך). MRI יכול לסייע באבחנה של התפשטות הגידול למוח, אולם באופן כללי לא משחק תפקיד כמו שילוב של PET-CT לצורך הסטייג'ינג עצמו.
קיימות קונטרה-אינדיקציות לטיפול ניתוחי אצל חולים עם NSCLC – כלומר, במצבים מסוימים אין לפנות לניתוח לאור התפשטות המחלה. מצבים אלו כוללים בין היתר גרורות מחוץ לבית החזה, תסנינים פלאורליים, גידול אשר התפשט לריאה השנייה, גידול שהתפשט לבלוטות לימפה סופרה-קלוויקולריות ועוד.
אצל חולים ללא עדות למחלה גרורתית, יש לשקול ניתוח ולאחר מכן כימותרפיה בהתאם למעורבות בלוטות הלימפה במחלה, בין היתר, או לחלופין טיפול בכימותרפיה והקרנה בלבד.
בשלב הראשון של המחלה, הפרוגנוזה לאחר הניתוח למשך חמש שנים מוערכת להיות בין 60% ל-80% הישרדות, בעוד שבשלב 2 הפרוגנוזה הצפויה נעה בין 40% ל-50%. אצל חולה שאיננו מועמד לניתוח בשלבים הללו של המחלה (למשל, כתוצאה ממצב בריאותי מסוים) ניתן לנסות טיפול קרינתי (הקרנה) אולם עם תוצאות פחות טובות.
טיפול כימותרפי יכול להינתן אצל חולים הנמצאים בשלב 2 או 3 למטרות ריפוי, כאשר התרופה העיקרית היא ציספלטין והטיפול ניתן בחודש וחצי עד חודשיים לאחר הניתוח ולמשך ארבעה מחזורי טיפול. לאחר מכן, לאור סיכון לחזרת הסרטן אצל חולים אלו, מומלץ מעקב אשר כולל ביצוע CT כל חצי שנה במהלך השנתיים הראשונות ולאחר מכן אחת לשנה.
אצל חולים עם מחלה גרורתית בעת האבחנה (כשני שלישים מהחולים) ההישרדות החציונית ללא כל טיפול עומדת על מספר חודשים בלבד (4–5 חודשים). הטיפול בחולים אלו הוא טיפול תומך (פליאטיבי) אשר מאריך את תוחלת החיים ומשפר את איכות החיים. הטיפול הניתן הוא כימותרפיה, כש"טיפול קו ראשון" הוא מתן מישלב המבוסס על ציספלטין. אצל חולים עם סרטן הריאה גרורתי מסוג התאים הלא קטנים - קשקשי שלא הגיבו לכימותרפיה, אישר ה FDA תרופה אימונולוגית בשם OPDIVO אשר מסוגלת להאריך את חייהם במספר חודשים וכן לשפר את איכות החיים. אצל חולים עם סרטן ריאה גרורתי מסוג התאים הלא קטנים עם מוטציות ב-EGFR אישר ה-FDA תרופה ביולוגית בשם GIOTRIF כתחליף לכימותרפיה בקו טיפול ראשון. תרופה זו עשויה להאריך את חיי החולים בכשנה במיוחד בחולים עם DEL19. לחולים עם מוטציה ב-ALK אישר ה-FDA תרופה בשם XALKORI אשר אינה מאריכה את תוחלת החיים אבל עוצרת את קצב התקדמות המחלה למספר חודשים. לחולים בשלב מתקדם שכימותרפיה והקרנות לא עזרו להם ואשר הגידול נמצא באזור הסימפונות ומפריע לנשימה אישר ה-FDA תרופה פוטודינמית בשם PHOTOFRIN אשר בשילוב קרני לייזר מסוגלת לכווץ גידולים באזורים הניתנים לגישה ברונכוסקופית. לקראת סוף 2015 יסתיים גיוס חולים עם מוטציות בKRAS למחקר בשימוש בתרופה SELUMATINIB אשר אמורה להשפיע לחיוב על גידולים מסוג זה.
טיפול בגידולים מסוג SCLC[עריכת קוד מקור | עריכה]
אצל חולים עם גידולים מסוג SCLC, הטיפול העיקרי הוא כימותרפיה, הקרנה או שילוב של השניים. ביצוע סטייג'ינג במחלה זו כולל CT של חזה ובטן, MRI של המוח ומיפוי עצמות אם נראה כי המחלה מערבת את העצמות. (קיים מידע מוגבל נכון להיום לגבי בדיקות מסוג PET-CT בסטייג'ינג של SCLC). כאשר אין סימנים למחלה גרורתית, יש לשקול טיפול משולב בכימותרפיה וקרינה (אלא אם כן המטופל לא מסוגל לקבל את הטיפול המשולב. במקרה כאמור יינתן טיפול בשלבים: ראשית כימותרפיה ולאחר מכן קרינה למשל). משיש סימנים למחלה גרורתית, יינתן טיפול פליאטיבי (שמטרתו הקלה על הסימפטומים) בקרינה או בכימותרפיה (ללא טיפול משולב).
מערכת ביצוע הסטייג'ינג לחולים עם SCLC שונה מאשר חולים עם NSCLC, וכוללת שתי אבחנות עיקריות - האם לחולה יש מחלה מוגבלת יחסית - limited-stage disease (כלומר מוגבלת לחצי מבית החזה בלבד) או מחלה מפושטת יותר, Extensive-Stage Disease. כ-60% עד 70% מן המטופלים מאובחנים עם הגעתם עם מחלה מפושטת בסוג סרטן זה.
מאחר שמדובר במחלה אגרסיבית יחסית, המאופיינת בגדילה מהירה של הגידול והתפשטות מהירה שלו, הרי שמנגד התגובה לכמותרפיה ולקרינה דרמטית. ניתוח אינו מבוצע באופן שגרתי אצל חולים אלו, גם עם מחלה מוגבלת, לאור הסבירות הגבוהה לקיומן של מיקרו-גרורות.
הטיפול הנחשב כ"טיפול קו ראשון" למחלה הוא כימותרפיה במישלב הכולל ציספלטין (או קרבופלטין) יחד עם אטופסיד (etoposide) למשך 4-6 מחזורי טיפול. שיעורי התגובה הם עד 80% וההישרדות החציונית נעה מ-12-20 חודשים לחולים עם מחלה מוגבלת ו-7–11 חודשים לחולים עם מחלה מפושטת. מרבית החולים, עם זאת, מפתחים עמידות לטיפול הכימותרפי ומעטים מאוד שורדים לאחר חמש שנים (אחוזים בודדים), הן במחלה מוגבלת והן במחלה מפושטת.
בנוסף לטיפול הכימותרפי, ניתן טיפול בקרינה כאשר התוצאות טובות יותר כאשר הטיפול הוא משולב (כלומר, כימותרפיה תוך כדי הקרנות) אולם טיפול משולב גורם לתופעות לוואי גדולות יותר (כגון, אסופגיטיס וטוקסיות לריאות) ועל כן יש לבחור את המטופלים בקפידה לעניין יכולתם לעמוד בטיפול משולב זה. קרינה פרופילקטית למוח מומלצת אף היא כדי למנוע שליחת גרורות.
טיפול מולקולרי[עריכת קוד מקור | עריכה]
בעשור השני של המאה ה-21 נעשים מחקרים רבים להתאמת הטיפול הנכון לחולה בהתאם למאפיינים שנמצאו בגידול עצמו, בהתאם למאפיינים מולקולריים. כך למשל, מטופלים המציגים מוטציות בגן EGFR (שנמצא יותר באדנוקרצינומות, יותר אצל נשים ואצל כאלו שמעולם לא עישנו) גורמות להפעלה של הרצפטור טירוזין קינאז ומכאן שטיפול בתרופות המעכבות טירוזין קינאז (כגון ארלוטיניב או ג'פיטיניב) יכולות להועיל במקרים אלו. עם זאת, נמצא כי כמעט כל החולים שהגיבו לטיפול האמור פיתחו עמידות לתרופה לאחר מכן ולכן קיימים ניסיונות לפתח תרופות המתמודדות עם המוטציות החדשות שנוצרו לאור העמידות הזו. מוטציות אחרות הראו תגובות לתרופות הפועלות עליהן ובאופן כללי קיימת מגמה לכיוון פיתוח תרופות המתמודדות עם מוטציות כאמור והבנת הפרופיל הפנוטיפי של הגידול. עבור חולים עם מוטציה ב-EGFR אשר הגידול שלהם עבר מוטציה נוספת T790M ופיתח עמידות ל - טרסיווה, אירסה או ג'ילוטריף מפתחת אסטרה זנקה תרופה בשם AZD9291.
טיפול אימונותרפי[עריכת קוד מקור | עריכה]
המילה האחרונה בטיפול בסרטן הריאה היא התרופות האימונותרפיות. כיום מאושרות שלוש תרופות כאלו על ידי ה-FDA מתוכן רק אחת לטיפול בשני סוגים של סרטן ריאה: אדנוקרצינומה ו-Squamous NSCLC. התרופות במקור היו מיועדות לטיפול במלנומה אך התגלה כי הן טובות גם לטיפול בסרטן הריאה. התרופות הן: OPDIVO, YERVOY ו-KEYTRUDA. שיטת הפעולה של שלוש התרופות זהה והיא מניעת המפגש בין מולקולת ה-PD-1 והקולטן PDL-1. מתוכן אישר ה-FDA רק את אופדיבו לטיפול בסרטן ריאה שלא הגיב לטיפול בכימותרפיה והקרנות. התרופות בינתיים מסוגלות להאריך את חיי החולים במספר חודשים בלבד אולם לשפר את איכות חייהם ולספק תקופה של נסיגה או אי התקדמות בת עד כ-9 חודשים. הביקורת על תרופות אלו על ידי איגוד האונקולוגים בארצות הברית הוא עלותן (עד 13,000 דולר לחודש לטיפול) וחברות הביטוח בחלקן אינן מכסות את עלות הטיפול.
ראו גם[עריכת קוד מקור | עריכה]
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- הערך "סרטן ריאה - Lung Cancer", באתר ויקירפואה
- העמותה הישראלית לסרטן ריאה
- ריכוז מחקרים בנושא סרטן הריאה, באתר "מחקרים"
 ניר פלד, לא רק מעשנים: הגורמים שמעלים את הסיכון לסרטן הריאה , באתר הארץ, 1 בנובמבר 2015
ניר פלד, לא רק מעשנים: הגורמים שמעלים את הסיכון לסרטן הריאה , באתר הארץ, 1 בנובמבר 2015- ד"ר יאיר בר, טיפולים לסרטן ריאה מתקדם, באתר ynet, 19 בנובמבר 2017
- פרופסור אורן פרוכטר על סרטן הראיה
- סרטן הריאה, באתר אנציקלופדיה בריטניקה (באנגלית)
 ריאות - סרטן, דף שער בספרייה הלאומית
ריאות - סרטן, דף שער בספרייה הלאומית
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ Heavy exposure to diesel exhaust linked to lung cancer death in miners, באתר האינטרנט של "מרכז הסרטן הלאומי", מרץ 2012
The Diesel Exhaust in Miners Study: A Nested Case–Control Study of Lung Cancer and Diesel Exhaust, אוקטובר 2011 - ^ "הסוכנות הבינלאומית למחקר על סרטן" של ארגון הבריאות העולמי, IARC: DIESEL ENGINE EXHAUST CARCINOGENIC, 12 ביוני 2012
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
