חיסון mRNA

חיסון mRNA הוא חיסון המשתמש בעותק של מולקולה הנקראת RNA שליח (mRNA) כדי לייצר תגובה חיסונית.[1] החיסון מספק מולקולות של mRNA שמקודד לאנטיגן לתאי מערכת החיסון, המשתמשים ב-mRNA המעוצב כשרטוט לבניית חלבון זר שבדרך כלל מיוצר על ידי פתוגן (כגון נגיף) או על ידי תא סרטני. מולקולות חלבון אלו מעוררות תגובה חיסונית נרכשת המלמדת את הגוף לזהות ולהרוס את הפתוגן או התאים הסרטניים התואמים. ה-mRNA מוכנס על ידי נוסחה משותפת של RNA מוקף בננו-חלקיקים שומניים מוצקים המגנים על גדילי ה-RNA ומסייעים לספיגתם בתאים.[2][3]
ריאקטוגניות, הנטייה של חיסון לייצר תגובות שליליות, דומה לזו של חיסונים רגילים שאינם RNA.[4] לאנשים הרגישים לתגובה אוטואימונית עשויה להיות תגובה שלילית לחיסוני RNA שליח. היתרונות של חיסוני mRNA על פני חיסונים מסורתיים הם קלות התכנון, מהירות ועלות הייצור הנמוכה יותר, השראת חסינות הומורלית וגם חסינות תאית וחוסר אינטראקציה עם ה־DNA הגנומי.[5][6] לחלק מחיסוני RNA שליח, כמו חיסון Pfizer–BioNTech COVID-19, יש החיסרון של צורך באחסון אולטרה-קר לפני ההפצה,[1] אך חיסוני mRNA אחרים, כגון חיסוני Moderna, CureVac ו-Walvax COVID-19, אינם דורשים זאת.[7][8]
בטיפולי RNA, חיסוני RNA שליח משכו עניין רב כמו חיסוני COVID-19.[1] בדצמבר 2020, פייזר-BioNTech ומודרנה קיבלו אישור לחיסוני COVID-19 מבוססי mRNA. ב-2 בדצמבר, סוכנות הפיקוח על תרופות ומוצרי בריאות בבריטניה (MHRA) הפכה לרגולטור התרופות הראשון שאישר חיסון mRNA, ואישר את החיסון Pfizer-BioNTech לשימוש נרחב.[9][10][11] ב-11 בדצמבר, מינהל המזון והתרופות האמריקני (FDA) הוציא אישור לשימוש חירום לחיסון Pfizer-BioNTech[12][13] ושבוע לאחר מכן אישר באופן דומה את חיסון Moderna.[14][15] פרס נובל לפיזיולוגיה או רפואה לשנת 2023 הוענק לקטלין קריקו ודרו וייסמן על פיתוח חיסוני mRNA יעילים נגד COVID-19.[16][17][18]
היסטוריה[עריכת קוד מקור | עריכה]
מחקר מוקדם[עריכת קוד מקור | עריכה]
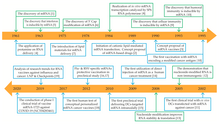
ההעברה המוצלחת הראשונה של mRNA מעוצב ארוז בתוך ננו -חלקיק ליפוזומלי לתוך תא פורסמה בשנת 1989.[19][20] mRNA "עירום" (או לא מוגן) מתוצרת מעבדה הוזרק שנה לאחר מכן לשריר של עכברים.[3][21] מחקרים אלו היו ההוכחה הראשונה לכך ש-mRNA שמשועתק במבחנה עם גן נבחר יכול לספק את המידע הגנטי לייצור חלבון רצוי בתוך רקמת תא חי והובילו להצעת הרעיון של חיסוני RNA שליח.[22][23][24]
ב-1993 הוכח ש-mRNA מכוסה בליפוזום ומקודד לאנטיגן ויראלי ממריץ תאי T בעכברים.[25][26] בשנה שלאחר מכן פותח mRNA מגביר עצמי על ידי הכללת אנטיגן ויראלי וגם גן המקודד רפליקאז.[25][27] השיטה שימשה בעכברים כדי לעורר גם תגובה חיסונית תאית וגם תגובה חיסונית הומורלית נגד פתוגן ויראלי.[25] בשנה שלאחר מכן הוכח כי mRNA המקודד לאנטיגן גידולי מעורר תגובה חיסונית דומה נגד תאי סרטן בעכברים.[28][29]
התפתחות[עריכת קוד מקור | עריכה]
הניסוי הקליני הראשון בבני אדם באמצעות תאים דנדריטים מחוץ לגוף, ex vivo, שהועברו עם mRNA המקודדים אנטיגנים גידוליים (חיסון mRNA טיפולי לסרטן) החל בשנת 2001.[30][31] ארבע שנים מאוחר יותר, דווח על שימוש מוצלח בנוקלאוזידים שעברו שינוי כשיטה להובלת mRNA בתוך תאים מבלי להפעיל את מערכת ההגנה של הגוף.[30][32] תוצאות ניסויים קליניים של חיסון mRNA המוזרק ישירות לגוף נגד תאים סרטניים דווחו בשנת 2008.[33][34]
BioNTech ב-2008, ומודרנה ב-2010, נוסדו כדי לפתח טכנולוגיות ביו-mRNA.[35][36] סוכנות המחקר האמריקאית DARPA השיקה בשלב זה את תוכנית מחקר הביוטכנולוגיה ADEPT לפיתוח טכנולוגיות מתפתחות עבור צבא ארצות הברית.[37][38] הסוכנות זיהתה את הפוטנציאל של טכנולוגיית חומצות גרעין להגנה מפני מגיפות והחלה להשקיע בתחום.[37] מענקי DARPA נתפסו כהצבעת אמון ועודדו סוכנויות ממשלתיות אחרות ומשקיעים פרטיים להשקיע בטכנולוגיית mRNA.[38] DARPA העניק 25 מיליון דולר למודרנה.[39]
הניסויים הקליניים הראשונים בבני אדם באמצעות חיסון mRNA נגד גורם זיהומי (כלבת) החלו בשנת 2013.[40][41] במהלך השנים הבאות, החלו ניסויים קליניים של חיסוני mRNA למספר וירוסים אחרים. חיסוני mRNA לשימוש אנושי נחקרו עבור גורמים זיהומיים כגון שפעת,[42] וירוס זיקה, ציטומגלווירוס, וירוס צ'יקונגוניה.[43][44]
במרץ 2022 הודיעה מודרנה על פיתוח חיסוני mRNA ל-15 מחלות: וירוס צ'יקונגוניה, COVID-19, קדחת דימום קרים-קונגו, קדחת דנגי, אבולה, HIV, מלריה, מחלת וירוס מרבורג, קדחת לסה, וירוס קורונה הגורם לתסמונת נשימתית במזרח התיכון (MERS-CoV), מחלות ניפה ו-henipavirus, קדחת השבר הסורי-אפריקני, חום חמור עם תסמונת טרומבוציטופניה, שחפת וזיקה.[45][46]
תאוצה[עריכת קוד מקור | עריכה]
מגפת COVID-19 וריצוף של הנגיף המחולל SARS-CoV-2 בתחילת 2020, הובילו לפיתוח מהיר של חיסוני ה-mRNA הראשונים שאושרו.[47][48] BioNTech ומודרנה קיבלו בדצמבר אותה שנה אישור לחיסוני COVID-19 מבוססי mRNA. ב-2 בדצמבר, שבעה ימים לאחר הניסוי האחרון שנמשך שמונה שבועות, הפכה סוכנות הפיקוח לתרופות ומוצרי בריאות בבריטניה (MHRA) לרגולטור התרופות העולמי הראשון שאישר חיסון mRNA, והעניק אישור חירום ל-BNT162b2 COVID-19 של פייזר-BioNTech. חיסון לשימוש נרחב.[9][10][49] ב-11 בדצמבר, ה-FDA נתן אישור לשימוש חירום לחיסון Pfizer-BioNTech COVID-19 ושבוע לאחר מכן אישור דומה לחיסון Moderna COVID-19.[50] נמשך פיתוח של חיסוני mRNA אחרים.
מנגנון[עריכת קוד מקור | עריכה]

המטרה של חיסון היא לעורר את מערכת החיסון המסתגלת ליצור נוגדנים המכוונים בדיוק לאותו פתוגן מסוים. הסמנים על הפתוגן שהנוגדנים מכוונים אליהם נקראים אנטיגנים.[51]
חיסונים מסורתיים מעוררים תגובת נוגדנים על ידי הזרקה לגוף של אנטיגנים, וירוס מוחלש, וירוס מומת, או וקטור ויראלי המקודד לאנטיגן רקומביננטי (וירוס נשא לא מזיק עם טרנסגן אנטיגן). אנטיגנים ווירוסים אלה מוכנים וגדלים מחוץ לגוף.
לעומת זאת, בחיסוני mRNA מכניסים לאדם המתחסן קטע קצר מועד[52] שנוצר באופן סינתטי של רצף ה-RNA של נגיף כלשהו. שברי mRNA אלה נקלטים על ידי תאים דנדריטים באמצעות פגוציטוסיס.[53] התאים הדנדריטים משתמשים בריבוזומים כדי לקרוא את ה-mRNA ולייצר את האנטיגנים הנגיפיים שה-mRNA מקודד.[4] הגוף מפרק את שברי ה-mRNA תוך מספר ימים מההחדרה.[54] תאים לא חיסוניים יכולים לספוג mRNA של חיסון, לייצר אנטיגנים ולהציג את האנטיגנים על פני השטח שלהם, אך תאים דנדריטים סופגים את כדוריות ה-mRNA הרבה יותר בקלות.[55] שברי ה-mRNA עוברים שעתוק בציטופלזמה ואינם משפיעים על ה-DNA הגנומי של הגוף, הממוקם בנפרד בגרעין התא.[1][56]
ברגע שהאנטיגנים הנגיפיים מיוצרים על ידי התא המארח, קורים תהליכי מערכת החיסון הנרכשת. אנטיגנים מתפרקים על ידי פרוטאזומים. לאחר מכן מולקולות MHC Class I ו-Class II נצמדות לאנטיגן ומעבירות אותו אל הממברנה התאית, וכך "מופעל" התא הדנדריטי.[56] לאחר ההפעלה, תאים דנדריטים נודדים לקשרי לימפה, שם הם מציגים את האנטיגן לתאי T ותאי B.[57] תהליך זה מפעיל ייצור נוגדנים המכוונים ספציפית לאנטיגן, וכתוצאה מכך לחסינות.[51]
mRNA[עריכת קוד מקור | עריכה]

המרכיב המרכזי של חיסון mRNA הוא מבנה ה-mRNA שלו.[58] ה-mRNA המשועתק במבחנה נוצר מ-DNA פלסמיד מהונדס, בעל מקדם RNA פולימראז ורצף התואם למבנה ה-mRNA. על ידי שילוב T7 phage RNA פולימראז ו-DNA פלסמיד, ניתן לשעתק את ה-mRNA במעבדה. יעילות החיסון תלויה ביציבות ובמבנה של ה-mRNA המתוכנן.[4]
ל-mRNA המתועתק במבחנה יש אותם מרכיבים מבניים כמו ל-mRNA טבעי בתאים איקריוטיים. יש לו Cap '5, אזור 5' - לא משועתק (UTR) ו-3'-UTR, מסגרת קריאה פתוחה (ORF), המקודדת את האנטיגן הרלוונטי, וזנב 3'-poly(A). על ידי שינוי מרכיבים אלה של ה-mRNA הסינתטי, ניתן לשפר את היציבות ויכולת התרגום של ה-mRNA, וכך לשפר את יעילות החיסון.[58]
ניתן לשפר את ה-mRNA על ידי שימוש באנלוגים סינתטיים של 5'-cap אשר משפרים את היציבות ומגבירים את תרגום החלבון. באופן דומה, ניתן לשנות אלמנטים רגולטוריים באזור ה-5'-לא-מתורגם ובאזור ה-3'-לא-מתורגם, ולבצע אופטימיזציה של אורך זנב ה-poly(A), כדי לייצב את ה-mRNA ולהגביר את ייצור החלבון. ניתן לשנות את נוקלאוטידי ה-mRNA כדי להפחית את ההפעלה של מערכת החיסון המולדת וגם להגדיל את זמן מחצית החיים של ה-mRNA בתא המארח. רצף חומצות הגרעין והשימוש בקודונים משפיעים על תרגום החלבון. העשרת הרצף בתכולת גואנין-ציטוזין משפרת את יציבות ה-mRNA ואת זמן מחצית החיים, וכך את ייצור החלבון. החלפת קודונים נדירים בקודונים נרדפים המשמשים לעיתים קרובות את התא המארח משפרת גם היא את ייצור החלבון.[4]
העברה[עריכת קוד מקור | עריכה]

כדי שחיסון יצליח, מספיק mRNA חייב להיכנס לציטופלזמה של התא המארח כדי לעורר ייצור של האנטיגנים הספציפיים. אולם כניסה של מולקולות mRNA מתמודדת עם מספר קשיים. לא רק מולקולות mRNA גדולות מכדי לחצות את קרום התא על ידי דיפוזיה פשוטה, הן גם טעונות שלילי כמו קרום התא, מה שגורם לדחייה אלקטרוסטטית הדדית. בנוסף, mRNA מתכלה בקלות על ידי RNase בעור ובדם.[56]
פותחו שיטות שונות כדי להתגבר על מכשולים אלו. ניתן לסווג את שיטת מתן החיסון לפי העברת mRNA לתאים - האם היא מתרחשת בתוך (in vivo) האורגניזם או מחוץ לו (ex vivo).[56][3]
Ex vivo[עריכת קוד מקור | עריכה]
תאים דנדריטים מציגים אנטיגנים על פני השטח שלהם, מה שמוביל לאינטראקציות עם תאי T כדי ליזום תגובה חיסונית. ניתן לאסוף תאים דנדריטים ממטופלים ולתכנת אותם עם ה-mRNA הרצוי, ואז לתת בחזרה לחולים כדי ליצור תגובה חיסונית.[59]
הדרך הפשוטה ביותר שבה תאים דנדריטים ex vivo קולטים מולקולות mRNA היא באמצעות אנדוציטוזה, מסלול די לא יעיל במעבדה שניתן לשפר משמעותית באמצעות אלקטרופורציה.[56]
In vivo[עריכת קוד מקור | עריכה]
מאז הגילוי כי מתן ישיר של mRNA משועתק במבחנה מוביל לביטוי של אנטיגנים בגוף, נחקרו גישות in vivo.[21] הן מציעות כמה יתרונות על פני שיטות ex vivo, במיוחד על ידי הימנעות מהעלות של קציר והתאמת תאים דנדריטים מחולים ועל ידי חיקוי זיהום רגיל.[56]
מסלולי הזרקה שונים, כגון לתוך העור, הדם או השרירים, מביאים לרמות שונות של ספיגת mRNA, מה שהופך את בחירת הנתיב להיבט קריטי של הכנסת mRNA בפורמט של in vivo. מחקר אחד הראה, בהשוואת מסלולים שונים, שהזרקה לקשרי לימפה מובילה לתגובה הגדולה ביותר של תאי T.[60]
הזרקת mRNA עירום[עריכת קוד מקור | עריכה]
הזרקת mRNA עירום פירושה שמתן החיסון נעשה רק בתמיסת חיץ.[61] אופן קליטת mRNA זה ידוע מאז שנות ה-90.[21] המחקרים הקליניים הראשונים השתמשו בהזרקות תוך עוריות של mRNA עירום לשם חיסון.[62][63] נעשה שימוש במגוון שיטות למתן mRNA עירום, כגון זריקות תת-עוריות, תוך ורידיות ותוך גידוליות. העברת mRNA עירומה גורמת לתגובה חיסונית, אך ההשפעה חלשה יחסית, ולאחר הזרקה ה-mRNA לרוב מתכלה במהירות.[56]
וקטורים של פולימרים ופפטידים[עריכת קוד מקור | עריכה]
ניתן לערבב פולימרים קטיוניים (ביון חיובי, קַטְיוֹן, יש יותר פרוטונים מאלקטרונים) עם mRNA כדי ליצור ציפויים מגנים הנקראים פוליפלקסים. אלה מגנים על ה-mRNA הרקומביננטי מפני האנזימים שהם ריבונוקלאזות ומסייעים לחדירתו לתאים. פרוטמין הוא פפטיד קטיוני טבעי והוא שימש לעטוף mRNA לחיסון.[64][65]
וקטור ננו-חלקיקי ליפידי[עריכת קוד מקור | עריכה]

ה-FDA אישר את השימוש בננו-חלקיקים שומניים מוצקים כמערכת למתן תרופות ב-2018, כאשר הסוכנות אישרה את תרופת ה־SiRNA הראשונה, Onpattro.[66] כינוס מולקולת ה-mRNA בננו-חלקיקים שומניים מוצקים היו פריצת דרך קריטית לייצור חיסוני mRNA בר-קיימא, ופתרו מספר מחסומים טכניים מרכזיים בהעברת מולקולת ה-mRNA לתא המארח.[66][67] מחקר בשימוש בשומנים להעברת siRNA לתאים הפך לבסיס למחקר דומה בשימוש בשומנים להעברת mRNA.[68] עם זאת, היה צורך להמציא שומנים חדשים כדי ליצור כמוסות של גדילי mRNA, שהם הרבה יותר ארוכים מגדילי siRNA.[68]
הליפיד מספק שכבת הגנה מפני התפוררות, המאפשר פלט שעתוק חזק יותר. בנוסף, ההתאמה האישית של השכבה החיצונית של הליפיד מאפשרת מיקוד של סוגי תאים רצויים באמצעות אינטראקציות ליגנד. עם זאת, מחקרים רבים הדגישו גם את הקושי לחקור סוג זה של העברה, והוכיחו כי קיים חוסר עקביות בין יישומים in vivo ו-in vitro של ננו-חלקיקים בהכנסה לתא.[69] ניתן להכניס את הננו-חלקיקים לגוף ולהעביר אותם בדרכים מרובות, כגון בעירוי תוך ורידי או דרך מערכת הלימפה.[66]
בעיה אחת עם ננו-חלקיקי שומנים היא שכמה מפריצות הדרך המובילות לשימוש מעשי בטכנולוגיה זו כרוכות בשימוש במיקרו-נוזלים. קשה להגדיל תאי תגובה מיקרו-נוזליים, מכיוון שכל המטרה של מיקרופלואידיקה היא לנצל את ההתנהגויות בקנה מידה קטן של נוזלים. הדרך היחידה לעקוף את המכשול הזה היא להפעיל מספר רב של תאי תגובה מיקרופלואידיים במקביל, משימה חדשה הדורשת ציוד בנוי בהתאמה אישית.[70][71] עבור חיסוני mRNA COVID-19, זה היה צוואר הבקבוק העיקרי בייצור. פייזר השתמשה בגישה מקבילה כזו כדי לפתור את בעיית קנה המידה. לאחר שמצאה כי לא ניתן להגדיל את ההזרקה באופן ישיר,[72] פייזר ייצרה כ-100 מהמזרקים הקטנים (כל אחד בערך בגודל של מטבע של חצי דולר אמריקאי), חיברה אותם במשאבות ומסננים ב"מבוך של צנרת,"[73][74] והקימה מערכת מחשב לוויסות זרימה ולחץ דרכם.[72]
בעיה נוספת בשימוש בקנה מידה גדול בשיטת הכנסה זו, היא הזמינות של השומנים החדשים המשמשים ליצירת ננו-חלקיקים שומניים, במיוחד שומנים קטיוניים הניתנים למינון. לפני 2020, שומנים כאלה יוצרו בכמויות קטנות שנמדדו בגרמים או קילוגרמים, ושימשו למחקר רפואי ולקומץ תרופות למצבים נדירים. כאשר הבטיחות והיעילות של חיסוני mRNA התבררו בשנת 2020, החברות הבודדות שהצליחו לייצר את השומנים הנדרשים התמודדו עם האתגר של הגדלת הייצור כדי להגיב להזמנות של כמה טונות של שומנים.[71][75]
וקטור ויראלי[עריכת קוד מקור | עריכה]
בנוסף לשיטות מסירה לא-ויראליות, נגיפי RNA הונדסו כדי להשיג תגובות אימונולוגיות דומות. נגיפי RNA טיפוסיים המשמשים כווקטורים כוללים רטרו-וירוסים, לנטי-וירוסים, אלפא-וירוסים ורבדו-וירוסים (rhabdoviruses), שכל אחד מהם יכול להיות שונה במבנה ובתפקוד.[76] מחקרים קליניים השתמשו בווירוסים כאלה על מגוון מחלות בחיות מודל כגון עכברים, עוף ופרימטים.[77][78][79]
יתרונות[עריכת קוד מקור | עריכה]
חיסונים מסורתיים[עריכת קוד מקור | עריכה]
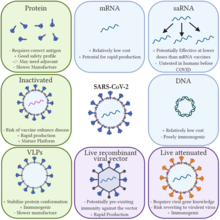
חיסוני mRNA מציעים יתרונות על פני חיסונים מסורתיים.[4][5] הם לא בנויים מפתוגן פעיל או מומת ולכן אינם מדבקים. חיסונים מסורתיים דורשים ייצור פתוגנים, שאם נעשה בכמויות גבוהות, עלול להגביר את הסיכון להתפרצויות מקומיות של הנגיף במתקן הייצור. יתרון ביולוגי נוסף של חיסוני mRNA הוא שמכיוון שהאנטיגנים מיוצרים בתוך התא, הם מעוררים חסינות תאית, כמו גם חסינות הומורלית.[6][80]
לחיסוני mRNA יש יתרון בייצור: ניתן לעצב אותם במהירות. Moderna עיצבה את חיסון ה-mRNA-1273 ל-COVID-19 תוך יומיים.[81] ניתן לייצר אותם מהר יותר, זול יותר ובאופן סטנדרטי יותר (עם פחות שיעורי שגיאות בייצור), מה שיכול לשפר את ההיענות להתפרצויות חמורות.[4][5]
לחיסון ה-Pfizer–BioNTech נדרשו במקור 110 ימים לייצור המוני (לפני שפייזר החלה לייעל את תהליך הייצור וקיצרה אותו ל-60 יום בלבד). ייצור זה היה מהיר יותר באופן משמעותי מייצור חיסוני שפעת ופוליו מסורתיים.[73] בתוך מסגרת זמן גדולה יותר, זמן הייצור בפועל הוא כ-22 ימים: שבועיים לשיבוט מולקולרי של פלסמידים של DNA וטיהור של DNA, ארבעה ימים לשעתוק DNA-ל-RNA וטיהור של mRNA, וארבעה ימים להכנסת mRNA לננו-חלקיקי ליפידים ואז מילוי וגימור.[82] רוב הימים הדרושים לייצור מוקצים לבקרת איכות קפדנית בכל שלב.
חיסוני DNA[עריכת קוד מקור | עריכה]
בנוסף ליתרונות של חיסוני DNA תאורטיים על פני חיסונים מסורתיים מבוססים, לחיסוני mRNA יש יתרונות נוספים על פני חיסוני DNA. ה-mRNA מתורגם בציטוזול, כך שאין צורך שה-RNA ייכנס לגרעין התא, והסיכון להשתלב בגנום המארח נמנע.[3] ניתן לשלב נוקלאוזידים שעברו שינוי (לדוגמה pseudouridines, 2'-O-methylated nucleosides) ב-mRNA כדי לדכא גירוי תגובה חיסונית כדי למנוע דיכוי מערכת החיסון ולייצר אפקט מתמשך יותר באמצעות יכולת שעתוק משופרת.[83][84][85] ניתן לייעל את מסגרת הקריאה הפתוחה (ORF) ואת האזורים הלא מתורגמים (UTR) של mRNA למטרות שונות (הנדסת רצף של mRNA), למשל באמצעות העשרת תוכן הגואנין-ציטוזין או בחירת UTRs ספציפיים הידועים כמגבירים את התרגום.[86] ניתן להוסיף קידוד ORF נוסף למנגנון שכפול כדי להגביר את תרגום האנטיגן ולפיכך את התגובה החיסונית, תוך הפחתת כמות חומר המוצא הדרושה.[87][88]
חסרונות[עריכת קוד מקור | עריכה]
אחסון[עריכת קוד מקור | עריכה]
mRNA הוא שביר, כך שיש לשמור על חיסונים מסוימים בטמפרטורות נמוכות כדי להימנע מפירוק ובכך לתת חסינות יעילה מעט לנמען. חיסון mRNA BNT162b2 של פייזר-BioNTech חייב להישמר בין 80 ל-60 מעלות מתחת לאפס.[89][90] לפי Moderna ניתן לאחסן את חיסון ה-mRNA-1273 שלהם בטמפרטורה שבין 25 ל-15 מעלות מתחת לאפס,[91] כמו במקפיא ביתי,[90] ושהוא נשאר יציב בין 2 ל-8 מעלות עד 30 ימים.[91][92] בנובמבר 2020, כתב העת המדעי נייצ'ר דיווח ש"הבדלים בניסוחי LNP או מבנים משניים של mRNA יכולים להסביר את ההבדלים ביציבות התרמוסטטית [בין Moderna ל-BioNtech]. מומחים רבים סבורים ששני מוצרי החיסון יתבררו בסופו של דבר כבעלי דרישות אחסון וחיי מדף דומים בתנאי טמפרטורה מגוונים."[80] נחקרות מספר פלטפורמות שעשויות לאפשר אחסון בטמפרטורות גבוהות יותר.[4]
לפני 2020, אף פלטפורמה טכנולוגית של mRNA (תרופה או חיסון) לא אושרה לשימוש בבני אדם, כך שהיה סיכון להשפעות לא ידועות.[80] מגפת ה-COVID-19 של 2020 דרשה יכולת ייצור מהירה יותר של חיסוני mRNA, הפכה אותם לאטרקטיביים עבור ארגוני בריאות לאומיים, והובילה לוויכוח על סוג האישור הראשוני שחיסוני mRNA צריכים לקבל (כולל אישור שימוש חירום או טפול חמלה) לאחר שמונה שבועות של ניסויים אחרונים בבני אדם.[93][94]
תופעות לוואי[עריכת קוד מקור | עריכה]
הריאקטוגניות דומה לזו של חיסונים רגילים שאינם RNA. עם זאת, לאלו הרגישים לתגובה אוטואימונית עשויה להיות תגובה שלילית לחיסוני mRNA.[4] גדילי ה-mRNA בחיסון עלולים לעורר תגובה חיסונית לא מכוונת. כדי למזער זאת, רצפי mRNA בחיסוני mRNA מתוכננים לחקות את אלה המיוצרים על ידי תאי המארח.[95]
השפעות ריאקטוגניות חזקות אך חולפות דווחו בניסויים של חיסוני mRNA COVID-19 חדשים; רוב האנשים לא יחוו תופעות לוואי חמורות הכוללות חום ועייפות. תופעות לוואי קשות מוגדרות ככאלה המונעות פעילות יומיומית.[96]
יעילות[עריכת קוד מקור | עריכה]
לחיסוני COVID-19 mRNA של Moderna ו-Pfizer-BioNTech יש שיעורי יעילות של 90 עד 95 אחוזים. חיסוני mRNA קודמים, ניסויי תרופות על פתוגנים אחרים מלבד COVID-19 לא היו יעילים והיה צריך לנטוש אותם בשלבים הראשונים של הניסויים.
הרופאה-מדענית מרגרט ליו הצהירה כי היעילות של חיסוני ה-mRNA החדשים ל-COVID-19 עשויה לנבוע מ"תגובה דלקתית לא ספציפית ל-mRNA שיכולה להיות להגביר את התגובה החיסונית הספציפית שלו, בהתחשב בכך שטכניקת הנוקלאוזידים המותאמת הפחיתה את הדלקת אך לא ביטלה אותה לחלוטין", וכי "זה עשוי גם להסביר את התגובות האינטנסיביות כמו כאבים וחום שדווחו אצל חלק מהמקבלים של ה-mRNA SARS-CoV-2 חיסונים". תגובות אלו, אף שהיו חמורות, היו חולפות ודעה נוספת היא שהאמינו שהן הן תגובה למולקולות הליפידים שהעבירו את התרופה. אין אישור מחקרי לטענות אלה.
ספקות[עריכת קוד מקור | עריכה]
יש מידע מוטעה המרמז שחיסוני mRNA יכולים לשנות את ה-DNA בגרעין.[97] mRNA בציטוזול מתפרק במהירות לפני שיספיק להיכנס לגרעין התא. חיסוני mRNA חייבים להיות מאוחסנים בטמפרטורה נמוכה מאוד וללא RNAses כדי למנוע פירוק mRNA. רטרו-וירוס יכול להיות RNA חד-גדילי (בדיוק כפי שרבים מחיסוני SARS-CoV-2 הם RNA חד-גדילי) שחודר לגרעין התא ומשתמש ברוורס טרנסקריפטאז כדי ליצור DNA מה-RNA בגרעין התא. לרטרו-וירוס יש מנגנונים לייבוא לגרעין, אך ל-mRNA אחר (כמו החיסון) חסרים מנגנונים אלו. ברגע שהוא נכנס לגרעין, יצירת DNA מ-RNA לא יכולה להתרחש ללא תעתיק הפוך ופריימרים מתאימים, שניהם מלווים נגיף רטרו, אך לא יהיו נוכחים עבור mRNA אקסוגני אחר (כגון חיסון) גם אם הוא יכול לחדור לגרעין.[98]
הגברה[עריכת קוד מקור | עריכה]
חיסוני mRNA משתמשים ב-mRNA שאינו מגביר (קונבנציונלי) או ב-mRNA מגביר עצמי.[99] חיסוני Pfizer–BioNTech ומודרנה משתמשים ב-mRNA שאינו מגביר. שני סוגי ה-mRNA ממשיכים להיחקר כשיטות חיסון נגד פתוגנים פוטנציאליים אחרים וסרטן.[100]
אי הגברה[עריכת קוד מקור | עריכה]

חיסוני ה-mRNA הראשוניים משתמשים במבנה mRNA שאינו מגביר.[101] ל-mRNA שאינו מגביר יש רק מסגרת קריאה אחת פתוחה המקודדת לאנטיגן הרלוונטי.[102] הכמות הכוללת של mRNA הזמינה לתא שווה לכמות הנמסרת על ידי החיסון. חוזק המינון מוגבל על ידי כמות ה-mRNA שניתן להעביר על ידי החיסון.[103] חיסונים שאינם מגבירים, מחליפים את האורידין ב-N1-Methylpseudouridine בניסיון להפחית רעילות.[104]
הגברה עצמית[עריכת קוד מקור | עריכה]
חיסוני mRNA (saRNA) בעלי הגברה עצמית משכפלים את ה-mRNA שלהם לאחר ההעברה.[105] ל-mRNA מגביר עצמי יש שתי מסגרות קריאה פתוחות. המסגרת הראשונה, כמו mRNA רגיל, מקודדת לאנטיגן הרלוונטי. המסגרת השנייה מקודדת לאנזים RNA רפליקאז (וחלבוני העזר שלו) המשכפל את מבנה ה-mRNA בתא. זה מאפשר מנות חיסון קטנות יותר.[105] המנגנונים וכתוצאה מכך ההערכה של mRNA מגביר עצמי עשויים להיות שונים, שכן mRNA מגביר עצמי הוא מולקולה הרבה יותר גדולה.[3]
חיסוני SaRNA שנחקרים כוללים חיסון נגד מלריה.[106] חברת Bio Gritstone החלה בשנת 2021 ניסוי שלב 1 של חיסון saRNA COVID-19, המשמש כחיסון דחף. החיסון נועד לכוון הן לחלבון הספייק של נגיף ה-SARS-CoV-2 והן לחלבונים נגיפיים שעשויים להיות פחות מועדים לשונות גנטית, כדי לספק הגנה טובה יותר מפני גרסאות SARS-CoV-2.[107][108] חיסוני saRNA חייבים להשתמש באורידין, שנדרש לשם שכפול.[109]
ראו גם[עריכת קוד מקור | עריכה]
לקריאה נוספת[עריכת קוד מקור | עריכה]
- Dolgin E (בספטמבר 2021). "The tangled history of mRNA vaccines" (PDF). Nature. 597 (9): 318–24. Bibcode:2021Natur.597..318D. doi:10.1038/d41586-021-02483-w. PMID 34522017.
{{cite journal}}: (עזרה) - Sahin U, Karikó K, Türeci Ö (באוקטובר 2014). "mRNA-based therapeutics – developing a new class of drugs". Nat Rev Drug Discov. 13 (10): 759–80. doi:10.1038/nrd4278. PMID 25233993.
{{cite journal}}: (עזרה)
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- סרטון המסביר את אופן פעולתו של חיסון ה-mRNA, באתר בית החולים לילדים של פילדלפיה
- "Five things you need to know about: mRNA vaccines". Horizon. אורכב מ-המקור ב-4 באפריל 2020. נבדק ב-17 בנובמבר 2020.
{{cite web}}: (עזרה) - "RNA vaccines: an introduction". PHG Foundation. University of Cambridge.
- "Understanding mRNA COVID-19 Vaccines". Centers for Disease Control and Prevention. 4 בינואר 2022.
{{cite web}}: (עזרה) - Kolata, Gina; Mueller, Benjamin (15 בינואר 2022). "Halting Progress and Happy Accidents: How mRNA Vaccines Were Made". The New York Times.
{{cite news}}: (עזרה)  חיסון mRNA, בביצוע M.I.T. Lecture 10: Kizzmekia Corbett, Vaccines", סרטון באתר יוטיוב
חיסון mRNA, בביצוע M.I.T. Lecture 10: Kizzmekia Corbett, Vaccines", סרטון באתר יוטיוב- xkcd webcomic explaining how the vaccine works using Star Wars characters and situations.
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ 1 2 3 4 Park KS, Sun X, Aikins ME, Moon JJ (בדצמבר 2020). "Non-viral COVID-19 vaccine delivery systems". Advanced Drug Delivery Reviews. 169: 137–51. doi:10.1016/j.addr.2020.12.008. PMC 7744276. PMID 33340620.
{{cite journal}}: (עזרה) - ^ Kowalski PS, Rudra A, Miao L, Anderson DG (באפריל 2019). "Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery". Mol Ther. 27 (4): 710–28. doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391.
{{cite journal}}: (עזרה) - ^ 1 2 3 4 5 Verbeke R, Lentacker I, De Smedt SC, Dewitte H (באוקטובר 2019). "Three decades of messenger RNA vaccine development". Nano Today. 28: 100766. doi:10.1016/j.nantod.2019.100766. ארכיון מ-11 בינואר 2021. נבדק ב-8 בדצמבר 2020.
{{cite journal}}: (עזרה) - ^ 1 2 3 PHG Foundation (2019). "RNA vaccines: an introduction". University of Cambridge. ארכיון מ-6 בדצמבר 2018. נבדק ב-18 בנובמבר 2020.
{{cite web}}: (עזרה) - ^ 1 2 Kramps T, Elders K (2017). "Introduction to RNA Vaccines". RNA Vaccines: Methods and Protocols. Methods in Molecular Biology. Vol. 1499. pp. 1–11. doi:10.1007/978-1-4939-6481-9_1. ISBN 978-1-4939-6479-6. PMID 27987140.
- ^ Crommelin DJ, Anchordoquy TJ, Volkin DB, Jiskoot W, Mastrobattista E (במרץ 2021). "Addressing the Cold Reality of mRNA Vaccine Stability". Journal of Pharmaceutical Sciences. 110 (3): 997–1001. doi:10.1016/j.xphs.2020.12.006. ISSN 0022-3549. PMC 7834447. PMID 33321139.
{{cite journal}}: (עזרה) - ^ "Mexico to start late-stage clinical trial for China's mRNA COVID-19 vaccine". Reuters. 11 במאי 2021. ארכיון מ-23 באוגוסט 2021. נבדק ב-19 באוגוסט 2021.
{{cite web}}: (עזרה) - ^ 1 2 "UK authorises Pfizer/BioNTech COVID-19 vaccine" (Press release). Department of Health and Social Care. 2 בדצמבר 2020. אורכב מ-המקור ב-2 בדצמבר 2020. נבדק ב-2 בדצמבר 2020.
{{cite press release}}: (עזרה) - ^ 1 2 "UK approves Pfizer/BioNTech Covid vaccine for rollout next week". The Guardian. 2 בדצמבר 2020. ארכיון מ-2 בדצמבר 2020. נבדק ב-2 בדצמבר 2020.
{{cite news}}: (עזרה) - ^ "Conditions of Authorisation for Pfizer/BioNTech COVID-19 Vaccine" (Decision). Medicines & Healthcare Products Regulatory Agency. 8 בדצמבר 2020. ארכיון מ-7 בדצמבר 2020. נבדק ב-10 בדצמבר 2020.
{{cite web}}: (עזרה) - ^ "FDA Takes Key Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for First COVID-19 Vaccine" (Press release). 11 בדצמבר 2020. אורכב מ-המקור ב-31 בינואר 2021. נבדק ב-6 בפברואר 2021.
{{cite press release}}: (עזרה) - ^ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (בדצמבר 2020). "The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Pfizer-BioNTech COVID-19 Vaccine – United States, December 2020" (PDF). MMWR Morb Mortal Wkly Rep. 69 (50): 1922–24. doi:10.15585/mmwr.mm6950e2. PMC 7745957. PMID 33332292. ארכיון (PDF) מ-19 בדצמבר 2020. נבדק ב-7 בפברואר 2021.
{{cite journal}}: (עזרה) - ^ "FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine" (Press release). 18 בדצמבר 2020. אורכב מ-המקור ב-19 בדצמבר 2020. נבדק ב-21 בדצמבר 2020.
{{cite press release}}: (עזרה) - ^ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (בינואר 2021). "The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine – United States, December 2020" (PDF). MMWR Morb Mortal Wkly Rep. 69 (5152): 1653–56. doi:10.15585/mmwr.mm695152e1. PMC 9191904. PMID 33382675. ארכיון (PDF) מ-9 בפברואר 2021. נבדק ב-7 בפברואר 2021.
{{cite journal}}: (עזרה) - ^ "The Nobel Prize in Physiology or Medicine 2023". NobelPrize.org (באנגלית אמריקאית). נבדק ב-2023-10-03.
- ^ "Hungarian and US scientists win Nobel for COVID-19 vaccine discoveries". Reuters (באנגלית). 2023-10-02. נבדק ב-2023-10-03.
- ^ "The Nobel Prize in Physiology or Medicine 2023". NobelPrize.org (באנגלית אמריקאית). נבדק ב-2023-10-03.
- ^ Xu S, Yang K, Li R, Zhang L (בספטמבר 2020). "mRNA Vaccine Era-Mechanisms, Drug Platform and Clinical Prospection". International Journal of Molecular Sciences. 21 (18): 6582. doi:10.3390/ijms21186582. PMC 7554980. PMID 32916818.
Initiation of cationic lipid-mediated mrna transfection; Concept proposal of mRNA-based drugs
{{cite journal}}: (עזרה) - ^ Malone RW, Felgner PL, Verma IM (באוגוסט 1989). "Cationic liposome-mediated RNA transfection". Proceedings of the National Academy of Sciences of the United States of America. 86 (16): 6077–81. Bibcode:1989PNAS...86.6077M. doi:10.1073/pnas.86.16.6077. PMC 297778. PMID 2762315.
{{cite journal}}: (עזרה) - ^ 1 2 3 Wolff JA, Malone RW, Williams P, Chong W, Acsadi G, Jani A, Felgner PL (במרץ 1990). "Direct gene transfer into mouse muscle in vivo". Science. 247 (4949 Pt 1): 1465–8. Bibcode:1990Sci...247.1465W. doi:10.1126/science.1690918. PMID 1690918.
{{cite journal}}: (עזרה) - ^ "After COVID-19 successes, researchers push to develop mRNA vaccines for other diseases". Nature. 31 במאי 2021. ארכיון מ-13 באוקטובר 2021. נבדק ב-31 ביולי 2021.
When the broad range of vaccines against COVID-19 were being tested in clinical trials, only a few experts expected the unproven technology of mRNA to be the star. Within 10 months, mRNA vaccines were both the first to be approved and the most effective. Although these are the first mRNA vaccines to be approved, the story of mRNA vaccines starts more than 30 years ago, with many bumps in the road along the way. In 1990, the late physician-scientist Jon Wolff and his University of Wisconsin colleagues injected mRNA into mice, which caused cells in the mice to produce the encoded proteins. In many ways, that work served as the first step toward making a vaccine from mRNA, but there was a long way to go—and there still is, for many applications.
{{cite news}}: (עזרה) - ^ Xu S, Yang K, Li R, Zhang L (בספטמבר 2020). "mRNA Vaccine Era-Mechanisms, Drug Platform and Clinical Prospection". International Journal of Molecular Sciences. 21 (18): 6582. doi:10.3390/ijms21186582. PMC 7554980. PMID 32916818.
Concept proposal of mRNA vaccines (1990)
{{cite journal}}: (עזרה) - ^ Patent: WO1990011092 (אורכב 14.10.2021 בארכיון Wayback Machine); Inventors: Philip L. Felgner, Jon Asher Wolff, Gary H. Rhodes, Robert Wallace Malone, Dennis A. Carson; Assignees: Vical Inc., Wisconsin Alumni Research Foundation; Title: "Expression of Exogenous Polynucleotide Sequences in a Vertebrate (אורכב 09.12.2021 בארכיון Wayback Machine)"; (Quote: "The present invention relates to introduction of naked DNA and RNA sequences into a vertebrate to achieve controlled expression of a polypeptide. It is useful in gene therapy, vaccination, and any therapeutic situation in which a polypeptide should be administered to cells in vivo"; Example 8: mRNA vaccination of mice to produce the gpl20 protein of HIV virus); Priority date: 21 March 1989; Publication date: 4 October 1990.
- ^ 1 2 3 Pascolo S (באוגוסט 2004). "Messenger RNA-based vaccines". Expert Opinion on Biological Therapy. 4 (8): 1285–94. doi:10.1517/14712598.4.8.1285. PMID 15268662.
{{cite journal}}: (עזרה) - ^ Martinon F, Krishnan S, Lenzen G, Magné R, Gomard E, Guillet JG, et al. (ביולי 1993). "Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA". European Journal of Immunology. 23 (7): 1719–22. doi:10.1002/eji.1830230749. PMID 8325342.
{{cite journal}}: (עזרה) - ^ Zhou X, Berglund P, Rhodes G, Parker SE, Jondal M, Liljeström P (בדצמבר 1994). "Self-replicating Semliki Forest virus RNA as recombinant vaccine". Vaccine. 12 (16): 1510–14. doi:10.1016/0264-410x(94)90074-4. PMID 7879415.
{{cite journal}}: (עזרה) - ^ Kallen KJ, Theß A (בינואר 2014). "A development that may evolve into a revolution in medicine: mRNA as the basis for novel, nucleotide-based vaccines and drugs". Therapeutic Advances in Vaccines. 2 (1): 10–31. doi:10.1177/2051013613508729. PMC 3991152. PMID 24757523.
{{cite journal}}: (עזרה) - ^ Conry RM, LoBuglio AF, Wright M, Sumerel L, Pike MJ, Johanning F, et al. (באפריל 1995). "Characterization of a messenger RNA polynucleotide vaccine vector". Cancer Research. 55 (7): 1397–400. PMID 7882341.
{{cite journal}}: (עזרה) - ^ 1 2 Sahin U, Karikó K, Türeci Ö (באוקטובר 2014). "mRNA-based therapeutics — developing a new class of drugs". Nature Reviews Drug Discovery. 13 (10): 759–80. doi:10.1038/nrd4278. ISSN 1474-1784. PMID 25233993.
{{cite journal}}: (עזרה) - ^ Heiser A, Coleman D, Dannull J, Yancey D, Maurice MA, Lallas CD, et al. (בפברואר 2002). "Autologous dendritic cells transfected with prostate-specific antigen RNA stimulate CTL responses against metastatic prostate tumors". The Journal of Clinical Investigation. 109 (3): 409–17. doi:10.1172/JCI14364. ISSN 0021-9738. PMC 150859. PMID 11828001.
{{cite journal}}: (עזרה) - ^ Karikó K, Buckstein M, Ni H, Weissman D (באוגוסט 2005). "Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA". Immunity. 23 (2): 165–75. doi:10.1016/j.immuni.2005.06.008. PMID 16111635.
{{cite journal}}: (עזרה) - ^ Blakney AK, Ip S, Geall AJ (בינואר 2021). "An Update on Self-Amplifying mRNA Vaccine Development". Vaccines. 9 (2): 97. doi:10.3390/vaccines9020097. PMC 7911542. PMID 33525396.
{{cite journal}}: (עזרה) - ^ Weide B, Carralot JP, Reese A, Scheel B, Eigentler TK, Hoerr I, et al. (בפברואר–במרץ 2008). "Results of the first phase I/II clinical vaccination trial with direct injection of mRNA". Journal of Immunotherapy. 31 (2): 180–8. doi:10.1097/CJI.0b013e31815ce501. PMID 18481387.
{{cite journal}}: (עזרה) - ^ "BioNTech's founders: scientist couple in global spotlight". France 24. 13 בנובמבר 2020. ארכיון מ-14 בפברואר 2021. נבדק ב-31 ביולי 2021.
{{cite web}}: (עזרה) - ^ "The story of mRNA: How a once-dismissed idea became a leading technology in the Covid vaccine race". Stat. 10 בנובמבר 2020. ארכיון מ-10 בנובמבר 2020. נבדק ב-16 בנובמבר 2020.
{{cite web}}: (עזרה) - ^ 1 2 "How a secretive Pentagon agency seeded the ground for a rapid coronavirus cure". The Washington Post. 30 ביולי 2020. ארכיון מ-2 באוגוסט 2021. נבדק ב-21 ביוני 2021.
{{cite news}}: (עזרה) - ^ 1 2 "DARPA's gambles might have created the best hopes for stopping COVID-19". BioCentury. 19 במרץ 2020. ארכיון מ-18 ביוני 2021. נבדק ב-19 ביוני 2021.
{{cite news}}: (עזרה) - ^ "DARPA Awards Moderna Therapeutics A Grant For Up To $25 Million To Develop Messenger RNA Therapeutics" (Press release). 2 באוקטובר 2013. אורכב מ-המקור ב-2 ביוני 2021. נבדק ב-31 במאי 2021.
{{cite press release}}: (עזרה) - ^ Dolgin E (בספטמבר 2021). "The tangled history of mRNA vaccines". Nature. 597 (7876): 318–24. Bibcode:2021Natur.597..318D. doi:10.1038/d41586-021-02483-w. ISSN 0028-0836. PMID 34522017.
{{cite journal}}: (עזרה) - ^ Alberer M, Gnad-Vogt U, Hong HS, Mehr KT, Backert L, Finak G, et al. (בספטמבר 2017). "Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial". The Lancet. 390 (10101): 1511–20. doi:10.1016/S0140-6736(17)31665-3. PMID 28754494.
{{cite journal}}: (עזרה) - ^ Dolgin E (בנובמבר 2021). "mRNA flu shots move into trials". Nature Reviews Drug Discovery. 20 (11): 801–3. doi:10.1038/d41573-021-00176-7. PMID 34635829.
{{cite journal}}: (עזרה) - ^ Hou X, Zaks T, Langer R, Dong Y (באוגוסט 2021). "Lipid nanoparticles for mRNA delivery". Nature Reviews Materials. 6 (12): 1078–94. Bibcode:2021NatRM...6.1078H. doi:10.1038/s41578-021-00358-0. ISSN 2058-8437. PMC 8353930. PMID 34394960.
{{cite journal}}: (עזרה) - ^ "COVID-19 and Your Health". Centers for Disease Control and Prevention. 11 בפברואר 2020. ארכיון מ-3 במרץ 2021. נבדק ב-26 בנובמבר 2020.
{{cite web}}: (עזרה) - ^ "Moderna Announces Its Global Public Health Strategy". investors.modernatx.com (באנגלית אמריקאית). ארכיון מ-16 במרץ 2022. נבדק ב-15 במרץ 2022.
{{cite web}}: (עזרה) - ^ Steenhuysen, Julie; Erman, Michael (8 במרץ 2022). "Moderna plots vaccines against 15 pathogens with future pandemic potential". Reuters (באנגלית). ארכיון מ-14 במרץ 2022. נבדק ב-15 במרץ 2022.
{{cite news}}: (עזרה) - ^ Ball P (בינואר 2021). "The lightning-fast quest for COVID vaccines — and what it means for other diseases". Nature. 589 (7840): 16–18. Bibcode:2021Natur.589...16B. doi:10.1038/d41586-020-03626-1. PMID 33340018.
{{cite journal}}: (עזרה) - ^ Wherry EJ, Jaffee EM, Warren N, D'Souza G, Ribas A (באפריל 2021). "How Did We Get a COVID-19 Vaccine in Less Than 1 Year?". Clinical Cancer Research. 27 (8): 2136–38. doi:10.1158/1078-0432.CCR-21-0079. ISSN 1078-0432. PMC 8052930. PMID 33542081.
{{cite journal}}: (עזרה) - ^ "Covid Pfizer vaccine approved for use next week in UK". BBC News. 2 בדצמבר 2020. ארכיון מ-2 בדצמבר 2020. נבדק ב-2 בדצמבר 2020.
{{cite news}}: (עזרה) - ^ Office of the Commissioner (18 בדצמבר 2020). "Pfizer-BioNTech COVID-19 Vaccine". FDA. ארכיון מ-14 בינואר 2021. נבדק ב-21 בדצמבר 2020.
{{cite web}}: (עזרה) - ^ 1 2 Batty CJ, Heise MT, Bachelder EM, Ainslie KM (בדצמבר 2020). "Vaccine formulations in clinical development for the prevention of severe acute respiratory syndrome coronavirus 2 infection". Advanced Drug Delivery Reviews. 169: 168–89. doi:10.1016/j.addr.2020.12.006. PMC 7733686. PMID 33316346.
{{cite journal}}: (עזרה) - ^ Hajj KA, Whitehead KA (בספטמבר 2017). "Tools for translation: non-viral materials for therapeutic mRNA delivery". Nature Reviews Materials. 2 (10): 17056. Bibcode:2017NatRM...217056H. doi:10.1038/natrevmats.2017.56.
{{cite journal}}: (עזרה) - ^ Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ (בנובמבר 2012). "Developing mRNA-vaccine technologies". RNA Biology. 9 (11): 1319–30. doi:10.4161/rna.22269. PMC 3597572. PMID 23064118.
{{cite journal}}: (עזרה) - ^ Anand P, Stahel VP (במאי 2021). "Review the safety of Covid-19 mRNA vaccines: a review". Patient Safety in Surgery. 15 (1): 20. doi:10.1186/s13037-021-00291-9. PMC 8087878. PMID 33933145.
{{cite journal}}: (עזרה) - ^ "How do the new COVID-19 vaccines work?". Scope. Stanford Medicine. 22 בדצמבר 2020. ארכיון מ-30 בינואר 2021. נבדק ב-28 בינואר 2021.
{{cite web}}: (עזרה) - ^ 1 2 3 4 5 6 7 Xu S, Yang K, Li R, Zhang L (בספטמבר 2020). "mRNA Vaccine Era—Mechanisms, Drug Platform and Clinical Prospection". International Journal of Molecular Sciences. 21 (18): 6582. doi:10.3390/ijms21186582. PMC 7554980. PMID 32916818.
{{cite journal}}: (עזרה) - ^ Fiedler K, Lazzaro S, Lutz J, Rauch S, Heidenreich R (2016). "MRNA Cancer Vaccines". Current Strategies in Cancer Gene Therapy. Recent Results in Cancer Research. Fortschritte der Krebsforschung. Progres dans les Recherches Sur le Cancer. Recent Results in Cancer Research. Vol. 209. pp. 61–85. doi:10.1007/978-3-319-42934-2_5. ISBN 978-3-319-42932-8. PMID 28101688.
- ^ 1 2 Jackson NA, Kester KE, Casimiro D, Gurunathan S, DeRosa F (בפברואר 2020). "The promise of mRNA vaccines: a biotech and industrial perspective". npj Vaccines. 5 (1): 11. doi:10.1038/s41541-020-0159-8. ISSN 2059-0105. PMC 7000814. PMID 32047656.
{{cite journal}}: (עזרה) - ^ Benteyn D, Heirman C, Bonehill A, Thielemans K, Breckpot K (בפברואר 2015). "mRNA-based dendritic cell vaccines". Expert Review of Vaccines. 14 (2): 161–76. doi:10.1586/14760584.2014.957684. PMID 25196947.
{{cite journal}}: (עזרה) - ^ Kreiter S, Selmi A, Diken M, Koslowski M, Britten CM, Huber C, et al. (בנובמבר 2010). "Intranodal vaccination with naked antigen-encoding RNA elicits potent prophylactic and therapeutic antitumoral immunity". Cancer Research. 70 (22): 9031–40. doi:10.1158/0008-5472.can-10-0699. PMID 21045153.
{{cite journal}}: (עזרה) - ^ "Vaccine components". Immunisation Advisory Centre. 22 בספטמבר 2016. ארכיון מ-26 בינואר 2021. נבדק ב-20 בדצמבר 2020.
{{cite news}}: (עזרה) - ^ Probst J, Weide B, Scheel B, Pichler BJ, Hoerr I, Rammensee HG, Pascolo S (באוגוסט 2007). "Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent". Gene Therapy. 14 (15): 1175–80. doi:10.1038/sj.gt.3302964. PMID 17476302.
{{cite journal}}: (עזרה) - ^ Lorenz C, Fotin-Mleczek M, Roth G, Becker C, Dam TC, Verdurmen WP, et al. (ביולי 2011). "Protein expression from exogenous mRNA: uptake by receptor-mediated endocytosis and trafficking via the lysosomal pathway". RNA Biology. 8 (4): 627–36. doi:10.4161/rna.8.4.15394. PMID 21654214.
{{cite journal}}: (עזרה) - ^ Weide B, Pascolo S, Scheel B, Derhovanessian E, Pflugfelder A, Eigentler TK, et al. (ביוני 2009). "Direct injection of protamine-protected mRNA: results of a phase 1/2 vaccination trial in metastatic melanoma patients". Journal of Immunotherapy. 32 (5): 498–507. doi:10.1097/CJI.0b013e3181a00068. PMID 19609242.
{{cite journal}}: (עזרה) - ^ Wang Y, Zhang Z, Luo J, Han X, Wei Y, Wei X (בפברואר 2021). "mRNA vaccine: a potential therapeutic strategy". Molecular Cancer. 20 (1): 33. doi:10.1186/s12943-021-01311-z. PMC 7884263. PMID 33593376.
{{cite journal}}: (עזרה) - ^ 1 2 3 "How nanotechnology helps mRNA Covid-19 vaccines work". Stat. 1 בדצמבר 2020. ארכיון מ-1 בדצמבר 2020. נבדק ב-3 בדצמבר 2020.
{{cite web}}: (עזרה) - ^ Reichmuth AM, Oberli MA, Jaklenec A, Langer R, Blankschtein D (במאי 2016). "mRNA vaccine delivery using lipid nanoparticles". Therapeutic Delivery. 7 (5): 319–34. doi:10.4155/tde-2016-0006. PMC 5439223. PMID 27075952.
{{cite journal}}: (עזרה) - ^ 1 2 "Without these lipid shells, there would be no mRNA vaccines for COVID-19". Chemical & Engineering News. American Chemical Society. 6 במרץ 2021. ארכיון מ-5 במרץ 2021. נבדק ב-6 במרץ 2021.
{{cite news}}: (עזרה) - ^ Paunovska K, Sago CD, Monaco CM, Hudson WH, Castro MG, Rudoltz TG, et al. (במרץ 2018). "A Direct Comparison of in Vitro and in Vivo Nucleic Acid Delivery Mediated by Hundreds of Nanoparticles Reveals a Weak Correlation". Nano Letters. 18 (3): 2148–57. Bibcode:2018NanoL..18.2148P. doi:10.1021/acs.nanolett.8b00432. PMC 6054134. PMID 29489381.
{{cite journal}}: (עזרה) - ^ "Opinion: A straightforward explanation why more COVID-19 vaccines can't be produced with help from 'dozens' of companies". MarketWatch. 3 בפברואר 2021. ארכיון מ-5 בפברואר 2021. נבדק ב-5 בפברואר 2021.
{{cite news}}: (עזרה) - ^ 1 2 "Why manufacturing Covid vaccines at scale is hard". Chemistry World. Royal Society of Chemistry. 23 במרץ 2021. ארכיון מ-24 במרץ 2021. נבדק ב-26 במרץ 2021.
{{cite news}}: (עזרה) - ^ 1 2 "Manufacturing moonshot: How Pfizer makes its millions of Covid-19 vaccine doses". CNN. 2 באפריל 2021. ארכיון מ-1 באפריל 2021. נבדק ב-3 באפריל 2021.
{{cite news}}: (עזרה) - ^ 1 2 "Race to the Vaccine: A COVID-19 vaccine life cycle: from DNA to doses". USA Today. Gannett. 7 בפברואר 2021. ארכיון מ-25 בפברואר 2021. נבדק ב-24 בפברואר 2021.
{{cite news}}: (עזרה) - ^ "mRNA Covid-19 Vaccines Are Fast to Make, but Hard to Scale". The Wall Street Journal. 3 במרץ 2021. ארכיון מ-4 באפריל 2021. נבדק ב-3 באפריל 2021.
{{cite news}}: (עזרה) - ^ "Why grandparents can't find vaccines: Scarcity of niche biotech ingredients". The Washington Post. 18 בפברואר 2021. ארכיון מ-26 בפברואר 2021. נבדק ב-7 במרץ 2021.
{{cite news}}: (עזרה) - ^ Lundstrom K (במרץ 2019). "RNA Viruses as Tools in Gene Therapy and Vaccine Development". Genes. 10 (3): 189. doi:10.3390/genes10030189. PMC 6471356. PMID 30832256.
{{cite journal}}: (עזרה) - ^ Huang TT, Parab S, Burnett R, Diago O, Ostertag D, Hofman FM, et al. (בפברואר 2015). "Intravenous administration of retroviral replicating vector, Toca 511, demonstrates therapeutic efficacy in orthotopic immune-competent mouse glioma model". Human Gene Therapy. 26 (2): 82–93. doi:10.1089/hum.2014.100. PMC 4326030. PMID 25419577.
{{cite journal}}: (עזרה) - ^ Schultz-Cherry S, Dybing JK, Davis NL, Williamson C, Suarez DL, Johnston R, Perdue ML (בדצמבר 2000). "Influenza virus (A/HK/156/97) hemagglutinin expressed by an alphavirus replicon system protects chickens against lethal infection with Hong Kong-origin H5N1 viruses". Virology. 278 (1): 55–59. doi:10.1006/viro.2000.0635. PMID 11112481.
{{cite journal}}: (עזרה) - ^ Geisbert TW, Feldmann H (בנובמבר 2011). "Recombinant vesicular stomatitis virus-based vaccines against Ebola and Marburg virus infections". The Journal of Infectious Diseases. 204 (Suppl 3): S1075–81. doi:10.1093/infdis/jir349. PMC 3218670. PMID 21987744.
{{cite journal}}: (עזרה) - ^ 1 2 3 Dolgin E (בנובמבר 2020). "COVID-19 vaccines poised for launch, but impact on pandemic unclear". Nature Biotechnology. doi:10.1038/d41587-020-00022-y. PMID 33239758.
{{cite journal}}: (עזרה) - ^ "Moderna's groundbreaking coronavirus vaccine was designed in just 2 days". Business Insider. 26 בנובמבר 2020. ארכיון מ-11 בינואר 2021. נבדק ב-28 בנובמבר 2020.
{{cite web}}: (עזרה) - ^ "From science to syringe: COVID-19 vaccines are miracles of science and supply chains". CTV News. Bell Media. 27 בפברואר 2021. ארכיון מ-27 בפברואר 2021. נבדק ב-28 בפברואר 2021.
{{cite news}}: (עזרה) - ^ Karikó K, Buckstein M, Ni H, Weissman D (באוגוסט 2005). "Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA". Immunity. 23 (2): 165–75. doi:10.1016/j.immuni.2005.06.008. PMID 16111635.
{{cite journal}}: (עזרה) - ^ Karikó K, Muramatsu H, Ludwig J, Weissman D (בנובמבר 2011). "Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA". Nucleic Acids Research. 39 (21): e142. doi:10.1093/nar/gkr695. PMC 3241667. PMID 21890902.
{{cite journal}}: (עזרה) - ^ Pardi N, Weissman D (17 בדצמבר 2016). "Nucleoside Modified mRNA Vaccines for Infectious Diseases". RNA Vaccines. Methods in Molecular Biology. Vol. 1499. Springer New York. pp. 109–21. doi:10.1007/978-1-4939-6481-9_6. ISBN 978-1-4939-6479-6. PMID 27987145.
{{cite book}}: (עזרה) - ^ Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ (בנובמבר 2012). "Developing mRNA-vaccine technologies". RNA Biology. 9 (11): 1319–30. doi:10.4161/rna.22269. PMC 3597572. PMID 23064118.
{{cite journal}}: (עזרה) - ^ Berglund P, Smerdou C, Fleeton MN, Tubulekas I, Liljeström P (ביוני 1998). "Enhancing immune responses using suicidal DNA vaccines". Nature Biotechnology. 16 (6): 562–65. doi:10.1038/nbt0698-562. PMID 9624688.
{{cite journal}}: (עזרה) - ^ Vogel AB, Lambert L, Kinnear E, Busse D, Erbar S, Reuter KC, et al. (בפברואר 2018). "Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses". Molecular Therapy. 26 (2): 446–55. doi:10.1016/j.ymthe.2017.11.017. PMC 5835025. PMID 29275847.
{{cite journal}}: (עזרה) - ^ "Pfizer-BioNTech COVID-19 Vaccine Vaccination Storage & Dry Ice Safety Handling". Pfizer. ארכיון מ-24 בינואר 2021. נבדק ב-17 בדצמבר 2020.
{{cite web}}: (עזרה) - ^ 1 2 "Why Does Pfizer's COVID-19 Vaccine Need To Be Kept Colder Than Antarctica?". NPR.org. ארכיון מ-1 בפברואר 2021. נבדק ב-18 בנובמבר 2020.
{{cite news}}: (עזרה) - ^ 1 2 "Fact Sheet for Healthcare Providers Administering Vaccine" (PDF). ModernaTX, Inc. ארכיון מ-28 בינואר 2021. נבדק ב-21 בדצמבר 2020.
{{cite web}}: (עזרה) - ^ "Moderna Announces Longer Shelf Life for its COVID-19 Vaccine Candidate at Refrigerated Temperatures". NPR.org. אורכב מ-המקור ב-16 בנובמבר 2020. נבדק ב-18 בנובמבר 2020.
{{cite web}}: (עזרה) - ^ "Experts Tell F.D.A. It Should Gather More Safety Data on Covid-19 Vaccines". New York Times. 22 באוקטובר 2020. ארכיון מ-26 בינואר 2021. נבדק ב-21 בנובמבר 2020.
{{cite news}}: (עזרה) - ^ "Pfizer boss warns on risk of fast-tracking vaccines". Financial Times. 30 בספטמבר 2020. ארכיון מ-18 בנובמבר 2020. נבדק ב-21 בנובמבר 2020.
{{cite news}}: (עזרה) - ^ PHG Foundation (2019). "RNA vaccines: an introduction". University of Cambridge. ארכיון מ-6 בדצמבר 2018. נבדק ב-18 בנובמבר 2020.
{{cite web}}: (עזרה) - ^ Wadman M (בנובמבר 2020). "Public needs to prep for vaccine side effects". Science. 370 (6520): 1022. doi:10.1126/science.370.6520.1022. PMID 33243869.
{{cite journal}}: (עזרה) - ^ "Vaccine rumours debunked: Microchips, 'altered DNA' and more" (Reality Check). BBC. 2 בדצמבר 2020. ארכיון מ-13 במרץ 2021. נבדק ב-10 בדצמבר 2020.
{{cite news}}: (עזרה) - ^ Skalka AM (2014). "Retroviral DNA Transposition: Themes and Variations". Microbiology Spectrum. 2 (5): 1101–23. doi:10.1128/microbiolspec.MDNA3-0005-2014. ISBN 9781555819200. PMC 4383315. PMID 25844274.
- ^ Deering RP, Kommareddy S, Ulmer JB, Brito LA, Geall AJ (ביוני 2014). "Nucleic acid vaccines: prospects for non-viral delivery of mRNA vaccines". Expert Opin Drug Deliv. 11 (6): 885–99. doi:10.1517/17425247.2014.901308. PMID 24665982.
{{cite journal}}: (עזרה) - ^ Blakney AK, Ip S, Geall AJ (בינואר 2021). "An Update on Self-Amplifying mRNA Vaccine Development". Vaccines. 9 (2): 97. doi:10.3390/vaccines9020097. PMC 7911542. PMID 33525396.
{{cite journal}}: (עזרה) - ^ Wang Y, Zhang Z, Luo J, Han X, Wei Y, Wei X (בפברואר 2021). "mRNA vaccine: a potential therapeutic strategy". Molecular Cancer. 20 (1): 33. doi:10.1186/s12943-021-01311-z. PMC 7884263. PMID 33593376.
{{cite journal}}: (עזרה) - ^ Deering RP, Kommareddy S, Ulmer JB, Brito LA, Geall AJ (ביוני 2014). "Nucleic acid vaccines: prospects for non-viral delivery of mRNA vaccines". Expert Opin Drug Deliv. 11 (6): 885–99. doi:10.1517/17425247.2014.901308. PMID 24665982.
{{cite journal}}: (עזרה) - ^ Versteeg L, Almutairi MM, Hotez PJ, Pollet J (בספטמבר 2019). "Enlisting the mRNA Vaccine Platform to Combat Parasitic Infections". Vaccines. 7 (4): 122. doi:10.3390/vaccines7040122. PMC 6963228. PMID 31547081.
{{cite journal}}: (עזרה) - ^ "New crop of COVID-19 mRNA vaccines could be easier to store, cheaper to use". www.science.org (באנגלית). ארכיון מ-5 באפריל 2022. נבדק ב-6 באפריל 2022.
{{cite web}}: (עזרה) - ^ 1 2 Bloom K, van den Berg F, Arbuthnot P (באפריל 2021). "Self-amplifying RNA vaccines for infectious diseases". Gene Therapy. 28 (3–4): 117–129. doi:10.1038/s41434-020-00204-y. PMC 7580817. PMID 33093657.
{{cite journal}}: (עזרה) - ^ "A Malaria Vaccine Candidate". Science Translational Medicine. 1 במרץ 2021. ארכיון מ-6 במאי 2021. נבדק ב-7 במאי 2021.
{{cite web}}: (עזרה) - ^
 Sarah Knapton, First 'variant-proof' Covid vaccine starts trials in Manchester, The Telegraph, 20 September 2021
Sarah Knapton, First 'variant-proof' Covid vaccine starts trials in Manchester, The Telegraph, 20 September 2021
- ^ "Gritstone Announces Dosing of First Volunteer in Trial Evaluating Self-Amplifying mRNA as a COVID-19 Vaccine Booster and Immunogenicity Enhancer". PipelineReview. 20 בספטמבר 2021. ארכיון מ-22 בספטמבר 2021. נבדק ב-21 בספטמבר 2021.
{{cite web}}: (עזרה) - ^ "New crop of COVID-19 mRNA vaccines could be easier to store, cheaper to use". www.science.org (באנגלית). ארכיון מ-5 באפריל 2022. נבדק ב-6 באפריל 2022.
{{cite web}}: (עזרה)
