ציאניד
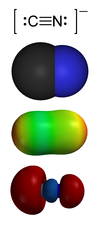
מבנה הקשר הקוולנטי וזוגות אלקטרונים לא קושרים
2. מודל מרחבי
3. משטח פוטנציאלי אלקטרוסטטי (פיזור מטען)
4. זוג בודד של פחמן בתצוגת HOMO/LUMO
ציאניד הוא תרכובת כימית רעילה, המכילה את היון הקרוי קבוצת ציאנו. קבוצת ציאנו בנויה מאטום פחמן הקשור בקשר קוולנטי משולש לאטום חנקן, ובסימון כימי: :C≡N:.
קבוצת ציאנו משמשת כקבוצה פונקציונלית לציאנידים (Cyanides או ניטרילים, Nitriles), שהם קבוצה של תרכובות אורגניות. כינויים נוספים לציאנידים הם "קבוצת הניטריל" ו"קבוצת הציאנו".
מקור השם "ציאניד" בתרכובת "פרוציאניד" (ferrocyanide), שפירוש שמה הוא "ברזל (ferro) כחול-ירקרק, ציאן (cyan)" ("כחול" עקב הפיגמנט "כחול פרוסי" המופק ממנה).
תרכובות העשויות לשחרר את אניון קבוצת הציאנו רעילות מאוד, בשל נטייתו של הציאניד להיקשר ליוני ברזל במערכת הנשימה התאית.
קישור ציאניד למתכות[עריכת קוד מקור | עריכה]
כאמור, רעילותו של הציאניד נובעת מהקישור שלו למתכת, ציאניד הוא ליגנד חזק, כלומר יוצר קומפלקסים עם מתכות מעבר. קומפלקס הוא תרכובת של קטיון מתכת מעבר עם כמה אניונים או בסיסי לואיס. הגאומטריה של הקומפלקס ומספר הליגנדים סביב המתכת נקבעים לפי המשיכה האלקטרוסטטית שבין המתכת לליגנדים, הדחייה האלקטרוסטטית שבין הליגנדים לבין עצמם, והאפשרות לחפיפה בין אורביטלי d של המתכת לאורביטלים של הליגנד (תרומה של קישור קוולנטי). הזיקה הגבוהה של יון הציאניד לקטיונים של מתכות המעבר נובעת:
- מכך שציאניד הוא אניון קטן ולכן קטנה הדחייה האלקטרוסטטית בין יוני ציאניד המקיפים את אותו יון.
- משיתוף אורביטלי ה π של הציאניד בקשר - יצירת אורביטלים מולקולריים בין אורביטלי d של המתכת לאורביטל π (אנ') של הציאניד.
סוגי קומפלקסים של ציאניד[עריכת קוד מקור | עריכה]
- קומפלקסים הקסה-ציאנידים (6 אניוני ציאניד סביב קטיון המתכת) המתכת M יכולה להיות ברזל, ונדיום, כרום (תלת ערכי), טיטניום, קובלט. המבנה הגאומטרי של הקומפלקסים הללו: אוקטהדרון.
- טטראציאנידים כאשר יון המתכת מטור הניקל: ניקל, פלדיום או פלטינה, כדרכן של מתכות אלו גאומטרית הקומפלקס - ריבוע מישורי.
- דיציאנידים כאשר הקומפלקס עם אחת ממתכות המטבע נחושת, כסף או זהב, הקומפלקסים הללו קוויים (ליניאריים).
יון הציאניד נקשר תמיד למתכת מצד הפחמן משום שזוג האלקטרונים הלא קושר של הפחמן הוא האורביטל המאוכלס באנרגיה הגבוהה ביותר (אלקטרונים באורביטלים גבוהים מבחינה אנרגטית הם אלו הנוטים להשתתף בקישור). כיוון שגם לחנקן זוג אלקטרונים לא קושר (בסיס לואיס) הציאניד יכול להיות ליגנד מגשר - נקשר לשני קטיונים כפי שהוא קשור, למשל, בכחול פרוסי או בגבישי זהב ציאנידי, אבץ ציאנידי או קדמיום ציאנידי.
שימוש בציאניד לכרייה[עריכת קוד מקור | עריכה]
יכולתו של הציאניד ליצור קומפלקסים יציבים מנוצלת, למשל, להפקת זהב. מפעילים תמיסת ציאניד על העפרה וכך ממצים את הזהב. ריאקציות המסה של זהב בציאניד:
באופן דומה, משתמשים בציאניד להפרדה של כסף, כיוון שהכסף נמצא לעיתים כסולפיד ולא במצבו המתכתי אין צורך בחמצן
כדי להפיק מחדש זהב מתכתי מתמיסת הציאניד מחזרים את הקומפלקס באבץ. לשיטת כריה זו השפעות סביבתיות הרסניות בשל זיהום מקורות מים בציאנידים. ככל שאיכות העפרה נמוכה יש צורך ביותר ציאניד לצורך ההפקה; להפקת זהב מעפרה באיכות טובה (מעל 6 גרם זהב לטון) נדרשים כ-50 ק"ג ציאניד לק"ג זהב, להפקת זהב מעפרות באיכות ירודה (פחות משני גרם זהב לטון) נדרשים 500 עד 1000 ק"ג ציאניד לק"ג זהב[1]. בחיפוש אחר דרכים לייצור ציאניד למטרה זו, גילו אדולף פרנק וניקודם קארו את ציאנמיד הסידן, שמשמש כיום בעיקר כדשן.
ציאנוהידרינים[עריכת קוד מקור | עריכה]
ציאנוהידרינים הם נגזרות של ניטרילים. הם מכילים קבוצת ניטריל וכן קבוצת הידרוקסיל (OH). הם נוצרים כשציאניד מגיב עם קטון או אלדהיד
רעילות של ציאניד[עריכת קוד מקור | עריכה]
הרעלת ציאניד והטיפול בה[עריכת קוד מקור | עריכה]
 ערך מורחב – הרעלת ציאניד
ערך מורחב – הרעלת ציאניד
הזיקה החזקה של הציאניד למתכות, ובפרט ליונים של ברזל תלת-ערכי, היא הגורמת לרעילותו הגבוהה של החומר.
הניטריל הידוע ביותר, ושעל-שמו קרויה כל המשפחה, הוא הגז הרעיל מימן ציאנידי (HCN), הידוע בפשטות כציאניד. 7 מיליגרמים של ציאניד מסוגלים להרוג אדם בוגר תוך שניות ספורות. היון -C≡N מגיע דרך זרם הדם לתאי הגוף ונקשר לברזל דו-ערכי באנזים ציטוכרום C אוקסידז, שנמצא על דופן המיטוכונדריה. בעת פעילות תקינה של המיטוכונדריה, חמצן מולקולרי אמור להיקשר לאנזים זה, לקבל אלקטרונים, ולהפוך יחד עם יוני מימן למים. שלב זה חיוני במעגל ייצור ה-ATP במיטוכונדריה. כאשר הציאניד תופס את מקומו של החמצן, המיטוכונדריה אינה מסוגלת לייצר ATP, ובכך נמנעת יכולתו של הגוף לייצר אנרגיה.
לציאניד נטייה חזקה להיקשר בחוזקה ליון הברזל הדו ערכי (Ferrous) המצוי בחלבונים חיוניים רבים בדם (כמו האנזים ציטוכרום אוקסידאז והחלבון המוגלובין), ובכך הוא מנטרל את יכולתם לפעול. בהיקשרו ליון הברזל, הוא מחמצן אותו ליון ברזל תלת ערכי (Feric). המוגלובין עם ברזל מחומצן, המכונה מתהמוגלובין (methemoglobin), אינו יכול לקשור עוד חמצן, והקישור הוא בלתי הפיך. תהליך זה מכונה "מתהמוגלובינמיה" (methemoglobinemia), והוא מביא לחנק תאי מהיר. מטהמוגלובינמיה יכולה להיגרם גם על ידי מחמצנים אחרים, כנתרן ניטריט NaNO2 ו-amyl nitrite. בהרעלת מתהמוגלובין ניתן לעיתים לטפל בעזרת sodium thiosulfate - Na2S2O3, המסייע לפירוק מטהמוגלובין להמוגלובין ולתיאוציאנט.
למרות רעילותו, מימן ציאנידי נמצא בכמויות מזעריות ברוב הפירות המכילים חרצן, כגון דובדבנים ומשמשים, וכן בשקדים. הגוף יודע לפרק ציאניד, והרעלה מתרחשת כאשר כמות הציאניד שנכנסת לגוף בבת אחת היא גדולה.
שימוש[עריכת קוד מקור | עריכה]
בגרסה מסחרית של מימן ציאנידי, בשם ציקלון בי, נעשה שימוש נרחב להשמדת יהודי אירופה בשואה. קיימים סיפורים רבים על מרגלים או שבויים שנשאו עמם גלולת ציאניד, או שהותקנה אמפולת ציאניד בתוך אחת משיניהם על מנת שיוכלו להתאבד במקרה של תפיסה. המתאבדים הידועים שעשו שימוש בציאניד הם הנאצים הבכירים הרמן גרינג והיינריך הימלר.
ראו גם[עריכת קוד מקור | עריכה]
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- ד"ר אבי סאייג, אפשר לשתות ציאניד ולהישאר בחיים?, במדור "שאל את המומחה" באתר של מכון דוידסון לחינוך מדעי, 9 נובמבר 2016
- ציאניד ודובדבנים באתר "מדע בצלחת"
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ :Gavin M. Mudd; Global trends in gold mining: Towards quantifying environmental and resource sustainability; Resources Policy, Volume 32, Issues 1-2, March-June 2007, Pages 42-56
| קבוצות פונקציונליות | ||
|---|---|---|
| פחמימנים | אלקיל (מתיל, אתיל, פרופיל, בוטיל, פנתיל) • אלקן (ויניל, אליל) • אלקין • קרבן • בנזיל • הלואלקאן • אלן • קומולן • פניל | 
|
| תרכובות חמצן | הידרוקסיל (כוהל) • קרבוניל • קטון • אלדהיד • אציל • קרבונט • חומצה קרבוקסילית • אנהידריד • אסטר • הידרופראוקסיד • פראוקסיד • אתר • המיאצטל • המיקטאל • אצטל • קטאל• חומצה דיקרבוקסילית • אצטיל • אצטוקסי • אקרילואיל • אלקוקסי (מתוקסי) • בנזויל • דיאוקסירן • אפוקסיד • אורתו-אסטר • ינון | |
| תרכובות חנקן | אמין • אמיד • קרבאמאט • אימין • אימיד • אזיד • אזו • ציאנט • איזוציאנט • ציאניד • ניטריל • איזוניטריל • הידרזון • ניטראט • ניטריט • ניטרו • ניטרוסו • אוקסים • פירידין • הידרזון • איזוניטריל • ניטרן | |
| תרכובות זרחן | פוספין • חומצה פוספונית • פוספאט • פוספודיאסטר | |
| תרכובות גופרית | תיול • תיואתר • דיסולפיד • סולפוקסיד • סולפון • חומצה סולפינית • חומצה סולפונית • תיוציאנט • איזותיוציאנט • תיוקטון • תיאל • תיואסטר • סולפונאמיד • פרסולפיד • תיוניל | |
| תרכובות ביוכימיות | חומצת שומן (ח.קרבוקסילית) • חלבון (פולי-אמיד) • פחמימה (קטון או אלדהיד) | |

![{\displaystyle \left[M(CN)_{6}\right]^{3-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cda3c29052f83547218a27f3dc48e67fabf2d13)
![{\displaystyle \left[M(CN)_{4}\right]^{2-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e587bb6e8bb2a22962d1659c20bb25b98d694de)
![{\displaystyle \left[M(CN)_{2}\right]^{-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57505d6065c4fdc2360f2907c0d15c43edafbd39)
![{\displaystyle 2Au+4KCN+{\frac {1}{2}}O_{2}+H_{2}O\Rightarrow 2K\left[Au(CN)_{2}\right]+2KOH}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f90f2625b3461ac6eb6358765fcea058e0d45a28)
![{\displaystyle 2Au+4KCN+O_{2}+2H_{2}O\Rightarrow 2K\left[Au(CN)_{2}\right]+2KOH+H_{2}O_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d6aac8e5e8709bba0e88ff7120148d937d8bbe4)
![{\displaystyle Ag_{2}S+4KCN+\Rightarrow 2K\left[Ag(CN)_{2}\right]+K_{2}S}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81c2692faf908d4363b54dc438612cc575fbd57a)