Human respiratory syncytial virus
 hRSV מבעד למיקרוסקופ אלקטרונים חודר
hRSV מבעד למיקרוסקופ אלקטרונים חודר
| |
| מיון מדעי | |
| ממלכה: | Orthornavirae |
| מערכה: | Negarnaviricota |
| קבוצה: | קבוצה V (נגיפי RNA חד-גדילי שלילי) |
| מחלקה: | Monjiviricetes |
| סדרה: | Mononegavirales |
| משפחה: | Paramyxoviridae |
| תת־משפחה: | Pneumovirinae |
| סוג: | Pneumovirus |
| מין: | Human respiratory syncytial virus |
| תת-מינים | |
| |
| שם מדעי | |
Human respiratory syncytial virus (בקיצור: hRSV; בתרגום מאנגלית: נגיף נשימתי סינקיטיוני אנושי) הוא נגיף השייך למשפחת נגיפי Paramixoviridae, שאליה שייכים גם נגיפי חצבת, חזרת, hMPV וה-Human parainfluenza viruses. hRSV נחשב לגורם העיקרי למחלות דרכי הנשימה התחתונות בקרב תינוקות וילדים קטנים בעונת החורף[1] אם כי ידוע גם כגורם למחלות בקרב אוכלוסיית המבוגרים ומדוכאי מערכת החיסון[2][3][4]. הנגיף בודד לראשונה בשנת 1956 משימפנזה הסובלת ממחלה בדרכי נשימה עליונות[2][5] ובשנת 1957 מילד חולה על ידי הווירולוג ד"ר רוברט מריט צ'נוק (Robert Merritt Chanock)[6]. כיום ידועים שני זנים של הנגיף (זן A וזן B)[7], השונים זה מזה בהרכב חלבוני המעטפת שלהם. זן A הוא השכיח יותר מבין השניים וגורם למחלות חריפות יותר[4].
שמו של הנגיף נגזר מהאפקט הציטופתי הייחודי לו הוא גורם בתרבית תאים - יצירת סינקיטיונים, כלומר תאי ענק שנוצרו מאיחוי קבוצת תאים שכנים מודבקים[2].
מבנה
[עריכת קוד מקור | עריכה]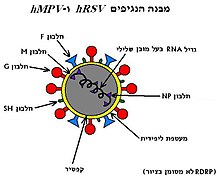
hRSV הוא נגיף בעל מעטפת ליפידית חיצונית פלאומורפית וקפסיד מעגלי בגודל של nm150-350[8]. הנגיף מכיל גנום RNA חד גדילי שלילי, בגודל של כ-14,600 נוקלאוטידים, ולכן על מנת לשכפל עצמו בתא המאכסן, עליו להכיל את האנזים הנגיפי RNA dependent RNA polymerase) RdRP). אנזים זה הופך את ה-RNA הנגיפִי בעל הגדיל השלילי ל-RNA נגיפִי בעל גדיל חיובי בעת ההדבקה. RNA בעל גדעל חיובי משמש מעין תבנית ממנה ניתן לשכפל גנום ויראלי חדש בעל גדיל שלילי, או מנגד לסנתז חלבונים נגיפיים על ידי ריבוזומים תאיים[9][10].
נגיפי hRSV עטופים במעטפת ליפידית המכילה גליקופרוטאינים אופייניים למשפחת ה-Paramixoviridae[10]:
- חלבוני G (Receptor binding glycoproteins) - חלבוני מעטפת של הנגיף המהווים תפקיד מרכזי במנגנון החדירה של ה-hRSV לתאי מערכת הנשימה. תפקידם זהה לקומפלקס חלבוני HN (Hemagglutinin-Neuraminidase) של נגיפי חזרת ו-Human parainfluenza viruses, דהיינו היצמדות לקולטני הפאראן גופרתי על גבי תאי אפיתל נשימתיים, המכילים שיירי חומצה סיאלית (Sialic acid), וחדירה לתוכם[11].
- חלבוני F (קיצור של: Fusion protein) - חלבוני מעטפת שמורים בקרב נגיפי ה-Paramixoviridae השונים. בעזרתם מעודד הנגיף יצירת איחויים של ממברנות תאים (יצירת תאי ענק). הדבר מקנה לנגיף מעבר נוח ובטוח מתא לתא מבלי להיחשף למרכיבי מערכת החיסון במהלך תהליך ההנצה. חלבונים אלה אימונוגניים למערכת החיסון של המאכסן[9].
- חלבוני SH (קיצור של: Small Hydrophobic protein) - חלבונים המצויים גם כן על פני המעטפת הליפידית של הנגיף, אולם תפקידם טרם התגלה. אחת ההשערות של החוקרים היא שתפקידם להוות מעין תעלת יונים הדרושה לשלב השלת הקפסיד (Uncoating) הוויראלי בתא המאכסן, בדומה לחלבוני תעלה M2 המצויים בקרב משפחת נגיפי ה-Orthomyxoviridae אליה שייכים נגיפי השפעת (Influenza A/B/C viruses)[10].
- חלבוני M (קיצור של: Matrix protein) - חלבונים המתווכים בין המעטפת הליפידית של הנגיף לבין הקפסיד (מהווים מעין חיץ בין המעטפת לקפסיד). יש להם תפקיד חשוב בשכפול הנגיף בתאי המאכסן[9].
- חלבונים אלה גורמים לעלייה בפעילות מערכת החיסון המולדת של המאכסן בכך שנמצאו כמובילים לשפעול פקטור השעתוק NF-κB, אשר גורם לעלייה בסינתזת אינטרפרון גמא הנחוץ לשם הפעלת מערכת החיסון של המאכסן כנגד זיהום על רקע נגיפי[12].
- חלבוני NP (קיצור של: Nuclear Proteins) - חלבונים המצויים סביב הגנום הנגיפי ותפקידם להגן עליו[9].
hRSV חולק קרבה גנטית רבה עם נציג נוסף במשפחת ה-Paramixoviridae - נגיף ה-hMPV, אולם בניגוד אליו מכיל 11 מסגרות קריאה פתוחות (בנוסף ל-8 הגנים המשותפים לשניים, מכיל hRSV 2 מסגרות קריאה פתוחות לחלבון M וכן 2 גנים לא מבניים ייחודיים: NS1 ו-NS2), המאורגנות בצורה שונה מאלה הקיימות ב-hMPV[10][13]. תפקידם של חלבוני NS1 ו-NS2 הוא לעזור לנגיף להשתלט על התא המאכסן וכן לשמור עליו בפני מערכת החיסון המולדת של הפונדקאי:
- חלבוני NS1 (קיצור של: Non-Structural protein 1) - חלבונים לא מבניים שנמצאו גורמים לירידה בפעילות מערכת החיסון המולדת של המאכסן באמצעות דיכוי השליח השניוני MAVS. דיכוי זה גורם לירידה בשפעול פקטור השעתוק NF-κB, דבר אשר גורם לירידה בסינתזת אינטרפרון גמא הנחוץ לשם הפעלת מערכת החיסון של המאכסן כנגד זיהום על רקע נגיפי[14].
- חלבוני NS2 (קיצור של: Non-Structural protein 2) - חלבונים לא מבניים שנמצאו גורמים לירידה בפעילות מערכת החיסון המולדת של המאכסן באמצעות דיכוי פעילות הקולטן RIG-I. דיכוי זה גורם לירידה בשפעול השליח השניוני MAVS ולירידה בשפעול פקטור השעתוק NF-κB, דבר אשר גורם לירידה בסינתזת אינטרפרון גמא הנחוץ לשם הפעלת מערכת החיסון של המאכסן כנגד זיהום על רקע נגיפי[15].
סינתזת אינטרפרון גמא יורדת בתאים המודבקים גם בעקבות פרוטאוליזה של השליח השניוני STAT2, על ידי החלבונים NS1 ו-NS2, בפרוטאזום[15].
הדבקה ומחזור ההתרבות
[עריכת קוד מקור | עריכה]
לאחר הצמדות ה-hMPV אל תאי האפיתל במערכת הנשימה, באמצעות חלבוני G, חודר הנגיף אל תוך התא ועובר שלב של השלת קפסיד (Uncoating). על ידי כך חושף הנגיף את תכולתו בציטוזול. אנזים ה-RdRP הופך את גנום ה-RNA בעל הגדיל השלילי ל-RNA בעל גדיל חיובי, אשר ממנו תחל סינתזת חלבוני הנגיף. תהליך הסינתזה של החלבונים מתרחש בריבוזומים של תא המאכסן, כשחלבוני המעטפת מסונתזים בריבוזומים שעל גבי הרשתית האנדופלזמתית ואילו חלבוני המבנה והקפסיד מסונתזים בריבוזומים החופשיים שבציטוזול. ברגע שמסונתזים מספיק חלבוני NP, מתחיל אנזים ה-RdRP לשכפל את הגנום עצמו. גדילי RNA חדשים שזה עתה סונתזו מונחים על גבי חלבוני M, המהווים מעין פלטפורמה לאריזה נכונה של הנגיף. ברגע שהנגיף נארז בצורה נכונה בקפסיד הוא עובר לתא אפיתל שכן, הודות לאיחויים בין קרומי התאים להם גורם חלבון F, בעודו רוכש חלבוני מעטפת ויראליים שנשתלו מבעוד מועד על פני הקרום של תא המאכסן. תהליך השכפול הנגיפי מתרחש, על כל שלביו, בציטוזול של התא המודבק[10][16].
פתוגנזה
[עריכת קוד מקור | עריכה]באזורי אקלים ממוזג ההדבקה ב-hRSV מתאפשרת במהלך חודשי הסתיו, החורף והאביב (באזורי אקלים טרופי במהלך התקופה הגשומה), בעקבות חשיפה לארוסולים המכילים בתוכם את חלקיקי הנגיף[2][17][18].
hRSV חודר לגוף דרך העיניים ודרכי הנשימה ומתרבה ברקמה הרירית של חלל האף והגרון[19].
תקופת הדגירה נמשכת בין 4–5 ימים כשלאחר מכן גורם הנגיף, בדומה ליתר נגיפי משפחת ה-Paramyxoviridae, למגוון מחלות בדרכי הנשימה[2][19]. נוגדנים בתינוקות שמקורם בחלב אם אינם מקנים חסינות בפני הדבקות[2] ולכן hRSV מהווה גורם עיקרי למחלות דרכי הנשימה התחתונות בקרב אוכלוסייה זו במהלך עונת החורף, אולם שכיח גם בקרב אוכלוסיית המבוגרים ואוכלוסיית חולים מדוכאי מערכת החיסון, כשהנפוצות בהן הם: דלקת סימפונות, דלקת סימפונונות, דלקת ריאות ואף אסתמה[4][20][21][22].
תסמיני ההדבקה בנגיף מזכירים מאוד את אלה המתרחשים בעת הדבקה ב-hMPV[3][17][20]:
- חום גבוה
- הצטננות
- צפצופים בזמן הנשימה
- קוצר נשימה
- שיעול
- כיחלון
- כאב גרון
- דלקת האוזן התיכונה
- נזלת
אצל ילדים קטנים ותינוקות גורם הנגיף למחלות בדרכי הנשימה התחתונות. בקרב תינוקות וילדים קטנים הדבקה ב-hRSV מלווה, לעיתים תכופות, בהדבקה עם hMPV (הדבקה כפולה). מצב זה של הדבקה עלול לגרום לביטוי קשה יותר של המחלה[23]. תחלואה, כתוצאה מהדבקות בנגיף, עלולה להתרחש מספר פעמים במהלך החיים[2].
בחלק מן החולים, השייכים לקבוצת סיכון להידבק בנגיף, כגון: פגים, חולים הסובלים ממחלות לב וריאה למיניהן, מדוכאי מערכת חיסון לאחר השתלות (בעיקר אצל מושתלי מח עצם), תוביל ההדבקה ב-hRSV לדלקת סימפונונות או לדלקת ריאות חריפה, אשר לעיתים תכופות מצריכות אשפוז בבית חולים. זאת משום שבעקבות הצטברות נוזלים בחלל הריאות מתעורר חשש להיווצרות חסימות בדרכי הנשימה שעלולות לגרום להפסקת הנשימה ולמוות[4][20].
במבוגרים ובצעירים הנגיף גורם לתסמיני מחלה קלים עד מתונים בדרכי הנשימה העליונות והתחתונות, המזכירים מאוד את תסמיני מחלת השפעת. באוכלוסייה זו המחלה חולפת ללא התערבות רפואית, לרוב כעבור יומיים-שלושה. הקלות היחסית של המחלה מוסברת ככל הנראה על ידי חשיפה קודמת לנגיף בשלב מסוים בחיים ויצירת נוגדנים מסוג IgG כנגד חלבוני F ו-G[2][4].
תסמיני המחלה נמשכים בממוצע בין 7–10 ימים[24].
מניעה
[עריכת קוד מקור | עריכה]בהיותו נגיף העטוף במעטפת ליפידית חיצונית מפגין hRSV רגישות יחסית גבוהה הן לתנאי סביבה, והן לחומרי חיטוי שונים.
רגישות לתנאי סביבה[18]:
- יובש
- טמפרטורה (תהליכי הפשרה-הקפאה וכן חימום מעל C°55 במשך 5 דקות, גורמים להרס את נגיפי hRSV)
- תנאי pH (סביבה החורגת מרמת חומציות pH=7.5 גורמת להרס נגיפי hRSV)
עם זאת, בטמפרטורת החדר מסוגל הנגיף לשרוד במשך 3–30 שעות[18] רגישות לחומרי חיטוי[18]:
- תמיסת אתנול בריכוז 70%
- תמיסת נתרן תת-כלורי בריכוז של 1%
- תמיסת גלוטראלדהיד בריכוז של 2%
- Sodium dodecyl sulfate בריכוז של 0.25%
- Triton X-100
- תמיסת נתרן דאוקסיכולי בריכוז 0.1%
- תמיסת פורמלין בריכוז 5%
- אתר
- כלורופורם
מספיקה כמות של 160–640 נגיפים על מנת להדבק[18], והיות שהנגיף מועבר דרך האוויר על ידי תרסיס, שמירה על היגיינה נאותה הכוללת שטיפת ידיים קבועה וכיסוי הפה והאף ברגע שיעול ועיטוש, מהווה אמצעי יעיל ביותר לשמירה בפני הידבקות[20][25].
עובדי מעבדות הם בעלי סיכון מוגבר להדבקות מפני שהם נחשפים לריכוזים גבוהים של הנגיף על בסיס יומי ולכן חייבים להצטייד בביגוד מגן הכולל כפפות, חלוק, מסכת פנים ומשקפי מגן. היות שנגיף ה-hRSV מועבר באמצעות אירוסולים, פרט לביגוד מגן ייעודי רצוי להשתמש במנדף ביולוגי מתאים[18]. אחוז ניכר של הדבקויות מגיע מכיוון הצוותים הרפואיים בבתי חולים במהלך ובפרק הזמן שלאחר הלידה. לפיכך גם הם מחויבים להצטייד בביגוד מגן מתאים בעת מגע וטיפול בילודים[20][25].
עבודה עם נגיפי hRSV נחשבת לבעלת סיכון ביולוגי ברמה 2 (Biosafety level 2)[18].
חיסון
[עריכת קוד מקור | עריכה]במהלך השנים נעשו מספר ניסיונות לפתח חיסון יעיל כנגד hRSV, כשהמפורסם ביותר הוכן בשנות ה-60 של המאה ה-20. בחיסון זה השתמשו בזן מומת באמצעות פורמלין של הנגיף, אולם בניגוד לתקווה הגבוהה שתלו החוקרים והרופאים, לא הצליח חיסון זה להקנות הגנה בפני הדבקות חדשה ואף נראה כי הגביר את הרגישות של התינוקות והילדים כלפי hRSV.[26] נכון ל-2019 לא פותח חיסון פעיל כנגד הנגיף, אך קיים חיסון סביל.
ב-3 במאי 2023 ה־FDA אישר חיסון נגד הנגיף לאוכלוסייה מגיל 60 ומעלה. החיסון מיוצר על ידי חברת GSK והוא הראשון שמאושר לשימוש באוכלוסייה הזו ונמכר תחת השם ארקסווי (Arexvy).[27][28]

אפידמיולוגיה
[עריכת קוד מקור | עריכה]hRSV הוא נגיף בעל תפוצה כלל עולמית עם נטייה להדבקה בעיקר בחודשי החורף. כל שנה נדבקים בנגיף כ-64 מיליון בני אדם ברחבי העולם וביניהם בין 4–5 מיליון ילדים מתחת לגיל 4. טווח הגילים בו נרשם המספר הגבוה ביותר של נדבקים בקרב אוכלוסיית הילדים הוא 2–8 חודשים. כ-160,000 חולים ברחבי העולם נפטרים מדי שנה מהנגיף. מחקרים סרולוגיים הראו כי למעשה כמעט כל הילדים המאושפזים בני 2–3 נחשפו ל-hRSV בשלב מסוים במהלך חייהם. פרט לכך, כל שנה נדבקים מחדש בנגיף מבוגרים ואוכלוסיית חולים מדוכאי מערכת החיסון[2][30].
אבחנה
[עריכת קוד מקור | עריכה]כיום נהוג להשתמש במספר שיטות לזיהוי הנגיף, הן סרולוגיות והן שיטות של וירולוגיה קלאסית[20][31]:
- בידוד הנגיף בתרבית - בשיטה זו מדגירים שטף אף או כיח מהגרון על שורת תאים סרטניים כגון HEP2 או תאי הילה, לקבלת אפקט ציטופתי ייחודי של תאי ענק, אשר ירמזו על נוכחות הנגיף בתרבית. החיסרון המרכזי בשיטה זו הוא פרק הזמן הממושך אשר לוקח לתרבית התאים לבטא את האפקט הציטופתי הנזכר לעיל (החל מהיום ה-5 מרגע ההדגרה בלבד)[31].
- אימונופלואורסצנציה ישירה - השיטה מתבססת על הדגרת נוגדנים מונוקלונליים, הנושאים מולקולה פלואורסצנטית (לרוב FITC) כנגד חלבוני המעטפת הליפידית של הנגיף מדגימות שטף אף. לאחר בדיקה תחת מיקרוסקופ אולטרה סגול ניתן לשלול או לאשר את נוכחות הנגיף בדוגמה. היתרון המשמעותי של השיטה הזו נעוץ במהירות הבדיקה (תוצאות ניתן לראות כעבור שעה). השיטה הזו היא גם המועדפת מבחינת אבחון הנגיף בקרב המעבדות הקליניות בבתי החולים[32].
- אימונוכרומטוגרפיה - בשיטה זו כיח או שטף מהאף נמהלים ומטופטפים על משטח בדיקה. הדגימה מתפשטת באמצעות כוח הנימיות על פני משטח הבדיקה ונחשפת לנוגדנים כנגד חלבוני G ו-F. כעבור מספר דקות ניתן לראות פס צבע המאשש את נוכחות הנגיף. בשל מהירותה (תוצאות ניתן לראות כעבור 15 דקות) שיטה זו היא השיטה המועדפת מבחינת האבחון במצבים בהם דרושה תשובה מיידית, במיוחד בחולים הנמצאים בקבוצת הסיכון[33].
- שיטת EIA (קיצור של: Enzyme immunoassay on antigen) - בשיטה זו חרוזים מצופים בנוגדנים מונוקלונליים כנגד חלבון G מגיבים עם כיח מהחולה. אם ישנה נוכחות נגיף בכיח יתקבל ביטוי צבע שנמדד מאוחר יותר לבליעת אורך גל של האור. היתרון המרכזי של השיטה, פרט למהירות היחסית בה מתבצעת הבדיקה (כחצי שעה), היא היכולת לאבחן כמויות קטנות מאוד של נגיף בכיח (ng5-10 בלבד)[34].
- RT-PCR - השיטה מתבססת על הגברת רצף RNA ייחודי לנגיף. היתרון של השיטה הוא הקטנת האפשרות לקבלת טעויות בזיהוי הנגיף, העלולות להתקבל בשיטות אבחון אחרות (כלומר מניעת False Negative או False Positive)[20].
טיפול
[עריכת קוד מקור | עריכה]
ברוב המקרים עיקר הטיפול כנגד הנגיף מתבסס על מתן טיפול תומך, אולם במקרים חמורים הטיפולים השכיחים כנגדו כוללים[20]:
- Ribavirin[20] - תרופה נפוצה בטיפול כנגד מגוון רחב של נגיפי RNA ו-DNA משום שהקבוצה הקרבוקסאמידית (אמינו קרבונילית) של התרופה מהווה אנלוג מבני לנוקלאוטידים של אדנוזין וגואנוזין. כתוצאה מכך ה-Ribavirin משתלב ללא בעיה, בעת סינתזת גדיל ה-RNA, במקום שני הנוקלאוטידים הנ"ל ויוצר זיווג עם נוקלאוטידים אורציל או ציטוזין. זיווג זה גורם להופעת מוטציות קטלניות למגוון נגיפי ה-RNA. התרופה ניתנת בתרסיס יחד עם מתן חמצן, הגורם להשארותה בדרכי הנשימה. קיימות נגזרות של ה-Ribavirin, דוגמת: Ribavirin 5' mono/di/tri-phosphate, הידועות כמעכבות RdRP בחלק מנגיפי ה-RNA.
- RSV-IGIV - הזרקת נוגדנים מסוג IgG, כנגד חלבוני G ו-F נגיפיים, מאנשים שהחלימו ממחלה על רקע הדבקה ב-hRSV[25].
- Palivizumab - מתן נוגדני IgG מונוקלונליים כנגד חלבון F לשם מניעת מחלה על רקע hRSV[3][17].
ראו גם
[עריכת קוד מקור | עריכה]לקריאה נוספת
[עריכת קוד מקור | עריכה]- David O.White, Frank J. Fenner, Medical Virology (4th edition), 1994. pp.469-474.
- Patrick R. Murray, Ken S. Rosenthal, Michael A. Pfaller, Medical microbiology (5th edition). Elsevier Mosby. 2005, pp.606-607. ISBN 978-0323033039.
קישורים חיצוניים
[עריכת קוד מקור | עריכה]- Human respiratory syncytial virus, באתר NCBI (באנגלית)
- נגיף Human respiratory virus באתר ViralZone
- נגיף Human respiratory virus באתר אינפומד
הערות שוליים
[עריכת קוד מקור | עריכה]- ^ James Andrew Coultas, Rosalind Smyth, Peter J. Openshaw, Respiratory syncytial virus (RSV): a scourge from infancy to old age, Thorax 74, 2019-10-01, עמ' 986–993 doi: 10.1136/thoraxjnl-2018-212212
- ^ 1 2 3 4 5 6 7 8 9 Patrick R. Murray, Ken S. Rosenthal, Michael A. Pfaller. Medical microbiology (5th ed.). Elsevier Mosby. 2005, p.606. ISBN 978-0323033039.
- ^ 1 2 3 סקירה על Respiratory Syncytial Virus באתר www.medscape.com.
- ^ 1 2 3 4 5 David O.White, Frank J. Fenner, Medical Virology (4th edition), 1994. p. 471.
- ^ רקע על נגיף hRSV באתר www.medscape.com.
- ^ Lawrence K. Altman, Robert M. Chanock, Prominent Virologist, Dies at 86, נקרולוג בניו יורק טיימס, 4 באוגוסט, 2010].
- ^ Lee FE, Walsh EE, Falsey AR, Lumb ME, Okam NV, Liu N, Divekar AA, Hall CB, Mosmann TR. (2007). Human infant respiratory syncytial virus (RSV)-specific type 1 and 2 cytokine responses ex vivo during primary RSV infection. The Journal of Infectious Diseases. 195(12):1779-88. PMID 17492594.
- ^ Collins, P.L, & Crowe JR, J.E. (2007). Respiratory Syncytial Virus and Metapneumovirus. In Knipe D.M, Howley P.M, Griffin D.E, Lamb R.A, Martin M.A, Roizman B, & Straus S.E (Eds.). Fields Virology (5th ed.) Philadelphia, USA: Lippincott Williams & Wilkins. pp.1601-1636. ISBN 978-0781760607.
- ^ 1 2 3 4 Patrick R. Murray, Ken S. Rosenthal, Michael A. Pfaller. Medical microbiology (5th ed.). Elsevier Mosby. 2005, p.597. ISBN 978-0323033039.
- ^ 1 2 3 4 5 נגיף Human respiratory syncytial virus באתר www.viralzone.org.
- ^ Krusat T, Streckert HJ. (1997). Heparin-dependent attachment of respiratory syncytial virus (RSV) to host cells. Archives of Virology. 142(6):1247-54. PMID 9229012.
- ^ Reimers K, Buchholz K, Werchau H. (2005). Respiratory syncytial virus M2-1 protein induces the activation of nuclear factor kappa B. Virology. 331(2):260-8. PMID 15629770.
- ^ נגיף Metapneumovirus באתר www.viralzone.org.
- ^ Boyapalle S, Wong T, Garay J, Teng M, San Juan-Vergara H, Mohapatra S, Mohapatra S. (2012). Respiratory syncytial virus NS1 protein colocalizes with mitochondrial antiviral signaling protein MAVS following infection. PLOS One. 7(2):e29386. PMID 22383950.
- ^ 1 2 Ling Z, Tran KC, Teng MN. (2009). Human respiratory syncytial virus nonstructural protein NS2 antagonizes the activation of beta interferon transcription by interacting with RIG-I. Journal of Virology. 83(8):3734-42. PMID 19193793.
- ^ Patrick R. Murray, Ken S. Rosenthal, Michael A. Pfaller. Medical microbiology (5th ed.). Elsevier Mosby. 2005, p.598. ISBN 978-0323033039.
- ^ 1 2 3 hRSV מתוך A.D.A.M. Medical Encyclopedia, PubMed Health. National Center for Biotechnology Information, U.S. National Library of Medicine. January 2011.
- ^ 1 2 3 4 5 6 7 Respiratory syncytial virus - Material Safety Data Sheets.
- ^ 1 2 David O.White, Frank J. Fenner, Medical Virology (4th edition), 1994. p.469.
- ^ 1 2 3 4 5 6 7 8 9 Patrick R. Murray, Ken S. Rosenthal, Michael A. Pfaller. Medical microbiology (5th ed.). Elsevier Mosby. 2005, p.607. ISBN 978-0323033039.
- ^ מתוך נגיפים כגורמי אסתמה (Inducers) או מעוררי אסתמה (Triggers) באתר www.medicalmedia.co.il.
- ^ Pérez-Yarza EG, Moreno A, Lázaro P, Mejías A, Ramilo O. (2007). The association between respiratory syncytial virus infection and the development of childhood asthma: a systematic review of the literature. The Pediatric Infectious Disease Journal. 26(8):733-9. PMID 17848887.
- ^ Schildgen O, Simon A, Wilkesmann A, Williams J, Eis-Hubinger AM, Kupfer B, Roggendorf M, Viazov S. (2006). The human metapneumovirus: biology, epidemiological features, and clinical characteristics of infection. Reviews in Medical Microbiology. 17:11-25.
- ^ הפתופיזיולוגיה של נגיף ה-hRSV באתר www.medscape.com.
- ^ 1 2 3 David O.White, Frank J. Fenner, Medical Virology (4th edition), 1994. p.473.
- ^ Kim HW, Canchola JG, Brandt CD, Pyles G, Chanock RM, Jensen K, Parrott RH. (1969). Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. American Journal of Epidemiology. 89(4):422-34. PMID 4305198.
- ^
 הניו יורק טיימס, FDA אישר חיסון ראשון נגד נגיף RSV למבוגרים מגיל 60 ומעלה, באתר הארץ, 4 במאי 2023
הניו יורק טיימס, FDA אישר חיסון ראשון נגד נגיף RSV למבוגרים מגיל 60 ומעלה, באתר הארץ, 4 במאי 2023
- ^
 נטל התחלואה ב-RSV ואפשרויות הטיפול והחיסון החדשות, באתר DoctorsOnly, 9 באוקטובר 2024
נטל התחלואה ב-RSV ואפשרויות הטיפול והחיסון החדשות, באתר DoctorsOnly, 9 באוקטובר 2024
- ^ Alberto Papi, Michael G. Ison, Joanne M. Langley, Dong-Gun Lee, Isabel Leroux-Roels, Federico Martinon-Torres, Tino F. Schwarz, Richard N. van Zyl-Smit, Laura Campora, Nancy Dezutter, Nathalie de Schrevel, Laurence Fissette, Marie-Pierre David, Marie Van der Wielen, Lusine Kostanyan, Veronica Hulstrøm, AReSVi-006 Study Group, Respiratory Syncytial Virus Prefusion F Protein Vaccine in Older Adults, The New England Journal of Medicine 388, 2023-02-16, עמ' 595–608 doi: 10.1056/NEJMoa2209604
- ^ האפידמיולוגיה של נגיף ה-hRSV באתר www.medscape.com.
- ^ 1 2 David O.White, Frank J. Fenner, Medical Virology (4th edition), 1994. p.472.
- ^ ערכת אימונופלואורסצנציה ישירה לנגיף hRSV של חברת Fisher scientific.
- ^ מצגת קצרה המסבירה את אופן פעילות ערכת כרומטוגרפיה לנגיף hRSV של חברת Inverness medical.
- ^ Masters HB, Bate BJ, Wren C, Lauer BA. (1988). Detection of respiratory syncytial virus antigen in nasopharyngeal secretions by Abbott Diagnostics enzyme immunoassay. Journal of Clinical Microbiology. 26(6):1103-5. PMID 3290243.
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
