צורן
| זרחן - צורן - אלומיניום | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| נתונים בסיסיים | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| מספר אטומי | 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| סמל כימי | Si | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| סדרה כימית | מתכות למחצה | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מראה | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| אפור כהה בגוון כחלחל | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| תכונות אטומיות | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| משקל אטומי | 28.0855 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| רדיוס ואן דר ואלס | 210 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| סידור אלקטרונים ברמות אנרגיה | 2, 8, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| קונפיגורציה אלקטרונית |
1s² 2s² 2p⁶ 3s² 3p² | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| דרגות חמצון |
−4, 1, 2, 3, −1, −3, −2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| תכונות פיזיקליות | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| צפיפות | 2,330 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מצב צבירה בטמפ' החדר | מוצק | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| נקודת רתיחה | 3,173.15K (2,900°C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| נקודת התכה | 1,687.15K (1,414°C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| לחץ אדים | 4.77Pa ב-1,683K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| שונות | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| אלקטרושליליות | 1.90 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| קיבול חום סגולי | 700 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מוליכות חשמלית | 2.52 /m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מוליכות חום | 148 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| אנרגיית יינון ראשונה | 786.5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| היסטוריה | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| מגלה |
ינס יאקוב ברצליוס | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| תאריך גילוי |
1823 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| נקרא על שם |
צור | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
צוֹרָן (באנגלית: Silicon; לטינית: Silicium), הידוע יותר בשמו הלועזי סיליקון, הוא יסוד כימי שסמלו הכימי Si ומספרו האטומי 14.
צורן הוא היסוד השמיני בתפוצתו ביקום (לפי מסה), אולם כמעט ולעולם אינו מופיע בצורתו הטהורה. הצורן מופיע לרוב בצורות שונות של צורן דו-חמצני (תחמוצת סיליקון) או סיליקטים, והוא שכיח מאוד בחול, באבק, בכוכבי לכת ובפלנטואידים. למעלה מ-90% מקרום כדור הארץ מורכב ממינרלי סיליקט, מה שהופך את הצורן ליסוד השני בתפוצתו בקרום כדור הארץ (כ-28% משקלי) אחרי חמצן. המינרל הסיליקטי קוורץ הוא המינרל השני בתפוצתו בקרום כדור הארץ.
הרבה מהשימושים המסחריים של צורן אינם דורשים הפרדה או עיבוד שלו מהצורה הטבעית. שימושים כאלה כוללים לבנים קרמיות, חרסית (חימר), חצץ, חרסינה וסוגי זכוכית שונים. צורן קרביד (SiC) הוא תרכובת מודרנית יותר של צורן, המשמש לליטוש, לשיוף וכחומר קרמי בעל חוזק גבוה. צורן הוא גם הבסיס למשפחת תרכובות הפולימרים סיליקון (Silicone). רוב הצורן הנקי (שאינו חלק מתרכובות כגון סיליקט) משמש כתוסף בעיבוד פלדות וביציקות אלומיניום.
לצורן נקי השפעה ניכרת על הכלכלה העולמית המודרנית, דרך תעשיית המיקרואלקטרוניקה, וזאת אף על פי שהיא צורכת פחות מ-10% מהצורן הנקי סה"כ. השימוש הנרחב בצורן בעל רמות ניקיון גבוהות מאוד בייצור מעגלים משולבים מהווה את הבסיס לרוב המחשבים, עליהם מושתתת מרבית הטכנולוגיה המודרנית.
תכונות
[עריכת קוד מקור | עריכה]תכונות כלליות
[עריכת קוד מקור | עריכה]בצורתו הגבישית, לצורן צבע אפור כהה וברק מתכתי. בשונה ממתכות, הצורן פריך והמוליכות החשמלית שלו נמוכה, ועל כן הוא מסווג כ"דמוי מתכת" (מטלואיד). זהו יסוד אדיש יחסית מבחינה כימית, הוא מגיב עם הלוגנים ומתכות אלקליות, אך אינו מושפע מחומצות (פרט לתערובת חומצה חנקתית וחומצה הידרופלואורית). צורן טהור מעביר 95% מתחום התת-אדום. בצורה זו הוא נמצא לעיתים רחוקות בטבע, ובדרך-כלל מופיע כצורן דו-חמצני (SiO2) הקרוי גם "סיליקה" או כתרכובות של סיליקון, חמצן ויסודות נוספים המכונות סיליקטים.
כמוליך למחצה
[עריכת קוד מקור | עריכה]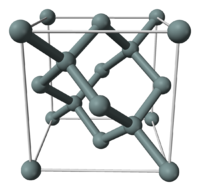
ברוב המקרים כאשר מתייחסים לצורן בהקשרו כמוליך למחצה, מדובר על חד-גביש של צורן. הצורן הוא בעל מבנה גבישי המכונה מבנה יהלום. לחד גביש סיליקון פער אנרגיה לא ישיר של 1.12 אלקטרון וולט בטמפרטורת החדר. פער האנרגיה הלא-ישיר מהווה חיסרון בהתקנים אלקטרו-אופטיים, ואכן ליישומים כגון לייזרים, גלאים, נורות LED ועוד מעדיפים לפעמים להשתמש בחלופות יקרות יותר כגון מוליכים למחצה מורכבים המבוססים למשל על גליום ארסניד, שלהם פער אנרגיה ישיר. פער האנרגיה של הסיליקון תלוי בטמפרטורה (במעלות קלווין) באופן הבא:[1]
צורן נקי מאוד, המכונה גם צורן אינטרינזי, הוא בעל התנגדות חשמלית סגולית גבוהה מסדר גודל של , הנובעת מריכוז נמוך מאוד של נושאי מטען חופשיים, מסדר גודל של 1010 נושאי מטען לסמ"ק. לצורן נוהגים להוסיף מזהמים בריכוזים נמוכים מאוד על-מנת לכוונן את תכונותיו החשמליות בתהליך הנקרא אילוח, או בשמו הנפוץ יותר סימום (doping). הזיהומים מכונים מאלחים או מסממים (dopants). המאלחים הנפוצים ביותר בסיליקון הם היסודות בורון, ליצירת צורן מסוג P, והיסודות זרחן וארסן המשמשים ליצירת צורן מסוג N. באמצעות אילוח ניתן להגדיל את מוליכות הצורן פי מיליארד ויותר.
שימושים
[עריכת קוד מקור | עריכה]תחמוצות צורן הן המרכיב העיקרי בזכוכית, מלט וקרמיקה. בנוסף הצורן מרכיב בסיליקונים (Silicone) ופולימרים על בסיס צורן.


בצורתו החד-גבישית הצורן הוא המוליך למחצה החשוב והנפוץ ביותר בשימוש כיום, ומהווה את הבסיס לרוב השבבים האלקטרוניים. סיליקון משמש גם בתאים סולאריים ממגוון סוגים, הן בצורתו החד-גבישית, וגם במבנה אמורפי (a-Si:H). אף על פי שהצורן פחות יעיל ממוליכים למחצה בעלי פער אנרגיה ישיר בתאים סולאריים, מחירו הנמוך יחסית ובשלות תהליכי הייצור הופכים אותו לאטרקטיבי כלכלית ביישומים רבים של אנרגיה סולארית.
שימושים נוספים
[עריכת קוד מקור | עריכה]- צורן יכול לעיתים להועיל כשהוא מוסף לסגסוגות.
- ייצור ארד, שהוא סגסוגת של נחושת ובדיל.
- שילוב צורן בלייזר יכול ליצור אורך גל עקבי של 456 ננומטר.
- לצורן תכונות שמבטיחות ייצור מסכי LCD ותאים סולאריים בעלות נמוכה.
- ייצור גומי עמיד חומצות.
- בריכוזים נמוכים צורן משמש לעיתים בתור מאלח של גליום ארסניד.
היסטוריה
[עריכת קוד מקור | עריכה]צורן זוהה לראשונה על ידי אנטואן לבואזיה ב-1787, וב-1800 הוגדר בטעות כתרכובת על ידי האמפרי דייווי. ב-1811 ז'וזף לואי גה-ליסאק ולואי ז'אק תנר (Louis Jacques Thénard) הכינו צורן לא טהור באמצעות חימום אשלגן וצורן ארבע פלואורי (SiF4). בשנת 1824 הפיק יונס יעקב ברצליוס צורן טהור לאחר שזיקק את התוצר שקיבלו גיי-ליסק ולואי ז'אק תנר.
מכיוון שצורן הוא יסוד חשוב בתעשיית המוליכים למחצה וההיי-טק, נקרא אזור ההיי-טק בקליפורניה "עמק הסיליקון".
צורן בטבע
[עריכת קוד מקור | עריכה]הצורן הוא היסוד השני בשכיחותו בקרום כדור הארץ (אחרי חמצן), ומהווה 25.7% ממסתו. הצורן מופיע בחול, קוורץ, גרניט, בעיקר בצורת צורן דו-חמצני (הידוע גם בשם סיליקה) או סיליקטים (תרכובות של צורן, חמצן ומתכות שונות). המיקרוביולוג בנימין וולקני גילה כי צורן הוא מרכיב ביולוגי חיוני באצות.
ייצור
[עריכת קוד מקור | עריכה]צורן מופק מסחרית בחימום סיליקה טהורה בכבשן חשמלי, המשתמש באלקטרודות מפחמן. בטמפרטורה העולה על 1900°C, מתרחשת התגובה הבאה:
צורן נוזלי מצטבר בתחתית הכבשן, מנוקז ומקורר. בשיטה זו מתקבל צורן 99% טהור ואחד מתוצרי הלוואי הוא צורן קרביד SiC. על מנת להימנע מתוצר לוואי זה, ריכוז הצורן הטהור נשמר גבוה ואז מתרחשת התגובה הבאה:
טיהור
[עריכת קוד מקור | עריכה]השימוש בצורן בתעשיית המוליכים למחצה דורש ייצור צורן טהור כמה שאפשר, שלא כבשימושים אחרים שבהם אפשר להסתפק באחוזי צורן נמוכים יחסית. שתי שיטות בולטות במיוחד:
טכניקה I
[עריכת קוד מקור | עריכה]טכניקות טיהור צורן ראשוניות התבססו על העובדה שכשצורן ניתך ולאחר מכן מתמצק, המצב המוצק מכיל צורן טהור יותר מהמצב הנוזלי. הטכניקה הראשונה, שתוארה ב-1919 ושימשה בייצור מכ"ם במלחמת העולם השנייה, כללה ריסוק צורן גבישי לאבקה והשרייתו בחומצה. כשצורן נטחן לאבקה, חלקים מזהמים (מרכיבים שאינם צורן) מופנים כלפי הצד החיצוני של גרגרי האבקה ונשטפים עם החומצה.
טכניקה II
[עריכת קוד מקור | עריכה]יותר קל לטהר צורן מתרכובות שלו מאשר מצורתו הגבישית. SiCl4 וSiH4 הן התרכובות השימושיות ביותר וכשהן במצב צבירה גז ונוגעות בצורן בטמפרטורה גבוהה, הן משתלבות איתו ויוצרות צורן טהור. בטכניקה הנפוצה ביותר, שנקראת "תהליך סימנס", מוטות צורן טהורים נחשפים ל-HSiCl3 גזי ב-1150°C. הצורן שבגז מצטרף למוטות הצורן בהתאם לתגובה הבאה:
בשיטה נוספת, הפיקה חברת דופונט צורן טהור ברמה גבוהה כשחשפו SiCl4 לאבץ ב-950°C בהתאם לתגובה הבאה:
בסופו של דבר טכניקה זו נזנחה לטובת "תהליך סימנס" מכיוון שהייתה כרוכה בבעיות רבות.
אמצעי זהירות
[עריכת קוד מקור | עריכה]מחלת ריאות בשם "צורנת" (או "סיליקוזיס") מופיעה אצל כורים, סתתים ושאר אנשים שעבדו ושאפו אבק סיליקה בכמויות גדולות.
קישורים חיצוניים
[עריכת קוד מקור | עריכה]- צורן בWebelements (אנגלית)
- מידע ותמונות על מינרלים המכילים צורן (אנגלית)
- צורן, באתר אנציקלופדיה בריטניקה (באנגלית)
 סיליקון, דף שער בספרייה הלאומית
סיליקון, דף שער בספרייה הלאומית
הערות שוליים
[עריכת קוד מקור | עריכה]| הטבלה המחזורית | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||







