אסטרדיול
 | |
| המבנה הכימי של אסטרדיול | |
|
(8R,9S,13S,14S,17S)-13-Methyl-6,7,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthrene-3,17-diol | |
| תכונות | |
|---|---|
| נוסחה אמפירית | C18H24O2 |
| משקל מולקולרי | 272.38 g/mol |
| מטבוליזם | כבד |
| זמן מחצית החיים |
13-20 שעות בנטילה אוראלית. 8-18 שעות בנטילה תת-לשונית. |
| הפרשה | 54% בשתן 6% בצואה |
אֶסטרָדִיוֹל (estradiol או oestradiol, וכן E2) הוא הורמון סטרואידי השייך לקבוצת האסטרוגן, וההורמון המרכזי מבין הורמוני המין הנשיים. האסטרדיול אחראי על הבדלים פיזיולוגיים רבים בין גברים לנשים, כמו התפתחות רקמת שד ופיזור השומן בגוף. במהלך מחזור החיים האסטרדיול אחראי על מאפיינים נרחבים של ההתבגרות המינית, בהם התפתחות בלוטות חלב במהלך ההיריון ושינויים מבניים ברחם[1]. על אף שרמות ההורמון בנשים גבוהות יותר, והוא מניע תהליכים רבים שקשורים למחזור החיים הנשי, לאסטרדיול תפקיד חשוב גם אצל גברים וחוסר בו יגרום לאין אונות[2]. נוסף על כך, האסטרדיול משפיע על רקמות ואיברים רבים כמו על העצמות, על רקמת העור ועל המוח, והוא בעל מעורבות רבה בתהליכים פסיכולוגים. מלבד אצל בני אדם ושאר יונקים נמצא האסטרדיול גם אצל רוב החולייתנים, אצל דגים, אצל סרטנים ואצל חרקים[3][4]. אסטרדיול, כמו הורמונים סטרואידיים אחרים, נוצר מכולסטרול[5] בעיקר בבלוטת יותרת הכליה, בשחלות ובאשכים[6].
אסטרדיול, בהיותו הורמון סטרואידי, חודר את קרום התא באופן חופשי. לכן בתאים המכילים קולטנים הרגישים לאסטרדיול ההיקשרות תימצא לרוב בתוך גוף התא. לאחר שקולטן נקשר לאסטרדיול, מתבצעת שרשרת ריאקציות ביוכימיות אשר יכולה להשפיע גם על שעתוק הגנים בתא.
ביוכימיה של אסטרדיול[עריכת קוד מקור | עריכה]
מבנה הקולטן[עריכת קוד מקור | עריכה]

ההורמונים הסטרואידים פועלים ברמה גינומית, דרך קישור לרצפטורים המשמשים כפקטורי שיעתוק[7] כמו כן נמצא מסלול פעולה העובר דרך קישור לקולטנים ממברנליים, המשתמש בשליחים שניונים לשם ביצוע השפעות מהירות יחסית בתא[8]. האסטרדיול, כהורמון סטרואידי, פועל גם הוא במנגנון זה. בפרט האסטרדיול הוא אגוניסט לרצפוטורים אשר קרויים ERs - Estrogen receptors (בעברית: קולטני אסטרוגן). שמשתייכים למשפחת הרצפטורים הגרעיניים (NR-nuclear receptor) להורמונים סטרואידים. רצפטורים אלה נקשרים לרצפי ד.נ.א ספציפיים ומשפיעים באמצעות כך על שעתוקם של חלבונים מסוימים בתא[8]. המבנה של ERs בדומה לשאר NRs הוא לרוב קבוע ומורכב מכמה חלקים. ראשית ישנו קצה בעל קבוצה פונקציונלית אמינית, אשר מקושרת לאתר המסומן באותיות A/B שיכול לעורר שעתוק גנים מסוימים ללא הימצאות ליגנד. לאחריו ישנו מתחם המסומן באות C אשר מכיל אזור קשירה לדנ"א (DBD). אתר זה הוא האתר הנפוץ ביותר בין ה-NRs. כמו כן ישנו אתר המסומן באות D אשר מעורב בקישור לחלבוני עקת-חום. לבסוף ישנו מתחם המסומן באות E המכיל את אזור קשירת הליגנד (LBD). אזור זה גם נושא תפקיד ביכולת הפיכה לדימר וביכולת לבצע שפעול בהתקה (transactivation). לאחריו קיים קצה הקולטן שמכיל את הקבוצה הפונקציונלית חומצה קרבוקסילית[8].
לקולטנים לאסטרדיול שני מבנים מרכזיים ידועים. אחד המסומן באות היוונית אלפא ERα והשני באות היוונית בטא ERβ. בין הרצפטורים ישנו דמיון רב באזור קשירת הליגנד, אך קצוות הקולטנים שונים גם באורכם וגם בסוג חומצות האמינו המרכיבות אותם[9]. עוד נמצא שהשוני בין המבנים מוביל להבדלים באפיניות לאסטרוגנים שונים, וברמת התגובה של הקולטנים אל האסטרוגנים. כמו כן, נמצאו הבדלים ברמות הביטוי של שני המבנים ברקמות שונות באדם, אף שברובן שני המבנים מבוטאים[8].
מנגנון הפעילות[עריכת קוד מקור | עריכה]
בגישה הקלאסית בהיעדר הורמון, הרצפטור לאסטרוגן נמצא קשור לקומפלקס חלבונים. קומפלקס המכיל בין היתר סוגים שונים של חלבוני עקת חום. כאשר מתרחשת קשירה בין הליגנד לרצפטור, מתרחש שינוי מבני בקולטן, המשחרר אותו מחלבוני עקת החום. לפי מודל זה, לאחר השחרור הרצפטור יוצר דימר עם עוד קולטן. דימר זה נקשר אל רצפי ד.נ.א ספציפיים המכונים EREs ומשפיע על רמת השיעתוק של הגנים המצויים בהמשך ל-EREs. נתיב השפעה נוסף של ה- ER הוא באמצעות קשרים לא ישירים, בעזרת אינטראקציות חלבון חלבון, עם אתרי שעתוק של פקטורים אחרים[8]. מודלים מאוחרים יותר הצביעו על מורכבויות נוספות במנגנון הפעולה. ראשית נמצא כי שני הרצפטורים יכולים ליצור דימרים ביניהם ולכן ניתן לזהות גם הומודימרים: ERβ•ERβ או ERα•ERα וגם הטרודימרים ERα•ERβ. מבנים אשר פועלים באופן שונה, וביעילות שונה על אותם רצפי ד.נ.א. נתיב הפעולה נגרם על ידי שונות בליגנדים הנקשרים אל אזור E ברצפטורים[10][11][12]. כמו כן נמצא כי ERs מסוגלים לתקשר באמצעים ביוכימיים, ואף ליצור דימרים, עם חלבוני שעתוק ממשפחות שונות[13][14][15]. בנוסף, הרצפטור לאסטרוגן יכול לעבור שינויים מבניים לאחר תרגום המשפיעים על פעילותו[16][17]. לדוגמה נמצא שהקולטן מסוגל להיות פעיל גם ללא נוכחות אסטרוגן באמצעות אינטראקציה עם פקטורי גידול כמו IGF-I או EGF. אם יימצא אסטרוגן בתא ההשפעה תוגבר עוד יותר. פעילות פקטורי הגידול על הקולטן מתווכת על ידי זירחון באמצעות MAP kinase pathway (אנ') במתחם A/B בשני סוגי הרצפטורים[18]. אתרי זרחון נוספים התגלו גם באזורים אחרים על הרצפטור כמו באזור קשירת הליגנד או באזור הקשירה של הרצפטור ל-DNA. מורכבות נוספת שנמצאה היא שלא כל מקטעי ה-ד.נ.א אשר מווסתים על ידי ERs מכילים את רצפי ה-DNA הקלאסיים של ההיקשרות (ERE)[19][20].
ייצור האסטרדיול בגוף[עריכת קוד מקור | עריכה]
95% מהאסטרדיול בנשים בגיל הפוריות מיוצרים בתאי גרנולוזה בזקיקי השחלה על ידי ארומטיזציה של אנדרוגנים. ראשיתו של התהליך בביקוע שרשרת צדדית של כולסטרול בבלוטת יותרת הכליה או בתאי התקה (theca) הפנימית בזקיק השחלה ליצירת פרגננולון, אשר בסדרה של תהליכים ביוכימיים הופך לאנדרוגנים אנדרוסטנדיון ולטסטוסטרון. האנדרוגנים מגיעים לתאי הגרנולוזה, שם האנזים ארומטאז הופך אנדרוסטנדיון לאסטרון וטסטוסטרון לאסטרדיול. פעולתו של הארומטאז מבוקרת על ידי הפרשת הורמון מגרה זקיק (FSH), הנקשר בתאי הגרנולוזה לקולטן המצומד לחלבון G, ובכך מפעיל סדרה של תהליכים ביוכימיים שמאפשרים את פעולתו של הארומטאז. אסטרון אף הוא יכול להפוך לאסטרדיול באמצעות האנזים 17β-הידרוקסיסטרואיד דהידרוגנאז. מקורות נוספים לייצור אסטרדיול הם רקמת שומן, בפרט בגיל המעבר, וכן בעור בדופנות העורקים ובמוח. כמו כן, כמויות קטנות יותר של אסטרדיול מיוצרות גם כן על ידי קליפת בלוטת יותרת הכליה, ובגברים באשכים[5][21].

מטבוליזם[עריכת קוד מקור | עריכה]
בפלזמת הדם אחוז האסטרדיול החופשי הוא קצת מעל 2%, והוא נשאר באופן זה לכל אורך המחזור החודשי[22]. כאשר האסטרדיול נמצא בצורה לא חופשית, הוא קשור לחלבונים נשאים, בעיקר אלבומין וגלובולין קושר הורמוני מין (SHBG), כאשר היחס הוא בקירוב 60% אל מול 38% בהתאמה[23][24]. כאשר ישנה פעילות יתר של אסטרדיול, תתרחש שרשרת פעולות ביוכימיות, אשר בסופה האסטרדיול יומר להורמון אסטרוגני פחות פעיל כמו אסטרון או אסטריול, כאשר אסטריול הוא ההורמון האסטרוגני הנפוץ ביותר בשתן. דרך נוספת היא התמרה כימית בכבד באמצעות חיבור עם מולקולות אחרות, שהופכות את האסטרדיול ללא פעיל, כגון חיבור עם סולפט ליצירת מולקולת אסטרדיול-סולפט או עם חומצה גלוקורונית ליצירת אסטרדיול גלוקורוניד. מולקולות אלו יופרשו מהכליות. אחדות מהמולקולות הנוצרות מקשרים עם אסטרדיול הן מסיסות במים. מולקולות אלו לרוב יופרשו דרך צינור המרה, וחלקם ייספגו מחדש לאחר שיעברו פירוק באמצעות הידרוליזה במעי. לעיתים יתבצע קישור של אסטרדיול עם מולקולת אסטר, אשר תוצר התגובה שלו יהיה אסטרדיול שומני, אשר יאוחסן ברקמת שומן לשימוש ארוך טווח[25].
תפקידים ביולוגיים[עריכת קוד מקור | עריכה]
התפתחות מינית[עריכת קוד מקור | עריכה]

לאסטרדיול תפקיד חשוב ביצירת ההבדלים המשניים בין גברים לנשים[6][26][27]. שינויים מבניים בין גברים לנשים מתחילים להופיע בתקופת ההתבגרות המינית, בה צמיחת השד אצל נשים מוגברת, ופיזור השומן בגוף משתנה[28], שינויים אלה נשארים קבועים יחסית לכל אורך תקופת הפוריות. כאשר נשים מגיעות לגיל המעבר הבדלים אלו מתחילים להצטמצם, וזאת כתוצאה מירידה משמעותית ברמת האסטרדיול בגוף האישה[26][27]. אצל גברים, לעומת זאת, עם השנים דווקא עולה רמת האסטרוגן בגוף, מה שגורם בגילאי הזקנה לגדילה ברקמת השד ובבלוטת הערמונית[2]. אסטרדיול גם גורם להתפתחות איברי המין הנשיים לכדי בשלות והוא אף אחראי באופן עקיף על קצב הגדילה המואץ בגיל ההתבגרות, זאת באמצעות הגברת הפרשת הורמוני הגדילה[29] . בנוסף לכך האסטרדיול אחראי על עצירתה של הגדילה[6].
המחזור החודשי וההיריון[עריכת קוד מקור | עריכה]
 ערך מורחב – המחזור החודשי
ערך מורחב – המחזור החודשי ערך מורחב – היריון
ערך מורחב – היריון
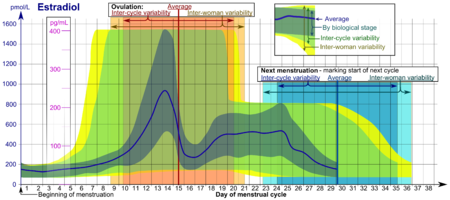
רמות האסטרדיול בדם אצל נשים בתקופת הפוריות משתנה בין שלבי המחזור השונים. למחזור חודשי תקין ארבעה שלבים עיקריים: השלב הווסתי בו מתרחש דימום מהנרתיק, השלב הפוליקולרי בו מתפתח הזקיק, שלב הביוץ והשלב הלוטאלי, בו מתפתח הגופיף הצהוב. במהלך מחזור חודשי תקין, רמות אסטרדיול הנמדדות בעת הווסת נמוכות מ-50 פיקוגרם למיליליטר, ולאחריו הן עולות עם התפתחות הזקיק השחלתי עד לאזור 400 פיקרוגרם למיליליטר עד לביוץ, ולאחריו הן יורדות. בשלב הלוטאלי, החל מיום 17 למחזור, מתחילה שוב עלייה ברמת האסטרדיול אשר מגיעה ביום ה-20 למחזור לרמה של 160 פיקוגרם למיליליטר, אשר נשמרת יחסית קבועה עד היום ה-24 למחזור. לאחר היום ה-24 חלה שוב ירידה ברמות האסטרדיול אשר מגיע למינימום בימי הווסת.
במהלך ההיריון, לקראת מועד הלידה, חלה עלייה של כלל האסטרוגנים וביניהם האסטרדיול. בניגוד לאסטרוגנים הנמצאים בגוף האישה שלא בהיריון, אשר מקורם בעיקר בשחלות, מקור האסטרוגנים אצל אישה בהיריון הוא הרקמה השלייתית. לתנודות ברמות האסטרוגנים בתקופת ההיריון מייחסים כמה תפקידים, ביניהם סיוע להולכת הדם ברחם המתפתח, להגדלת השדיים לקראת הלידה, להגברת האלסטיות של צוואר הרחם, וכן לסיוע בתהליך כיווץ הרחם בשעת הלידה המתווך באמצעות ההורמון אוקסיטוצין.
הכבד[עריכת קוד מקור | עריכה]
אסטרדיול מעורב בתהליך ייצור הליפופרוטאינים בכבד. מלבדם האסטרדיול מעורב גם בייצור גורמי קרישה ושאר חלבונים הקשורים למערכת הדם. כאשר רמות האסטרדיול בכבד גבוהות מן הרגיל, הדבר יכול להוביל לעימדון מרה (כולסטאזיס), מחלה שבה נוצרת חסימה של זרימת המרה בתוך הכבד, כיוון שהמטבוליט הגלוקורוניד של אסטרדיול מפחית את כמות מלחי המרה הנספגים על ידי תאי הכבד. תופעה זו נפוצה במיוחד במהלך היריון, כיוון שבמהלך ההיריון רמות ההורמונים האסטרוגניים, ובכללם האסטרדיול, עולות בצורה חדה.
מערכת השלד[עריכת קוד מקור | עריכה]

לאסטרדיול תפקיד חשוב בוויסות גדילת העצם, הסחוסים והמפרקים. האסטרדיול מעורב בתהליך סגירת סחוס הגדילה, וכאשר ישנו חוסר באסטרדיול ושאר הורמונים אסטרוגניים, עלול התהליך להתעכב ואף לא להתרחש כלל. אדם הלוקה בחוסר שכזה עלול לסבול מבקרת גדילה לקויה, העשויה לבוא לידי ביטוי בגביהה מתמשכת, באורך גפיים חריג, ובפרופורציות אנורמליות בין פלג הגוף העליון והתחתון. כמו כן, לאסטרדיול השפעה על צפיפות העצם, ולכן הוא מעורב בדלדול עצם[30]. בהתאמה לכך ניתן לראות אצל נשים שינויים בצפיפות העצם בהתאם לשינויים ברמות ההורמונים האסטרוגניים בשלבי המחזור השונים[31].
רקמת העור[עריכת קוד מקור | עריכה]
על רקמת העור נמצאים קולטנים להורמוני מין כמו אסטרדיול ופרוגסטרון. ממחקרים עולה כי הורמונים אלו מעורבים בתהליכים המקנים לרקמת העור אלסטיות וחוזק. ממחקרים שהשוו בין גיל המעבר לתקופת הפוריות תוך מתן אסטרדיול לשתי הקבוצות נמצא כי הירידה בהורמוני המין גורמת להאצה בתהליכים הגורמים לדלדול העור, ביצירת קמטים ובחוסר גמישות העור. כמו כן, נצפו שינויים מבניים בתאי העור הכוללים הבדלים ברמה הביוכימית של מרכיבי התאים ושל זרימת הדם לתאי העור[32][33]. כיום ישנם טיפולים המנסים לעכב את התוצאות הללו באמצעות מתן הורמונים סינתטיים אשר נמצאו מועילים בחלק מהמקרים לצמצום התופעה[33][34].
תפקידים פסיכוביולוגיים[עריכת קוד מקור | עריכה]
מחקרים על חיות מעבדה הראו כי ישנם קולטנים לאסטרדיול באמיגדלה, בהיפוקמפוס, בהיפותלמוס ובקליפת המוח[35][36]. בנוסף לכך ישנן עדויות רבות שלאסטרדיול יש השפעה על מערכות דופמינרגיות[37] ועל מערכות סרוטונרגיות[38]. מערכות אלה מעורבות במערכת הגמול ובבסיס הביולוגי של ויסות מצבי רוח, ואכן במחקרים רבים נמצא כי להורמוני המין אסטרדיול ופרוגסטרון תפקיד בתהליכי למידה חברתיים כמו למידה מהאחר, בהערכה חברתית, במצבי חרדה ובדפוסים של התנהגות תוקפנית[39][40][41]. כמו כן, אסטרוגן מגביר את פעילות ההורמון אוקסיטוצין המעורב ביצירת קשרים חברתיים[42].

מערכות למידת פחד ודיכאון[עריכת קוד מקור | עריכה]
מכיוון שנשים נוטות פי שניים מגברים ללקות בחרדה[44], ניתן להניח שלהורמוני המין תפקיד בבקרת המערכות הביולוגיות העומדות בבסיס הפתולוגיות מן הסוג הזה. מצבי התודעה העומדים בבסיס הפתלוגיות האלו קשורים בין היתר לתהליכי למידה ושכחה של פחד, ואכן נמצא שהמנגנונים העומדים בבסיס תהליכי שכחה של פחד פועלים ביתר שאת כאשר רמות האסטרדיול בגוף האישה גבוהות[45][46], ובהתאמה תהליכי הלמידה של תגובת פחד לגירוי נמצאו מוגברים כאשר רמות האסטרדיול היו נמוכות[47]. אחד המנגנונים המרכזיים האחראי על וויסות רגשי של תגובות, הוא המעגל בין אזור בקליפת המוח הקדם-מצחית, שלרוב גורם לדיכוי פעילות האמיגדלה ונקרא "קליפת המוח הקדם-מצחית הגחונית-אמצעית" לבין האמיגדלה. במחקרים נמצא כי כאשר רמות האסטרדיול גבוהות, מעגל זה מראה פעילות מוגברת תחת סריקות מוח[48][46]. כמו כן, מעגלים נוספים המעורבים בוויסות פעילות האמיגדלה כמו המעגל בין פיתול החגורה הקדמי (ACC) ובין קליפת המוח הקדם-מצחית הגבית-צדית (dorsolateral PFC) הראו בעת תהליכי שכחה גם הם פעילות מוגברת[49], ובנוסף לכך נמצאה גם קישוריות גבוהה יותר בין האמיגדלה לבין האונה הקדם-מצחית במצב מנוחה אצל נשים עם רמות אסטרדיול גבוהות, מה שיכול להעיד על עלייה ביכולות הוויסות הרגשי, ומנגד אצל נשים בעלות רמות נמוכות של אסטרדיול נמצא כי ישנה קישוריות גבוהה יותר בין האמיגדלה ל-ACC, קשר המזוהה עם הגברה של השפעות שליליות על המוח[50]. מן הצד המשלים, אזורים המזוהים עם פעילות מוגברת כתגובה לגירוי בעת כניסה למצבי לחץ וחרדה כמו ההיפותלמוס, ההיפוקמפוס, האמיגדלה וה-ACC הראו פעילות מוחלשת[51][52].
מערכת התגמול[עריכת קוד מקור | עריכה]
אסטרדיול מעלה את כמות ההורמון דופמין במוח[37], וממחקרים נמצא כי הורמוני שחלה מעורבים ברגישות של מערכת התגמול במוח לנוכח סמים וכסף. היחסים בין המערכות מורכבים ומשתנים בין שלבי המחזור השונים[53], אך הצד השווה ביניהן הוא שעלייה בכמות האסטרדיול מעלה את הרגישות לצריכת סמים וקבלת כסף[54], ואילו עלייה ברמות הפרוגסטרון מפחיתה את הרגישות[55].
זיהוי רגשות ואמפתיה[עריכת קוד מקור | עריכה]
ישנו חוסר בספרות רחבה על השפעת הורמוני שחלה על זיהוי רגשות ואמפתיה, אך ממספר מחקרים עולה כי הורמונים אלה מעורבים בפונקציות חברתיות רבות הכוללות הערכה של רגשות הזולת ותחושת הזדהות עם האחר. נמצא כי לרמת האסטרדיול יש יחס הפוך ליכולות זיהוי הרגשות של הזולת[56][57]. בנוסף על כך נמצא כי תנודות במספר הקולטנים (ER) לאסטרדיול, הנובעות מהבדלים גנטיים, מעורבות בתהליכים חברתיים אלה[58]. כמו כן במחקר אשר נתן לגברים מנת אסטרדיול נמצא כי חלה עלייה בתגובות האוטונומיות לכאב אדם אחר מה שמעיד כנראה על מעורבות גם במנגנון תחושת האמפתיה[59].
השפעות על העדפת בני זוג[עריכת קוד מקור | עריכה]
אחד הנושאים הנחקרים ביותר בתחום של התנהגות חברתית תלוית הורמוני המין הוא התנהגויות הקשורות לרבייה. אחד הממצאים המתוקפים ביותר הוא שינויים בהעדפות בבחירת בני זוג. נמצא כי כאשר רמות האסטרדיול והטסטוסטרון בגוף האישה גבוהות, ישנה העדפה גבוהה באופן מובהק למאפיינים גבריים הכוללים גוף[60] ותווי פנים גבריים[61], כמו גם לגון קול גברי[62], לריחות גבריים[63] ולהתנהגות הנחשבת גברית[64]. ישנם חוקרים התולים זאת בצורך בתמיכה חברתית, במהלך ההיריון או במצב בו הגוף מתכונן להיריון במהלך השלב הלוטאלי[65]. כתוצאה מכך ישנם שינויים בהעדפה לתכונות בן הזוג לאורך המחזור, בהתאמה לשינויים בהורמוני המין המווסתים את ההתנהגות החברתית במהלך המחזור.
הבדלים ברמה המוחית[עריכת קוד מקור | עריכה]
נמצא כי אסטרדיול מגביר את הרגישות לגירוי מיני או גברי. במחקרים נמצאה קורלציה חיובית בין רמות האסטרדיול לבין תגובות קליפת המוח הארובתית-מצחית, אזור האחראי בין היתר על הגברת העוררות הפיזיולוגית ולתחושת חיבה בחשיפה לפנים גבריות[66]. יתר על כן נמצאה עלייה בתגובתיות ה-PCC, אזור הנמצא באזורים לימביים שמזוהה עם הגברת המוטיבציה והקשב, שכנראה אחראי על הגברתם לנוכח פנים גבריות[67]. בנוסף לשניים האחרונים נצפתה גם עלייה ברגישות מערכת התגמול לנוכח גירויים מסוג זה. הגברת אזורים אלו כתגובה לגירויים גבריים או מיניים חשובה ליזימה של אינטראקציות חברתיות, ומאפשרים את התנודתיות בהעדפות תכונות בן זוג, בתחושת שביעות רצון, ובחשק המיני לאורך המחזור החודשי.
נוטלות גלולות[עריכת קוד מקור | עריכה]
אצל נוטלות גלולות התנודתיות בהעדפות בן הזוג נעדרת, או אף נוטה לגרום העדפה של תכונות נשיות אצל בן הזוג[61][68][69]. זאת כנראה כתגובה לדיכוי התנודות הטבעיות של הורמוני המין אסטרדיול ופרוגסטרון וכן לדיכוי רמות הטסטוסטרון[70][71]. נוסף על כך נצפתה ירידה בתגובתיות לגירויים מיניים בכלל[72], מה שיכול להוות הסבר ביולוגי לירידת הליבידו אצל נוטלות גלולות[73]. ברמה המוחית תגובתיות האינסולה הפנימית, אזור המזוהה עם כימות התגמול בעקבות גירוי מיני[74], ותגובתיות הפיתול הקדם מרכזי (precentral gyrus), אזור בקליפת המוח המעורב בהעלאת העוררות הפיזיולוגית בעקבות גירוי מיני[75], ירדה משמעותית אצל נוטלות גלולות[76]. בהתאם לירידה בפעילות, נשים המפסיקות ליטול גלולות במהלך הנישואים נוטות יותר לדווח על חוסר שביעות רצון מבן זוגם, במקרה שהוא יחסית לא מושך מינית, ולהפך כאשר הוא יחסית גבר מושך, ביחס לנשים אחרות[77]. בנוסף לכך נטילת גלולות עלולה לגרום להגברת קנאה ולהפחתת התנהגות המושכת את בן הזוג[78][79], להפחתת שביעות רצון מינית ומשיכה לבן הזוג[80][81]. יתר על כן נצפתה ירידה ברגישות הסטריאטום למתן אוקסיטוקצין בזמן צפייה בתמונות בני הזוג של הנשים[82], ירידה המתבטאת בירידת הרגישות של מערכת התגמול לנוכח מראה חיצוני של בן הזוג, מה שיכול להוות את המנגנון לירידה בשביעות הרצון ממנו. הרגישות אצל נוטלות גלולות לנוכח פני תינוק חמוד דווקא עלתה[83]. תגובה בעלת דפוס דומה לזו נצפתה אצל אבות אשר אצלם רמות הטסטוסטרון היו נמוכות, דפוס זה יכול לגרום להגברת התנהגות הורית כלפי התינוק[84].
מחלות המקושרות לאסטרדיול[עריכת קוד מקור | עריכה]
אי רגישות לאנדרוגנים[עריכת קוד מקור | עריכה]
 ערך מורחב – תסמונת חוסר הרגישות לאנדרוגן
ערך מורחב – תסמונת חוסר הרגישות לאנדרוגן
במקרים בהם ישנה מוטציה על כרומוזום X המונעת ייצור של קולטנים להורמונים אנדרוגנים כגון טסטוסטרון, עוברים בעלי גנוטיפ זכרי XY יבטאו פנוטיפ חיצוני נקבי זאת כיוון שהאנדרוגנים הגורמים לעובר להתפתח למערכת זכרית אינם נקלטים. לתופעה זאת קוראים תסמונת חוסר הרגישות לאנדרוגנים באופן מוחלט. עם זאת הורמונים אנטי מולרייאנים הגורמים לעצירת ההתפתחות העוברית לעבר מערכת נשית כן נקלטים בתאי העובר, וכתוצאה מכך העובר לא יפתח אברי מין פנימיים נשיים. האנדרוגנים המשוחררים אשר לא נקלטים בתאי המטרה משמשים כחומר מוצא לאנזים ארומטאז, ובאמצעותו יעברו ארומטיזציה לעבר אסטרוגנים. אסטרוגנים אלו אחראים על התפתחות מאפיינים נקביים משניים עם ההתבגרות, לחוסר צמיחת שיער גוף ולפיתוח שד כך שעל אף הגנוטיפ הזכרי נראים הלוקים במחלה באופן חיצוני כנקבות[85]. אי לכך אחת האפשרויות לאבחן את התסמונת היא באמצעות בדיקת הורמונים[86], כיוון שלסובלים מן המחלה יש כמויות של אסטרדיול ושל טסטוסטרון מעל לנורמה[86][85].
אי רגישות לאסטרוגנים[עריכת קוד מקור | עריכה]
התסמונת אי-רגישות לאסטרוגנים מתרחשת כתוצאה ממוטציה הפוגעת בפעילות הקולטנים לאסטרוגנים ER. בעקבות המוטציה אין האסטרוגנים יכולים לפעול את פעולתם הביולוגית ולכן התופעה מלווה בעקרות. כיוון שאין האסטרוגנים קובעים את מין העובר אלא רק אנדרוגנים והורמונים אנטי מולריאנים בשילוב עם החלבון DTF המחלה פוגעת הן בזכרים והן בנקבות. לקויות רבות נצפו אצל הלוקים בתסמונת, ביניהן ניתן למנות: אי עצירת הצמיחה לגובה, צפיפות עצם אנורמלית, אקנה חמורה בפנים וחוסר בסממני מין משניים. תסמונת זו נדירה ביותר[87][88] והיא מורשת בצורה אוטוזומלית רצסיבית. נושאי המוטציה אינם פוריים ובספרות המחקרית ישנם רק שלושה דיווחי מקרה על חמישה פרטים[88].
סכיזופרניה[עריכת קוד מקור | עריכה]
 ערך מורחב – סכיזופרניה
ערך מורחב – סכיזופרניה
סכיזופרניה היא הפרעה נפשית כרונית, השייכת לקבוצת ההפרעות הנפשיות הפסיכוטיות. הפרעה זו מתאפיינת בהזיות, מחשבות שווא, הפרעות בארגון הדיבור והחשיבה, צמצום רגשי, פגיעה בהנאה ובכוח הרצון והיוזמה (initiative), בעיות קוגניטיביות (בזיכרון, קשב, פונקציות ניהוליות וכו'), התנהגויות מוזרות המוסברות על ידי החוויות הפנימיות החריגות (ההזיות, מחשבות השווא) ועל ידי שיבושי מערכות בקרה (קוגניטיביות), קשיים תפקודיים רבים בתחום התעסוקתי והחברתי[89]. ישנם הבדלי מגדר שתוארו עוד בתחילת המאה ה-19[90] ורלוונטיים גם כיום[91][92], אשר מקושרים להבדלים ברמות האסטרדיול הטבעיות בין גברים לנשים. ישנו סיכוי נמוך יותר לנשים עד גיל הבלות ללקות במחלה, וכן הנשים אשר לקו עד גיל הבלות סובלות מתסמינים פחותים ביחס לגברים[92]. דבר זה מתבטא בין היתר בירידה תפקודית מופחתת, אחוז הנישואין גבוה יותר, משך האשפוז קצר יותר ומספר האשפוזים קטן יחסית. ככל הנראה הגורם הסיבתי לדבר הוא הרמות הגבוהות של האסטרדיול בתקופה זו, אשר בעודף תורמות למנגנונים המווסתים את ההתנהגות הפתולוגית, ומנגד בחוסר מקנות פגיעות יתר למחלה[90][93]. נשים מתאשפזות יותר סביב זמן קבלת הוסת, זמן אשר מאופיין ברמות אסטרדיול נמוכות. והתסמינים הפסיכוטים נמצאו ביחס הפוך לרמות האסטרדיול[94]. המנגנונים המוצעים להסבר התופעה מתבססים על המצאות נרחבת של רצפטורים לאסטרוגן באזורים קריטיים במחלת הסכיזופרניה, כאשר ההשערה היא שהאסטרדיול באמצעות היקשרות לרצפטורים אלו מווסת את ההפרעה לתפקוד אזורים אלו[91].
אפילפסיה וסתית[עריכת קוד מקור | עריכה]
 ערך מורחב – אפילפסיה וסתית
ערך מורחב – אפילפסיה וסתית
אפילפסיה וסתית היא תת-סוג של אפילפסיה, מחלה נוירולוגית כרונית המאופיינת בהתקפי פרכוס חוזרים ונשנים[95]. מחלה זו כתת-סוג של אפילפסיה תוארה כבר ביוון העתיקה[96], כאשר היא כוללת רק נשים אשר הגירוי להתקפים שלהן קשור במחזור החודשי. נשים שיש להן אפילפסיה וסתית רגישות, בדרך כלל לשינויים הורמונליים אנדוגניים. לגירוי התקפים זה יש מתאם סטטיסטי מובהק לרמת אסטרדיול/אסטרוגן וליחס ביניהם[97]. המנגנון המוצע לסיבת המחלה קושר בין המערכת הגבארגית, אשר לרוב מאפיינת בעיכוב ירי נוירונלי, לאסטרדיול. זאת משום שאסטרדיול ידוע כמדכא את המוליך העצבי GABA וכתוצאה מכך הוא מסווג כמעורר הצתה ויריות אפילפטיות[98].
פקקת ורידים[עריכת קוד מקור | עריכה]
 ערך מורחב – פקקת ורידים
ערך מורחב – פקקת ורידים
פקקת ורידים המחלה המאופיינת בהיווצרות קרישי דם שלא לצורך בתוך מערכת הוורידים בגוף. וקרישי דם בוורידים אלו פוגעים בהספקת הדם המובל בורידים, ובתפקוד איברי היעד. נוסף לכך חלקים מקרישי דם אלו עלולים להיסחף עם זרם הדם לאיברים חיוניים כמו הלב, המוח, והריאות. ואף לגרום למוות. ידוע בספרות כבר שנים רבות כי מתן אסטרדיול באופן חיצוני כמו בצורת טיפול הורמונלי לאחר גיל הפוריות[99][100], טיפול לשינוי מין[101][102] או בצורת גלולות[103][104] מעלה סיכון לפקקת ורידים, דבר זה תוקף על ידי מטא-אנליזה אף לגלולות מן הדור השלישי[105]. המנגנון בו האסטרדיול גורם לכך ככל הנראה קשור לכך שההורמון מעלה את רמות גורמי הקרישה בדם[106][107], ומוריד את רמות נוגדי הקרישה[106][107].
טיפול הורמונלי לטרנסג'נדרים[עריכת קוד מקור | עריכה]
לנשים טרנסיות אשר בעלות זהות ביולוגית זכרית מוצע לקחת טיפול הורמונלי הכולל לרוב שילוב של הורמונים אסטרוגנים וחוסמי טסטוסטרון. זאת על מנת לגרום לשינויים פיזיולוגים, התורמים להתאמה המגדרית של הפרט. השפעות הטיפול מתבטאות באופן הדרגתי על פני חודשים ושנים וכוללות: הפחתת הקשיחות העורית[108], שינוי ריחות הגוף[108], הגדלת החזה[109], התפתחות התפלגות שומן נשית[109], שינוי מראה הפנים[108], הקטנת מסת השריר והכוח הפיזי[108], שינוי בסמיכות שיער הראש[109], הפחתה במספר, משך ונוקשות הזקפות ושינויים בדפוסי הליבידו[108] . עם זאת ישנם סיכונים רבים הכרוכים בהליך: ישנם סיכויים לפגיעה משמעותית בתפקודי הכבד[110], לעליה בלחץ הדם ובקרישיות הדם[101][102], לסיכון מוגבר לשבץ[101][102] וסכרת[108], מופיעה ירידה בפוריות[110] בחלק מהמקרים בעקבות הטיפול מתרחשת עקרות[108].
פסיכוזה שלאחר לידה[עריכת קוד מקור | עריכה]
 ערך מורחב – פסיכוזה שלאחר לידה
ערך מורחב – פסיכוזה שלאחר לידה
פסיכוזה שלאחר לידה (באנגלית: Postpartum psychosis) היא הפרעה נפשית המאופיינת בסימני פסיכוזה אצל האם לאחר הלידה. התסמונת מתוארת על ידי הופעת תסמיני דיכאון, מחשבות שווא ומחשבות של האם לפגוע בעצמה או בתינוק. ההנחה היא שהפסיכוזה היא למעשה אפיזודה של הפרעת מצב רוח דו-קוטבית או דיכאונית. לרוב הסובלות מן המחלה מדווחות תחילה על עייפות, נדודי שינה וחוסר רוגע, לעיתים מופיעים התקפי בכי ותחושת אי יציבות רגשית כללית. לאחר מכן מתפתחת פסיכוזה הכוללת פרנויה, בלבול, התנהגות חסרת סדר ומשמעות, אמירות לא רציונליות ודלוזיות הקשורות למצב בריאותו של התינוק ולרווחתו[111]. לעיתים יש מחשבת שווא שהתינוק בעל מומים. לעיתים המטופלות מכחישות את הלידה, ומציינות כי הן לא נשואות או בתולות. לעיתים יש הזיות שמיעה המורות לאם להרוג את התינוק או את עצמן. כמו כן מתוארות תלונות על חוסר יכולת ללכת, לעמוד או לנוע. רמות ההורמונים האסטרוגנים ובכללם אסטרדיול עולות בסמוך ללידה לרמות גבוהות בהרבה מהתקופה הלא הריונית, מקור אסטרוגנים אלו מצוי בשליה המזינה את העובר, אשר מפרישה אותם לגוף האם. בתהליך הלידה לאחר צאת התינוק נפלטת השליה, ועם תהליך זה יורדות בצורה חדה רמות ההורמונים האסטרוגנים. לכן מנגנון אפשרי לסיבת התפתחות הפסיכוזה שלאחר לידה, ולשאר הבדלי מצב רוח קיצונים שמאפיינים תקופה קריטית זו, הוא השינויים ברמות הורמונים אלו. ואכן מחקרים קליניים הראו כי מתן אסטרדיול לאחר הלידה מקטין את התסמינים הפסיכוטיים אצל נשים הלוקות בפסיכוזה לאחר לידה[112][113]. דבר זה מחזק את ההשערה כי הירידה בכמות האסטרוגנים היא העומדת בבסיס הביולוגי ליצירת הפסיכוזה[114] ככל הנראה בעקבות השפעת האסטרדיול על המערכת הסרוטונרגית[114], מערכת ביוכימית במוח אשר מעורבת בפסיכוזה שלאחר לידה, אשר ידוע כי האסטרדיול משפיע על פעילותה[115].
טיפולי פוריות[עריכת קוד מקור | עריכה]
במקרים בהם יש לאישה הרוצה להיכנס להריון בעיות בהליכי הביוץ מסיבות הורמנליות במקרים רבים פתרון אפשרי הוא שימוש בחומרים משרי ביוץ. אחד החומרים הנפוצים בתחום הוא קלומיפן ציטרט, חומר החוסם את הקולטנים במוח האישה לאסטרוגנים וביניהם לאסטרדיול, ובכך גורם לשחרור מוגבר של FH ו-FSH המשפעלים את תהליכי הביוץ. בנוסף במקרים בהם הסביבה הרירית של צוואר הרחם אינה מספיק מפותחת, ניתנים גם הורמונים אסטרוגנים על מנת לפתח את הרירית, ובכך לסייע להליך הקליטה של תאי הזרע[116].
הפריות חוץ גופיות[עריכת קוד מקור | עריכה]
במקרים בהם נצרכת הפריה חוץ גופית לעיתים ניתן טיפול הורמונלי לפני שאיבת הביציות, המשתמש בתרופות המדמות הורמונים גונדוטרפינים. תרופות אלו גורמות להשראת ביוץ באופן מלאכותי על השחלות בצורה בה יותר מזקיק אחד יחל בהליך ההבשלה. בשל השימוש בתרופות משרות ביוץ עלול להתרחש הליך פתלוגי הנקראת תסמונת גירוי יתר שחלתי (OHSS – Ovarian Hyper Stimulation Syndrome). תסמונת זו מתרחשת כתוצאה מגירוי יתר של השחלה לצורך הגברת מספר הביציות, באופן בו קיים מספר רב של זקיקים אשר כל אחד מהם מפריש אסטרוגנים ומביא למנגנון פתולוגי שבו קיימת עליה בחדירות הנימים, אובדן נוזל לחלל הבטן, היווצרות מיימת וסיבוכים נוספים. גורם סיכון למחלה הוא רמות גבוהות של אסטרדיול לאחר מתן חומרים משרי ביוץ.
גיל המעבר[עריכת קוד מקור | עריכה]
טיפול הורמונלי בגיל המעבר[עריכת קוד מקור | עריכה]
אנורקסיה[עריכת קוד מקור | עריכה]
סרטן[עריכת קוד מקור | עריכה]
סרטן השד[עריכת קוד מקור | עריכה]
סרטן השחלה[עריכת קוד מקור | עריכה]
אי ספיקה שחלתית מוקדמת[עריכת קוד מקור | עריכה]
דלדול עצם[עריכת קוד מקור | עריכה]
גילוי האסטרדיול[עריכת קוד מקור | עריכה]

את האסטרדיול גילו במקביל החוקרים אדוארד אדלברט דויזי, ביוכימאי אמריקאי מאוניברסיטת אוניברסיטת וושינגטון בסנט לואיס בשיתוף עם אדגר אלן ביולוג אמריקאי מאוניברסיטת מיזורי, והחוקר הנאצי אדולף בוטנאנדט[117], אשר קיבל על תגליתו פרס נובל לכימיה לשנת 1929[118].
בתחילת המאה העשרים ביולוג בשם אדגר אלן חקר את מחזור הייחום בעכברים, כבר אז הצטבר ידע רב על השינויים המתרחשים ברחם לאורך הייחום מה שהכין את הקרקע לתגלית הורמוני המין. באחד הימים הבחין אלן כי קיים קשר בין שינויים בזקיקי השחלה ובתריסריון, לבין שינויים היסטולוגים ברחם של עכברות. אי לכך הניח אלן כי השחלות מפרישות הורמונים. כדי לבחון את הרעיון, הלך אלן למפעל לאריזת בשרים והשיג זקיקי שחלה של חזירים. את הנוזל המצוי בזקיקי השחלה הוא חילץ מן הזקיקים, ולאחר מכן הוא הזריק את החומר לעכברים וחולדות שטרם התבגרו מינית. מאוחר יותר הבחין אלן כי בעקבות ההזרקה הרחם של המכרסמות עורר בצורה המאפיינת את תהליך ההתבגרות המינית. ממצא זה אישש את ההנחה כי קיימים הורמונים המווסתים תהליכים מיניים המופרשים מהשחלה[117].
אלן ניסה לזקק מנוזל הזקיקים את החומר הפעיל, קרי את ההורמון, אשר גורם לשינויים שנזכרו לעיל, אך עבודתו זו לא נשאה פרי. אלן פנה אל שכנו הביוכימאי אדלברט דויזי עם בעיית הזיקוק. דויזי באותו הזמן התעסק בזיקוק אינסולין, אך אלן הצליח לשכנע אות לקחת על עצמו את הניסיון לבודד את ההורמונים השחלתיים. במחקרו דוזי נתקל בעבודתם של החוקר הגרמני-ישראלי ברנרד צונדק ושותפו למחקר סלמאר אסחיים (Selmar Aschheim), אשר גילו כמות גדולה של חומרים אסטרוגניים בשתן של נשים הריוניות. דויזי הבין כי מחקר המבוסס על בידוד הורמוני המין יתאפשר ביתר קלות אם יעבור ממחקר של נוזל הזקיקים השחלתיים של חזירים למחקר של שתן נשים הריוניות. בעזרת שיתוף פעולה עם אחות חדר לידה, השיג דוייזי מספיק דגימות שתן כדי לבצע חקר מדעי. בשנת 1929 לאחר רכישת ציוד מעבדה יקר ערך, וחמש שנים של פיתוח מנגנון רב שלבי לזיקוק חומרים, הצליח דויזי להפיק קריסטל של אסטרון טהור. באותה העת הוא קרא לחומר שגילה בשם "תיהלין" (theelin), ומסר על כך הרצאה בפני חברי הקונגרס הבין לאומי השלוש עשרה לפיזיולוגיה. חודש לאחר מכן, באופן בלתי תלוי פרסם החוקר אדולף בוטנאנדט מאמר בו הראה כי הצליח לבודד אסטריול טהור מה שהוביל את וועדת פרסי נובל להעניק לו בשנת 1939 יחדיו עם לבוסלב רוז'יצ'קה על זקוק הטסטוסטרון והאסטרוגנים. בעוד מדויזי נמנעה הכרה זאת[117].
דויזי המשיך בחקר הורמוני המין גם לאחר זיקוק האסטרון, ובשנת 1931 הוא הצליח לבודד את האסטריול וקרא לו "תילול" (theelol). עד לגילוי האסטרדיול לקחו עוד כמעט עשר שנים כך שרק בשנת 1940 בודד דויזי, בעזרת קולגות נוספים, את האסטרדיול ונתן את השם דיהידרותיהלין (dihydrotheelin)[117].
ראו גם[עריכת קוד מקור | עריכה]
|
עיינו גם בפורטל פורטל הביולוגיה מהווה שער לחובבי הביולוגיה ולמתעניינים בתחום. בין היתר, תוכלו למצוא בפורטל מידע על ביולוגים חשובים ועל ענפי הביולוגיה. |
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- על השפעת הורמוני המין הנשיים על תפקודים קוגניטיביים ועיבוד רגשי: Sundstrom Poromaa, I. and Gingnell, M. (2014) Menstrual cycle influence on cognitive function and emotion processing: from a reproductive perspective. Front. Neurosci. 8, 380
- על השפעת דיכוי רמות האסטרדיול באמצעות גלולות על תפקוד המוח והתנהגות רגשית-חברתית: How Oral Contraceptives Impact Social-Emotional Behavior and Brain Function by Estrella R. Montoya בתוך,Trends in Cognitive Sciences, February 2017, Vol. 21, No. 2, עמודים 125-136.
- על שיפור אחוזי הצלחה של השתלת עור בניתוחים כירוגיים באמצעות מתן אסטרדיול:Chiu, David T: Pre- and/or Postsurgical Administration of Estradiol Benzoate Increases Rates of Skin Flap Viability in Female Rats בתוך Aesthetic Plastic Surgery; Heidelberg Vol. 37, Iss. 5, (Oct 2013)
 אסטרדיול, דף שער בספרייה הלאומית
אסטרדיול, דף שער בספרייה הלאומית
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ Ryan KJ (August 1982). "Biochemistry of aromatase: significance to female reproductive physiology". Cancer Research. 42 (8 Suppl): 3342s–3344s. PMID 7083198.
- ^ 1 2 ד"ר ארדיטי אלכס- מאמר על הגדלה שפירה בערמונית
- ^ Mechoulam R, Brueggemeier RW, Denlinger DL (September 1984). "Estrogens in insects". Cellular and Molecular Life Sciences. 40 (9): 942–944. doi:10.1007/BF01946450.
- ^ Ozon R (1972). "Estrogens in Fishes, Amphibians, Reptiles, and Birds". In Idler DR. Steroids In Nonmammalian Vertebrates. Oxford: Elsevier Science. pp. 390–414. ISBN 978-0323140980.
- ^ 1 2 Boron WF, Boulpaep EL (2003). Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders. p. 1300. ISBN 978-1-4160-2328-9.
- ^ 1 2 3 https://www.clalit.co.il/he/your_health/family/Pages/estradiol.aspx
- ^ Rollerova, E., & Urbancikova, M. (2000). Intracellular estrogen receptors, their characterization and function. Endocr Regul, 34(4), 203-218.
- ^ 1 2 3 4 5 הירש, ק' (2005). קרוטנואידים מעכבים סגנל של אסטרוגנים בתאי סרטן התלויים בהורמונים (חיבור לשם קבלת תואר "דוקטור לפילוסופיה"), אוניברסיטת בן-גוריון בנגב, באר שבע.
- ^ Giguère, V., Tremblay, A., & Tremblay, G. B. (1998). Estrogen receptor β: re-evaluation of estrogen and antiestrogen signaling. Steroids, 63(5-6), 335-339.
- ^ Saunders, P. T. (1998). Oestrogen receptor beta (ER beta). Reviews of reproduction, 3(3), 164-171.
- ^ Paech, K., Webb, P., Kuiper, G. G., Nilsson, S., Gustafsson, J. Å., Kushner, P. J., & Scanlan, T. S. (1997). Differential ligand activation of estrogen receptors ERα and ERβ at AP1 sites. Science, 277(5331), 1508-1510.
- ^ Liu, M. M., Albanese, C., Anderson, C. M., Hilty, K., Webb, P., Uht, R. M., ... & Kushner, P. J. (2002). Opposing action of estrogen receptors α and β on cyclin D1 gene expression. Journal of Biological Chemistry, 277(27), 24353-24360.
- ^ Lee, S. K., Choi, H. S., Song, M. R., Lee, M. O., & Lee, J. W. (1998). Estrogen receptor, a common interaction partner for a subset of nuclear receptors. Molecular Endocrinology, 12(8), 1184-1192.
- ^ Mi-Ryoung, S. O. N. G., Soo-Kyung, L. E. E., Young-Woo, S. E. O., Hueng-Sik, C. H. O. I., LEE, J. W., & Mi-Ock, L. E. E. (1998). Differential modulation of transcriptional activity of oestrogen receptors by direct protein–protein interactions with retinoid receptors. Biochemical Journal, 336(3), 711-717.
- ^ Liu, G., Schwartz, J. A., & Brooks, S. C. (1999). p53 down-regulates ER-responsive genes by interfering with the binding of ER to ERE. Biochemical and biophysical research communications, 264(2), 359-364.
- ^ Wang, C., Fu, M., Angeletti, R. H., Siconolfi-Baez, L., Reutens, A. T., Albanese, C., ... & Fuqua, S. A. (2001). Direct acetylation of the estrogen receptor α hinge region by p300 regulates transactivation and hormone sensitivity. Journal of Biological Chemistry, 276(21), 18375-18383.
- ^ Wells, L., Vosseller, K., & Hart, G. W. (2001). Glycosylation of nucleocytoplasmic proteins: signal transduction and O-GlcNAc. Science, 291(5512), 2376-2378.
- ^ Kato, S., Endoh, H., Masuhiro, Y., Kitamoto, T., Uchiyama, S., Sasaki, H., ... & Metzger, D. (1995). Activation of the estrogen receptor through phosphorylation by mitogen-activated protein kinase. Science, 270(5241), 1491-1494.
- ^ O’Lone, R., Frith, M. C., Karlsson, E. K., & Hansen, U. (2004). Genomic targets of nuclear estrogen receptors. Molecular endocrinology, 18(8), 1859-1875.
- ^ Zhang, Z., & Teng, C. T. (2000). Estrogen receptor-related receptor α1 interacts with coactivator and constitutively activates the estrogen response elements of the human lactoferrin gene. Journal of Biological Chemistry, 275(27), 20837-20846.
- ^ פרופ' סלע בן-עמי, הערך אסטרדיול באתר ויקירפואה.
- ^ Wu CH, Motohashi T, Abdel-Rahman HA, Flickinger GL, Mikhail G (August 1976). "Free and protein-bound plasma estradiol-17 beta during the menstrual cycle". The Journal of Clinical Endocrinology and Metabolism. 43 (2): 436–45. doi:10.1210/jcem-43-2-436. PMID 950372.
- ^ Stanczyk FZ, Archer DF, Bhavnani BR (June 2013). "Ethinyl estradiol and 17β-estradiol in combined oral contraceptives: pharmacokinetics, pharmacodynamics and risk assessment". Contraception. 87 (6): 706–27. doi:10.1016/j.contraception.2012.12.011. PMID 23375353.
- ^ Falcone T, Hurd WW (2007). Clinical Reproductive Medicine and Surgery. Elsevier Health Sciences. pp. 22–. ISBN 978-0-323-03309-1.
- ^ Oettel M, Schillinger E (6 December 2012). Estrogens and Antiestrogens I: Physiology and Mechanisms of Action of Estrogens and Antiestrogens. Springer Science & Business Media. pp. 235–237. ISBN 978-3-642-58616-3.
- ^ 1 2 Craig CR, Stitzel RE (2004). Modern Pharmacology with Clinical Applications. Lippincott Williams & Wilkins. pp. 706–. ISBN 978-0-7817-3762-3.
- ^ 1 2 McMillan JA, Feigin RD, DeAngelis C, Jones MD (2006). Oski's Pediatrics: Principles & Practice. Lippincott Williams & Wilkins. pp. 550–. ISBN 978-0-7817-3894-1.
- ^ אצל נשים השומן מתחלק באופן שונה מגברים כאשר הוא מרוכז יותר באזור השד, האגן, הירכיים והעכוז.
- ^ Victor R. Preedy (2 December 2011). Handbook of Growth and Growth Monitoring in Health and Disease. Springer Science & Business Media. pp. 2661–. ISBN 978-1-4419-1794-2.
- ^ Carani C, Qin K, Simoni M, Faustini-Fustini M, Serpente S, Boyd J, Korach KS, Simpson ER (July 1997). "Effect of testosterone and estradiol in a man with aromatase deficiency". The New England Journal of Medicine. 337 (2): 91–5. doi:10.1056/NEJM199707103370204. PMID 9211678.
- ^ Albright F, Smith PH, Richardson AM (31 May 1941). "Postmenopausal Osteoporosis: Its Clinical Features". JAMA. 116 (22): 2465–2474. doi:10.1001/jama.1941.02820220007002.
- ^ Holzer G, Riegler E, Hönigsmann H, Farokhnia S, Schmidt JB, Schmidt B (September 2005). "Effects and side-effects of 2% progesterone cream on the skin of peri- and postmenopausal women: results from a double-blind, vehicle-controlled, randomized study". The British Journal of Dermatology. 153 (3): 626–34. doi:10.1111/j.1365-2133.2005.06685.x. PMID 16120154.
- ^ 1 2 Raine-Fenning NJ, Brincat MP, Muscat-Baron Y (2003). "Skin aging and menopause : implications for treatment". American Journal of Clinical Dermatology. 4 (6): 371–8. doi:10.2165/00128071-200304060-00001. PMID 12762829.
- ^ Response of skin thickness and metacarpal index to estradiol therapy in postmenopausal women. Obstetrics and gynecology 70 (4), 538-541, 1987
- ^ Osterlund, M. et al. (1998) Differential distribution and regulation of estrogen receptor-alpha and -beta mRNA within the female rat brain. Brain Res. Mol. Brain Res. 54, 175–180
- ^ Micevych, P. and Dominguez, R. (2009) Membrane estradiol signaling in the brain. Front. Neuroendocrinol. 30, 315–327
- ^ 1 2 Almey, A. et al. (2015) Estrogen receptors in the central nervous system and their implication for dopamine-dependent cognition in females. Horm. Behav. 74, 125–138
- ^ Borrow, A.P. and Cameron, N.M. (2014) Estrogenic mediation of serotonergic and neurotrophic systems: implications for female mood disorders. Prog. Neuropsychopharmacol. Biol. Psychiatry 54, 13–25
- ^ Frye, C.A. and Vongher, J.M. (1999) Progesterone has rapid and membrane effects in the facilitation of female mouse sexual behavior. Brain Res. 815, 259–269
- ^ Sinchak, K. and Micevych, P.E. (2001) Progesterone blockade of estrogen activation of mu-opioid receptors regulates reproductive behavior. J. Neurosci. 21, 5723–5729
- ^ Ervin, K.S. et al. (2015) Estrogen involvement in social behavior in rodents: rapid and long-term actions. Horm. Behav. 74, 53–76
- ^ Bos, P.A. et al. (2012) Acute effects of steroid hormones and neuropeptides on human social-emotional behavior: a review of single administration studies. Front. Neuroendocrinol. 33, 17–35
- ^ Li Y, Nakae K, Ishii S, Naoki H (2016) Uncertainty-Dependent Extinction of Fear Memory in an Amygdala-mPFC Neural Circuit Model. PLoS Comput Biol 12(9): e1005099. https://doi.org/10.1371/journal.pcbi.1005099
- ^ Maeng, L.Y. and Milad, M.R. (2015) Sex differences in anxiety disorders: Interactions between fear, stress, and gonadal hormones. Horm. Behav. 76, 106–117
- ^ Graham, B.M. and Milad, M.R. (2013) Blockade of estrogen by hormonal contraceptives impairs fear extinction in female rats and women. Biol. Psychiatry 73, 371–378
- ^ 1 2 Zeidan, M.A. et al. (2011) Estradiol modulates medial prefrontal cortex and amygdala activity during fear extinction in women and female rats. Biol. Psychiatry 70, 920–927
- ^ Wegerer, M. et al. (2014) Low levels of estradiol are associated with elevated conditioned responding during fear extinction and with intrusive memories in daily life. Neurobiol. Learn. Mem. 116, 145–154
- ^ Hwang, M.J. et al. (2015) Contribution of estradiol levels and hormonal contraceptives to sex differences within the fear network during fear conditioning and extinction. BMC Psychiatry 15, 295
- ^ Amin, Z. et al. (2006) Effects of estrogen variation on neural correlates of emotional response inhibition. Neuroimage 32, 457–464
- ^ Engman, J. et al. (2016) Amygdala subnuclei resting-state functional connectivity sex and estrogen differences. Psychoneuroendocrinology 63, 34–42
- ^ Jacobs, E.G. et al. (2015) 17beta-estradiol differentially regulates stress circuitry activity in healthy and depressed women. Neuropsychopharmacology 40, 566–576
- ^ Goldstein, J.M. et al. (2005) Hormonal cycle modulates arousal circuitry in women using functional magnetic resonance imaging. J. Neurosci. 25, 9309–9316
- ^ Diekhof, E.K. (2015) Be quick about it. Endogenous estradiol level, menstrual cycle phase and trait impulsiveness predict impulsive choice in the context of reward acquisition. Horm. Behav. 74, 186–193
- ^ Justice, A.J. and de Wit, H. (2000) Acute effects of estradiol pretreatment on the response to d-amphetamine in women. Neuroendocrinology 71, 51–59
- ^ Evans, S.M. and Foltin, R.W. (2006) Exogenous progesterone attenuates the subjective effects of smoked cocaine in women, but not in men. Neuropsychopharmacology 31, 659–674
- ^ Kamboj, S.K. et al. (2015) A specific association between facial disgust recognition and estradiol levels in naturally cycling women. PLoS One 10, e0122311
- ^ Guapo, V.G. et al. (2009) Effects of sex hormonal levels and phases of the menstrual cycle in the processing of emotional faces. Psychoneuroendocrinology 34, 1087–1094
- ^ Karlsson, S. et al. (2016) Social memory associated with estrogen receptor polymorphisms in women. Soc. Cogn. Affect. Neurosci. 11, 877–883
- ^ Olsson, A. et al. (2016) Testosterone and estrogen impact social evaluations and vicarious emotions: a double-blind placebo-controlled study. Emotion 16, 515–523
- ^ Little, A.C. et al. (2007) Preferences for masculinity in male bodies change across the menstrual cycle. Horm. Behav. 51, 633–639
- ^ 1 2 Penton-Voak, I.S. et al. (1999) Menstrual cycle alters face preference. Nature 399, 741–742
- ^ Feinberg, D.R. et al. (2006) Menstrual cycle, trait estrogen level, and masculinity preferences in the human voice. Horm. Behav. 49, 215–222
- ^ Grammer, K. (1993) 5-a-androst-16en-3a-on: a male pheromone? A brief report. Ethol. Sociol. 14, 201–207
- ^ Gangstad, S.W. et al. (2004) Women's preferences for male behavioral displays change across the menstrual cycle. Psychol. Sci. 15, 203–207
- ^ Gangstad, S.W. et al. (2004) Women's preferences for male behavioral displays change across the menstrual cycle. Psychol. Sci. 15, 203–207
- ^ Rupp, H.A. et al. (2009) Neural activation in the orbitofrontal cortex in response to male faces increases during the follicular phase. Horm. Behav. 56, 66–72
- ^ Hahn, A.C. and Perrett, D.I. (2014) Neural and behavioral responses to attractiveness in adult and infant faces. Neurosci. Biobehav. Rev. 46 (Pt 4), 591–603
- ^ Jones, B.C. et al. (2005) Commitment to relationships and preferences for femininity and apparent health in faces are strongest on days of the menstrual cycle when progesterone level is high. Horm. Behav. 48, 283–290
- ^ Little, A.C. et al. (2013) Oral contraceptive use in women changes preferences for male facial masculinity and is associated with partner facial masculinity. Psychoneuroendocrinology 38, 1777–1785
- ^ Fleischman, D.S. et al. (2010) Oral contraceptives suppress ovarian hormone production. Psychol. Sci. 21, 750–752 author reply 753
- ^ Zimmerman, Y. et al. (2014) The effect of combined oral contraception on testosterone levels in healthy women: a systematic review and meta-analysis. Hum. Reprod. Update 20, 76–105
- ^ Rupp, H.A. and Wallen, K. (2007) Sex differences in viewing sexual stimuli: an eye-tracking study in men and women. Horm. Behav. 51, 524–533
- ^ Burrows, L.J. et al. (2012) The effects of hormonal contraceptives on female sexuality: a review. J. Sex. Med. 9, 2213–2223
- ^ Georgiadis, J.R. and Kringelbach, M.L. (2012) The human sexual response cycle: brain imaging evidence linking sex to other pleasures. Prog. Neurobiol. 98, 49–81
- ^ Georgiadis, J.R. and Kringelbach, M.L. (2012) The human sexual response cycle: brain imaging evidence linking sex to other pleasures. Prog. Neurobiol. 98, 49–81
- ^ Abler, B. et al. (2013) Neural correlates of erotic stimulation under different levels of female sexual hormones. PLoS One 8, e54447
- ^ Russell, V.M. et al. (2014) The association between discontinuing hormonal contraceptives and wives’ marital satisfaction depends on husbands’ facial attractiveness. Proc. Natl. Acad. Sci. U.S.A. 111, 17081–17086
- ^ Welling, L.L. et al. (2012) Hormonal contraceptive use and mate retention behavior in women and their male partners. Horm. Behav. 61, 114–120
- ^ Cobey, K.D. et al. (2011) Hormonal birth control use and relationship jealousy: evidence for estrogen dosage effects. Pers. Individ. Dif. 50, 315–317
- ^ Roberts, S.C. et al. (2012) Relationship satisfaction and outcome in women who meet their partner while using oral contraception. Proc. Biol. Sci. 279, 1430–1436
- ^ Roberts, S.C. et al. (2014) Partner choice, relationship satisfaction, and oral contraception: the congruency hypothesis. Psychol. Sci. 25, 1497–1503
- ^ Scheele, D. et al. (2016) Hormonal contraceptives suppress oxytocin-induced brain reward responses to the partner's face. Soc. Cogn. Affect. Neurosci. 11, 767–774
- ^ Sprengelmeyer, R. et al. (2009) The cutest little baby face: a hormonal link to sensitivity to cuteness in infant faces. Psychol. Sci. 20, 149–154
- ^ Mascaro, J.S. et al. (2014) Differential neural responses to child and sexual stimuli in human fathers and non-fathers and their hormonal correlates. Psychoneuroendocrinology 46, 153–163
- ^ 1 2 Brinkmann, A. O. (2001). Molecular basis of androgen insensitivity. Molecular and cellular endocrinology, 179(1-2), 105-109.
- ^ 1 2 Oakes, M. B., Eyvazzadeh, A. D., Quint, E., & Smith, Y. R. (2008). Complete androgen insensitivity syndrome—a review. Journal of pediatric and adolescent gynecology, 21(6), 305-310.
- ^ J. Larry Jameson; Leslie J. De Groot (25 February 2015). Endocrinology: Adult and Pediatric. Elsevier Health Sciences. pp. 238–. ISBN 978-0-323-32195-2.
- ^ 1 2 Bernard V, Kherra S, Francou B, Fagart J, Viengchareun S, Guéchot J, Ladjouze A, Guiochon-Mantel A, Korach KS, Binart N, Lombès M, Christin-Maitre S (2017). "Familial Multiplicity of Estrogen Insensitivity Associated With a Loss-of-Function ESR1 Mutation". J. Clin. Endocrinol. Metab. 102 (1): 93–99. doi:10.1210/jc.2016-2749. PMC 5413105. PMID 27754803.
- ^ P.Jones,P.Buckley (2006) ע' 7
- ^ 1 2 Kraepelin, E., Psychiatry, 1909–13. 8th edition. Leipzig.
- ^ 1 2 McGregor, C., Riordan, A., & Thornton, J. (2017). Estrogens and the cognitive symptoms of schizophrenia: possible neuroprotective mechanisms. Frontiers in neuroendocrinology, 47, 19-33.
- ^ 1 2 Newton-Mann, E., Finney, C., Purves-Tyson, T., & Gogos, A. (2017). Estrogen receptors: mechanism of action and relevance to schizophrenia. Current Psychiatry Reviews, 13(1), 55-64.
- ^ Kretschmer, E. (1936). Körperbau und Charakter. Untersuchungen zum Konstitutions-Problem und zur Lehre von den Temperamenten.
- ^ Riecher-Rössler, A., & Häfner, H. (1993). Schizophrenia and oestrogens—is there an association?. European Archives of Psychiatry and Clinical Neuroscience, 242(6), 323-328.
- ^ Commission on Epidemiology and Prognosis, International League Against Epilepsy (1993). "Guidelines for epidemiologic studies on epilepsy". Epilepsia. 34 (4): 592–6. doi:10.1111/j.1528-1157.1993.tb00433.x. PMID 8330566.(הקישור אינו פעיל)
- ^ Temkin, Owsei (1 במרץ 1994) [First published 1945, Revised 1971]. The Falling Sickness (2nd Revised ed.). Baltimore: Johns Hopkins University Press. ISBN 978-0801848490.
{{cite book}}: (עזרה) - ^ Backstrom T (1976). "Epileptic seizures in women related to plasma estrogen and progesterone during the menstrual cycle". Acta neurologica Scandinavica. 54 (4): 321–47. doi:10.1111/j.1600-0404.1976.tb04363.x. PMID 973554.
- ^ Riazi K, Honar H, Homayoun H, Rashidi N, Dehghani M, Sadeghipour H, Gaskari SA, Dehpour AR (2004). "Sex and estrus cycle differences in the modulatory effects of morphine on seizure susceptibility in mice". Epilepsia. 45 (9): 1035–42. doi:10.1111/j.0013-9580.2004.69903.x. PMID 15329066.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ Koh KK, Horne MKIII, Cannon ROIII. Effects of hormone replacement therapy on coagulation, fibrinolysis, and thrombosis risk in postmenopausal women. Thromb Haemost. 1999; 82: 626–633.
- ^ Teede HJ, McGrath BP, Smolich JJ, Malan E, Kotsopoulos D, Liang YL, Peverill RE. Postmenopausal hormone replacement therapy increases coagulation activity and fibrinolysis. Arterioscler Thromb Vasc Biol. 2000; 20: 1404–1409.
- ^ 1 2 3 Asscheman, H., T'Sjoen, G., Lemaire, A., Mas, M., Meriggiola, M. C., Mueller, A., ... & Gooren, L. J. (2014). Venous thrombo‐embolism as a complication of cross‐sex hormone treatment of male‐to‐female transsexual subjects: a review. Andrologia, 46(7), 791-795.
- ^ 1 2 3 Weinand, J. D., & Safer, J. D. (2015). Hormone therapy in transgender adults is safe with provider supervision; a review of hormone therapy sequelae for transgender individuals. Journal of clinical & translational endocrinology, 2(2), 55-60.
- ^ Jick H, Kaye JA, Vasilakis-Scaramozza C, Jick SS. Risk of venous thromboembolism among users of third generation oral contraceptives compared with users of oral contraceptives with levonorgestrel before and after 1995: cohort and case-control analysis. BMJ. 2000; 321: 1190–1195.
- ^ Bloemenkamp KWM, Rosendaal FR, Büller HR, Helmerhorst FM, Colly LP, Vandenbroucke JP. Risk of venous thrombosis with use of current low-dose oral contraceptives is not explained by diagnostic suspicion and referral bias. Arch Intern Med. 1999; 159: 65–70.
- ^ Kemmeren JM, Algra A, Grobbee DE. Third generation oral contraceptives and risk of venous thrombosis: meta-analysis. BMJ. 2001; 323: 131–134.
- ^ 1 2 Olivieri O, Friso S, Manzato F, Guella A, Bernardi F, Lunghi B, Girelli D, Azzini M, Brocco G, Russo C. Resistance to activated protein C in healthy women taking oral contraceptives. Br J Haematol. 1995; 91: 465–470.
- ^ 1 2 Scarabin PY, Plu-Bureau G, Zitoun D, Bara L, Guize L, Samama MM. Changes in haemostatic variables induced by oral contraceptives containing 50 micrograms or 30 micrograms oestrogen: absence of dose-dependent effect on PAI-1 activity. Thromb Haemost. 1995; 74: 928–932.
- ^ 1 2 3 4 5 6 7 הערך על טיפול הורמונלי, אתר מעברים - שינוי בר קיימא לאוכלוסייה הטרנסית
- ^ 1 2 3 Giltay, E. J., & Gooren, L. J. G. (2000). Effects of sex steroid deprivation/administration on hair growth and skin sebum production in transsexual males and females. The Journal of Clinical Endocrinology & Metabolism, 85(8), 2913-2921.
- ^ 1 2 דף מרפאת הטרנסג'נדרים באתר בית החולים בני ציון
- ^ Jones, I., Chandra, P. S., Dazzan, P., & Howard, L. M. (2014). Bipolar disorder, affective psychosis, and schizophrenia in pregnancy and the post-partum period. The Lancet, 384(9956), 1789-1799.
- ^ Balaraman Y, Schmetzer AD. Hormonal replacement therapy in postpartum affective disorders. Ann Clin Psychiatry. 2011;23:71–72.
- ^ Huang MC, Wang YB, Chan CH. Estrogen-progesterone combination for treatment-refractory post-partum mania. Psychiatry Clin Neurosci. 2008;62:126.
- ^ 1 2 Davies, W. (2017). Understanding the pathophysiology of postpartum psychosis: challenges and new approaches. World journal of psychiatry, 7(2), 77.
- ^ Barth, C., Villringer, A., & Sacher, J. (2015). Sex hormones affect neurotransmitters and shape the adult female brain during hormonal transition periods. Frontiers in neuroscience, 9, 37.
- ^ אתי הרמתי, 51 שנה לאישור השימוש בקלומיפן ציטראט, התרופה שסללה את הדרך להיריון אצל נשים רבות בעלות ביוץ לא סדיר, באתר של מכון דוידסון לחינוך מדעי, 7 בפברואר 2018.
- ^ 1 2 3 4 Simpson, E., & Santen, R. J. (2015). Celebrating 75 years of oestradiol. Journal of molecular endocrinology, 55(3), T1-T20.
- ^ הדף על בוטנאנדט באתר פרסי נובל

