דופמין
 | |
| מבנה מולקולת הדופמין | |
| תכונות | |
|---|---|
| נוסחה אמפירית |
C₈H₁₁NO₂ |
| משקל מולקולרי | 153.181 |
דופמין (באנגלית: DA - Dopamine) הוא תרכובת אורגנית ממשפחות הקטכולאמינים והפנתילאמינים. הוא מתפקד הן כהורמון והן כמוליך עצבי (נוירוטרנסמיטר) וממלא מספר תפקידים חשובים במוח ובגוף. הדופמין פועל הן במערכת העצבים המרכזית והן במערכת העצבים ההיקפית והוא אחד החומרים המשתתפים במהלך הסינתזה של אפינפרין ונוראפינפרין[1].
לחוסר או עודף של דופמין השפעה גדולה במספר גדול של הפרעות ומחלות, ובתוכן סכיזופרניה, מחלת פרקינסון, דיכאון מז'ורי, הפרעה דו-קוטבית והפרעות קשב. על בסיס ידע זה פותחו תרופות רבות במטרה להתערב בפעילות הדופמין.

הנוסחה הכימית של הדופמין היא (C6H3(OH)2-CH2-CH2-NH2). הדופמין משתייך למשפחת הקטכולאמינים, יחד עם אדרנלין ונוראדרנלין[2]. זוהי קבוצת משנה של קבוצת התרכובות המונואמינים, המכילה גם את הסרוטונין.
השפעות קוגניטיביות-התנהגותיות[עריכת קוד מקור | עריכה]
במוח האנושי ישנם כמעט מיליון תאי עצב המכילים דופמין[3]. ישנה הכרה רחבה בחשיבותו של הדופמין לפעילותה של קליפת המוח הקדם-מצחית[4], המעורבת בתפקודים מחשבתיים גבוהים[5]. למעשה, הדופמין חיוני לשליטה על הפעילות הקוגניטיבית בקליפת המוח הקדם-מצחית[6]. הדופמין מעורב גם בתהליכי ויסות ושליטה של עיבוד מידע מלמעלה-למטה המאפשרים מתן עדיפות למידע רלוונטי על פני מידע לא רלוונטי[6][7]. בהתאם לזאת, לדופמין יש תפקיד מרכזי בתפקודים קוגניטיביים, בהם השימוש בזיכרון העבודה[8][4][9] ותפקודים ניהוליים בראשם תכנון, קבלת החלטות והוצאתן לפועל[10][9][6].
בנוסף, הדופמין מעורב במספר תפקודים חשובים כמו תנועה, קשב ולמידה[2]. יש לו תפקיד מרכזי במערכת החיזוק[11] והוא מעורב גם בנטייה לחוויית זרימה[12]. הדופמין מקושר גם ליכולת החשיבה המסתעפת[13] וליצירתיות[14]. כמו כן, הוא חיוני להערכה של מטרות ולתכנון הפעולות המיועדות להגשמתן[15].
מספר סוגים של גנים של דופמין קשורים לקשב וויסות עצמי[16]. למשל: הפרעת קשב מקושרת לשונות בגנים של קולטני דופמין[17], כמו DRD4 ו-DRD5[16]. האלל 7R של DRD4 אותר כמצביע על סיכון להפרעת קשב[13]. הגן DAT1 מכיל את הקידוד הגנטי לנשא הדופמין[16]. וריאציות בגן זה מקושרות להפרעת קשב[17]. בהתאם לכך, פגמים בגן DAT1 מפריעים לפעילות הדופמין ומקושרים אל אופן ההשפעה של תרופות מסוג מתילפנידאט, אשר נמצאו יעילות בהקלת תסמיני ההפרעה[18]. הגן DAT1 מקושר אומנם להיפראקטיביות ולאימפולסיביות, אך לא לפגיעה בתפקודי הקשב[16]. נמצא קשר גם בין הפרעת קשב לאללים שונים של גן ה-COMT, שהוא אנזים שמפרק תרכובות אורגניות מסוג קטכולאמין (כמו דופמין) בנוזל החוץ-תאי[2]. האנזים COMT הוא המנגנון החשוב ביותר לפירוק הדופמין בקליפת המוח הקדם-מצחית[14].
העברה סינפטית של דופמין[עריכת קוד מקור | עריכה]

פעילות הדופמין במערכת העצבים היא מורכבת, כך שיכולות להיות לו השפעות שונות במקרים שונים. השפעות אלו מקושרות בין היתר לתהליכי העברה סינפטית של המוליך העצבי דופמין.
באופן כללי הדופמין מיוצר ומאוחסן בקצות הנוירונים ומשוחרר לסינפסות שלהם בעקבות דחף עצבי מתאים. הדופמין ששוחרר למרווח הסינפטי מפעיל קולטני דופמין אשר מעבירים את המידע לתא שאליו הם מחוברים. בתום פעולת הדופמין הוא מפונה מהסינפסה במספר דרכים[19].
הדופמין יכול ליצור פוטנציאל פוסט-סינפטי מעכב או מעורר[2][4]. אופן ההשפעה של הדופמין תלוי בסוג הקולטן שאליו הוא נקשר ובתא המחובר לקולטן זה. בנוסף, מעבר לקשרים בין נוירונים ספציפיים, קיימות במוח גם שלוש מערכות דופמינרגיות. מערכת הקשב, מערכת החיזוק, ומערכת קידוד הזיכרון ההצהרתי, בהן הדופמין מתפקד כהורמון לכל דבר.
יצירה של דופמין[עריכת קוד מקור | עריכה]
הייצור של דופמין הוא אחד הצעדים ביצירת נוראפינפרין ואפינפרין[1]. הסינתזה של דופמין בגוף מתבצעת בעיקר בקצות העצבים של הרקמות העצביות ובבלוטת יותרת הכליה.
תהליך יצירת הדופמין מורכב ממספר שלבים[20]. חומצת האמינו טירוזין (TYR) היא מולקולת הקודמן ממנה נגזר הדופמין. היא משמשת גם כקודמן עבור נוראפינפרין (מוליך עצבי נוסף מסוג קטכולאמין)[2]. זוהי חומצת אמינו בלתי חיונית שנוצרת בגוף מחומצת אמינו פנילאלנין. הטירוזין הופכת לחומר הנקרא "דופא" DOPA (שהוא קיצור ל-dihydroxyphenylaline) שממנו נוצר הדופמין[19]. ל-DOPA יש שני איזומרים, שהם שני חומרים בעלי אותו הרכב בסיסי, אך שונים במבנה המרחבי[19]. האיזומר המשמש ליצירת הדופמין נקרא "אל דופא" L-DOPA או "לבו דופא" LEVO-DOPA[19]. הטירוזין הופך ל-L-DOPA על ידי כך שהוא קושר אליו קבוצת הידרוקסיל באמצעות האנזים Aromatic L-amino acid decarboxylase. בשלב הבא מאבדת מולקולת אל-דופה קבוצת קרבוקסיל בהשפעת פעילותו של האנזים דופה דקרבוקסילאז והופכת לדופמין. במידת הצורך בשלב הבא יכולה להצטרף לדופמין קבוצת ההידרוקסיל והופכת לנוראפינפרין (נוראדרנלין).
מונואמין אוקסידאז (MAO) הוא האנזים המווסת את תהליך ההפקה של הדופמין ושל יתר המוליכים העצביים הקטכולאמינים[2].
האנזים טירוזין הידרוקסילאז הוא האנזים אשר קובע את קצב הסינתיזה[1]. התאים הדופימינרגיים חסרים את האנזים דופמין הידרוקסילאז, ולכן הם אינם מייצרים נוראפינפרין[1].
הדופמין במרווח הסינפטי: אחסון, שחרור והסרה[עריכת קוד מקור | עריכה]
הדופמין שנוצר בקצות העצבים מתרכז בתוך השלפוחיות הסינפטיות. השחרור של הדופמין לסינפסה משופעל על ידי גירוי של תא העצב הקדם סינפטי[20][1]. הוא מאוחסן בשלפוחיות עד שמגיע דחף עצבי, אשר משחרר את הדופמין מהשלפוחיות אל המרווח הסינפטי שבין התא הקדם-סינפטי והתא הבתר-סינפטי[19][20]. אחסון הדופמין בשלפוחיות הסינפטיות ושחרורו מהן, הם פעולות הזקוקות לאנרגיה[1].
כאשר הדופמין עובר את המרווח הסינפטי הוא מפעיל את הקולטנים המיוחדים לו בתא הפוסט סינפטי וכך הוא מעביר אליו את המידע[19]. הדופמין ממשיך לפעול על הקולטנים הבתר-סינפטיים כל עוד הוא נמצא במרווח הסינפטי[20]. קולטנים קדם סינפטיים תורמים לוויסות של כמות הפרשת הדופמין לסינפסה[1].
הסרת הדופמין מהמרווח הסינפטי[עריכת קוד מקור | עריכה]
הסרה מהירה של המוליכים העצביים מהמרווח הסינפטי מאפשרת העברה מדויקת של האות הקדם סינפטי לתא המטרה[3]. בהתאם לכך, לאחר שהדופמין ביצע את פעילותו יש להסיר אותו מהמרווח הסינפטי. הסרת הדופמין יכולה להתרחש על ידי פירוקו או הזזתו למקום אחר[20]. הדופמין יכול להיקלט חזרה אל תא העצב הקדם סינפטי שממנו שוחרר. הוא יכול גם להיספג על ידי תאי גלייה תומכים, או על ידי פעפוע לנוזל החוץ תאי[19].
הסרת הדופמין מהמרווח הבין תאי מערבת את החלבון נשא הדופמין ואת האנזים COMT[21][22] המשתתף בניטרולו.
קולטני דופמין[עריכת קוד מקור | עריכה]
 ערך מורחב – קולטני דופמין
ערך מורחב – קולטני דופמין
קולטני דופמין (DR - Dopamine Receptors) מופעלים על ידי הדופמין שנמצא במרווח הסינפטי ומעבירים את המידע לתא שעליו הם מקושרים[19]. זהו המנגנון שבאמצעותו הדופמין ששוחרר מהתא הקדם סינפטי פועל על התאים הפוסט סינפטיים[20].
כל קולטני הדופמין הם קולטנים מצומדים לחלבון G (המכונים GPCRs), אשר האיתות (signaling) שלהם מתווך על ידי אינטראקציה ושפעול של חלבון G (המכונה GTP-binding proteins)[23][1].
סוגים של קולטני דופמין[עריכת קוד מקור | עריכה]
ישנם סוגים שונים של קולטני דופמין[19]. השפעת הדופמין תלויה בסוג הקולטן שאליו הוא מתחבר. הדופמין יכול ליצור פוטנציאלים בתר-סינפטיים מעוררים או מעכבים, בהתאם לקולטן הבתר-סינפטי שאיתו נוצר המגע. סוגי הקולטנים השונים מפוזרים באזורים מוחיים שונים, כך שבאזורים מסוימים יכולים להיות יותר או פחות קולטנים מסוג מסוים בהשוואה לאזורים אחרים[19][20].
עד כה זוהו חמישה סוגים של קולטני דופמין[13]. הקולטנים מסומנים באות D שאליה מצטרף המספר הרלוונטי. מספור הקולטנים נקבע על ידי סדר הגילוי שלהם[3].
- DRD1: קולטני דופמין D1 - קולטנים אלו נפוצים יחסית. קולטני D1 הם קולטנים בתר-סינפטיים. גירוי קולטני D1 מביא לעלייה ברמת השליח השניוני cAMP בתא. קולטני D1 נמצאים באזור הסטריאטום ובמיוחד באזורים האחראים על תנועה[1]. באזור זה יש קשר הפוך בין פעולות האצטילכולין לבין פעולת הדופמין[1].
- DRD2: קולטני דופמין D2 - קולטנים אלו נפוצים יחסית. קולטני D2 יכולים להיות בתר-סינפטיים ויכולים להיות בעמדות קדם-סינפטיות. במקרים רבים הם משמשים כקולטנים עצמיים של התא הקדם סינפטי, אשר מווסתים את קצב ההפקה והשחרור של הדופמין[20]. גירוי קולטנים אלו מפחית את רמת ה-cAMP. הם נמצאים באזור גרעיני הבסיס, כמו הגרעין הזנבי והפוטמן (Putamen), גרעין האקומבנס, ב-Olfactory Tubercle ובסטריאטום[1]. קולטני D2 קשורים באופן משמעותי למערכת החיזוק[3]. עלייה בזמינות של קולטני D2 קשורה לאימפולסיביות נמוכה, יציבות רגשית, אפקט חיובי ונטייה לחוויית זרימה[12]. ירידה בכמות קולטני D2 מקושרת להשמנת יתר, אך לא ברור אם היא הגורם או התוצאה[24]
- DRD3: קולטני דופמין D3 - גירוי קולטנים אלו מפחית את רמת ה-cAMP בתא. קולטנים אלו נמצאים בחלק הקדמי של גרעין האקומבנס ובאזורים לימביים, כגון הגופים הממילריים ואזור הספטום[1], אך הם נפוצים יותר בסטריאטום, בהשוואה לאזורים אחרים במוח[20]. קולטנים אלו מווסתים את כמות הפרשת הדופמין אל תוך הסינפסה[1].
- DRD4: קולטני דופמין D4 - גירוי קולטנים אלו מפחית את רמת ה-cAMP בתא. לקולטני DRD4 יש תפקיד חשוב בתיווך האותות הדופמינרגיים בסינפסה[13]. הם נפוצים יותר בקליפת המוח הקדם-מצחית בהשוואה לאזורים מוחיים אחרים[20]. הגן האחראי על DRD4 נמצא בכרומוזום 11p15[16].
- DRD5: קולטני דופמין D5 - גירוי קולטנים אלה מעלה את רמת ה-cAMP בתא. הגן של DRD5 נמצא קשור להפרעת קשב[16]. קולטנים אלו נמצאים רק באזורים לטרליים של הגופים הממילריים ובאזורים ההיפוקמפיים[1].
קולטנים עצמיים מצויים בדנדריטים, בגופי התא ובכפתורים הסופיים של נוירונים דופמינרגיים. הפעלתם גורמת היפר-פולריזציה ומפחיתה את הירי העצבי. הם דומים ל-D2.
קבוצות של קולטני דופמין[עריכת קוד מקור | עריכה]

חמשת קולטני הדופמין מחולקים לשתי קבוצות עיקריות:
- משפחת D1 (באנגלית: D1-like dopamine receptors) - כוללת את קולטני דופמין D1 ו-D5[8][20][23]. קולטנים אלו מופעלים בעזרת אדניל ציקלז (Adenyl Cyclase) על ידי חלבון G הידוע בשם Gso[1].
- משפחת D2 (באנגלית: D2-like dopamine receptors) - כוללת את קולטני דופמין D3, D2 ו-D4[8][20][23]. קולטנים אלו אינם זקוקים לאדניל ציקלז, והם מופעלים על ידי חלבון הידוע בשם Gio[1].
לקולטנים שבכל אחת מהקבוצות יש מאפייני איתות (signaling) המשותפים לקולטנים האחרים באותה הקבוצה, עם זאת ישנם גם הבדלים בין סוגי קולטנים שונים באותה הקבוצה[23]. כלומר, הקבוצות מאחדות בתוכן קולטנים שונים שחלק מהמאפיינים שלהם דומים.
היבטים רפואיים[עריכת קוד מקור | עריכה]
משום שלקולטנים שונים ישנה השפעה שונה, אחת המטרות של הפרמקולוגיה היא לפתח תרופות שתפעלנה באופן ספציפי על סוג מסוים של קולטנים מבלי שתשפיע על הסוגים האחרים[19]. כך ניתן להעלות את יעילותה של תרופה מסוימת תוך צמצום תופעות לוואי בלתי רצויות.
פעילות פאזית וטונית של דופמין[עריכת קוד מקור | עריכה]
ישנם שני דפוסי תגובה של תאי עצב הפועלים באמצעות המוליך העצבי דופמין[25], אשר מתרחשים באמצעות שני מנגנונים עצמאיים[26]: טוני (tonic) ופאזי (phasic).
הפעלה פאזית (phasic) של דופמין[עריכת קוד מקור | עריכה]
הפעלה פאזית (phasic) של דופמין היא תגובה חולפת וקצרה הנגרמת מדחף עצבי של תאי עצב דופמינרגיים[26]. ההפעלה הפאזית היא תגובה לאירועים מסוימים בסביבה[27]. הפעילות הפאזית של הדופמין מווסתת את הגמישות או הפלסטיות plasticity של מצבי השפעול של קליפת המוח[28].
ככל הנראה, לפעילות הפאזית של הדופמין בקליפת המוח הקדם-מצחית יש חשיבות ליכולת לעדכן את הייצוגים שבזיכרון העבודה ולערוך עליהם מניפולציות[28].
הפעלה טונית (tonic) של דופמין[עריכת קוד מקור | עריכה]
ההפעלה הטונית (tonic) של דופמין היא בעלת אופי יציב ומתמשך הקובע את רמות הרקע של הדופמין[26][27] והיא מווסתות על ידי קליפת המוח הקדם-מצחית[26].
הטונוס של הדופמין מעיד על תחושת הרווחה של האדם והיכולת שלו ליהנות[1]. בהתאם לכך, אצל אנשים עם נטייה לחיפוש ריגושים או אימפולסיביות, נמצא טונוס דופמין נמוך יותר בהשוואה לשאר האוכלוסייה[1].
הפעילות הטונית של הדופמין מווסתת את היציבות של מצבי השפעול של קליפת המוח[28]. כמו כן, הפעילות הטונית של הדופמין מווסתת את קליפת המוח הקדם מצחית ואת התפקודים הקוגניטיביים שהיא אחראית עליהם (כמו: זיכרון העבודה, קשב סלקטיבי ותפקודים ניהוליים) ביחס של צורת U הפוכה, כך שהתפקוד המיטבי הוא ברמות בינוניות או מתונות, בעוד שרמות גבוהות או נמוכות מידי של דופמין טוני פוגעות בתפקודים אלו[29].
הפולימורפיזם Val158Met מקושר להבדלים בין אישיים ביעילות של האנזים COMT[29], שהוא המנגנון החשוב ביותר לפירוק הדופמין בקליפת המוח הקדם-מצחית[14]. בהתאם לכך, הפולימורפיזם Val158Met מקושר גם לרמות הטוניות (tonic) של המוליך העצבי דופמין בקליפת המוח הקדם-מצחית[29]. האלל met של הפולימורפיזם Val158Met מעלה את הפעילות הטונית של הדופמין[28].
השפעת הפעילות הטונית על תגובת מערכת העצבים לפעילות הפאזית[עריכת קוד מקור | עריכה]
השילוב בין שני דפוסי התגובה של המערכת הדופמינרגית מאפשר לדופמין לווסת את התגובה העצבית של תאי המטרה לאותות הדופמינרגיים. הפעילות הטונית קובעת את רמת הרקע של גירוי קולטני הדופמין, אשר משנה את מידת התגובתיות של המערכת לפעילות הפאזית של הדופמין באזורים אלו[26][4]. באופן זה הפעילות הטונית של הדופמין יכולה לווסת את ההשפעה של הפעילות הפאזית שלו[27] ואת תגובת המערכת אליה. כתוצאה מכך, לנוכחות או היעדרות של סביבה דופמינרגית טונית, יכולה להיות השפעה על מגוון של מנגנונים פזיולוגיים שהשילוב ביניהם יוצר טווח דינאמי של תגובות עבור שינויים חולפים ברמות הדופמין[4].
מערכות דופמינרגיות עצביות[עריכת קוד מקור | עריכה]
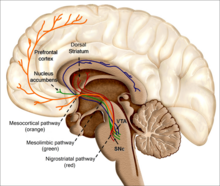
המערכת המזולימבית - בירוק
המערכת המזו-קורטיקלית - בכתום
המערכת הניגרו-סטראיטלית - באדום

במוח ישנן כמה מערכות של נוירונים דופמינרגיים[2]. מערכות אלו מובחנות מבחינה אנטומית ותפקודית, כך שכל אחת מהן נמצאת ומשפיעה על אזורים שונים[20]. שלוש מהמערכות הדופמינרגיות יוצאות מהמוח האמצעי, מהחומר השחור ומאזור הטגמנטום הגחוני.
- במערכת המזולימבית (Mesolimbic system): המערכת המזולימבית היא מערכת של נוירונים דופמינרגיים היוצאת מאזור הטגמנטום הגחוני ומסתיימת בגרעין האקומבנס באמיגדלה ובהיפוקמפוס. היא מעורבת בתהליכים הקשורים לחיזוק[2][8]. לנאוסטראטום יש תפקיד בבקרת התנועה של גופי התא שבמערכת המזולימבית. גרעין האקומבנס ממלא תפקיד חשוב בהשפעות המחזקות של כמה סוגי גירויים (סמים אסורים).
- במערכת המזו-קורטיקלית (Mesocortical system): המערכת המזו-קורטיקלית היא מערכת של נוירונים דופמינרגיים היוצאת מאזור הטגמנטום הגחוני ומסתיימת בקורטקס הקדם-מצחי. לנוירונים הללו יש השפעה מעוררת על קורטקס המצח, ולפיכך הם משפיעים על תפקודים כגון יצירת זכרונות קצרי-טווח ועל תכנון והכנת אסטרטגיות לפתרון בעיות.
- במערכת הניגרו-סטראיטלית (Nigrostriatal system): המערכת הנור-סטריאטלית היא מערכת נוירונים דופמינרגיים היוצאת מהחומר השחור ומסתיימת בנאוסטריאטום. גופי התא הללו מצויים בחומר השחור ושולחים את האקסונים שלהם לנאוסטריאטום לגרעין הזנבי ולפוטמן. התנוונות נוירונים דופמינרגיים במערכת הניגרו-סטראיטלית נמצאה כקשורה למחלת פרקינסון. המחלה מאופיינת ברעד, קשיות איברים, שיווי משקל לקוי וקושי בהתחלת תנועות.
הפורניקס מכיל שלוחות של אקסונים דופמינרגיים מהטגמנטום הגחוני[2]. המערכת הניגרו-סטריאטלית, המזולימבית והמזו-קורטיקלית פועלות באופן מתואם לשליטה על ההתנהגות, הקשב וקבלת ההחלטות[20]. בהתאם לכך, כל אחת מהן מעורבת בהפרעת קשב[20].
היבטים התפתחותיים[עריכת קוד מקור | עריכה]
 ערך מורחב – פסיכולוגיה התפתחותית
ערך מורחב – פסיכולוגיה התפתחותית
המערכות הדופמינרגיות עוברות שינויים רבים במהלך ההתפתחות של האדם[22].
מערכות דופמינרגיות תת-קורטיקליות (subcortical) מגיעות לשיאן בתקופת ההתבגרות[30]. לעומת זאת, ההתפתחות של המערכות הדופמינרגיות הקורטיקליות (cortical system) היא איטית יותר ומגיעה לשיאה רק בבגרות המוקדמת[30]. לרמות הדופמין בקליפת המוח הקדם-מצחית יש דפוס התפתחות לא-ליניארי[22]. מיד לאחר הלידה רמות הדופמין בקליפת המוח הקדם-מצחית גבוהות ודומות לאלו של האדם הבוגר, אך הן קודם יורדות ורק אז עולות בחזרה[22].
במהלך ההזדקנות הטבעית חלה הנמכה ברמת התפקוד של המערכות הדופמינרגיות, באופן דומה למערכות אחרות של מוליכים עצביים כמו הסרוטונין והאצטילכולין שגם בהן ניכרת ירידה בגילאים הזקנה[30].
מעורבות במערכת החיזוק[עריכת קוד מקור | עריכה]
 ערך מורחב – מערכת החיזוק
ערך מורחב – מערכת החיזוק
מערכת החיזוק היא מכלול המבנים והמסלולים העצביים במוח שיוצרים תחושה של עונג בתגובה לגירויים מסוימים. מערכת זו משפיעה על ההתנהגות בכך שהיא מגדילה את הסיכוי שההתנהגויות המחוזקות יחזרו על עצמן בעתיד.
לדופמין יש תפקיד מרכזי במערכת החיזוק[2][11]. הוא מתפקד כמתווך בתהליך העברת אות החיזוק במוח[17]. יש לו תפקיד חיוני בתהליכי וויסות המוטיבציה - בלמידה מהם הדברים הרעים והטובים בעולם, כמו גם בבחירת הפעולות שיובילו להשגתם של הדברים הטובים ולהימנעות מהדברים השליליים[31].
המבנים המוחיים המקושרים למערכת החיזוק באופן משמעותי מעוצבבים על ידי שלוחות דופמינרגיות מהמוח האמצעי[17]. לתאי העצב הדופמינרגים של המוח האמצעי יש תגובה חזקה לחיזוקים ותפקיד חיוני ביצירה של מוטיבציה חיובית[31].
משום שהדופמין הוא חומר שמעורר תחושה של מוטיבציה, הימצאותו תורמת לתהליך הלמידה גם במקרים בהם מקורו בפעילות שאינה קשורה ישירות לחומר הלימוד או לשיעור המועבר בכיתה[11].
השפעת הערך וההסתברות של הגמול על התגובות הדופמינרגיות[עריכת קוד מקור | עריכה]
הפעילות של תאי עצב דופמינרגיים מעבירה מידע אודות שני מאפיינים מקורבים אך מובחנים של הגמול: ערכו ורמת הוודאות בנוגע להתרחשותו[25].
- הפעלה פאזית (phasic) של דופמין - התגובות הפאזית הקצרות של הדופמין במערכת החיזוק מייצגות את הערך של הגמול[5]. הן מושפעת ממידת ההתאמה שבין הגמול הצפוי לגמול הממשי[25] ולא מההסתברות להתרחשותו של הגמול[25].
- הפעלה טונית (tonic) של דופמין - ההפעלה הטונית של הדופמין במערכת החיזוק מושפעת מרמת אי הוודאות להתרחשות הגמול[25] ומשקפת את מידת חוסר הוודאות להופעתו של הגירוי המחזק[5]. הקידוד של חוסר הוודאות מצביע על התפקיד של הדופמין בלמידה מבוססת קשב והתנהגות סיכון[25].
תאי עצב דופמינרגיים מקודדים את טעות החיזוי של הגמול באופן דו-כיווני, כך שהתגובה הדופמינרגית שווה לגמול שהתרחש פחות הגמול שנצפה[32]. קידוד דו כיווני מסוג זה יכול לשמש כאות לימודי אידיאלי עבור הפלסטיות של מערכת העצבים[32], משום שהוא מאפשר למערכת העצבים להתאים ולשפר את התפקוד שלה ביחס למידע המופק מתוך ההתנסות עם הסביבה.
אפנון עצבי, יחס אות לרעש והתפקוד של מערכת העצבים[עריכת קוד מקור | עריכה]
לאפנון העצבי של יחס אות לרעש בתהליך עיבוד המידע יש השלכות על הקיבולת והתנודתיות של המערכת הנוירו-קוגניטיבית[33]. היחס בין התפקוד הקוגניטיבי לרמת הרעש במערכת העצבים הוא בצורת U הפוכה, כך שהביצוע המיטבי מתרחש ברמות רעש מתונות והוא נפגע ברמות רעש גבוהות או נמוכות מידי[27]. בהתאם לכך, מחסור או עודף של אפנון עצבי פוגע ביכולת עיבוד המידע העצבי[33]. מידה לא מתאימה של אפנון עצבי מובילה לירידה במובחנות של ייצוגים עצביים ופגיעה ביעילותן של התנהגויות תפקודיות[33]. לתופעה זו יש מספר הסברים. ראשית, לסנכרון בין תאי עצב יש תפקיד חשוב לאינטגרציה של יחידות תפקודיות במוח והוא מושפע רבות מהרעשים של המוח. ייתכן שרעשים אלו אף תורמים ליכולת הסנכרון העצבי במוח[34]. כמו כן, התופעה של תהודה אקראית במערכת העצבים מראה גם היא עקומת U הפוכה, בה רמת התפקוד מגיעה לשיא ברמות מתונות[27]. למעשה, השיא של עקומת התהודה האקראית של מערכת העצבים תלוי ברמת המוליך העצבי דופמין[35], אשר משפיע על רמת התנודתיות והקיבולת של המערכת הנוירו-קוגניטיבית[33]. בהתאם לכך, הקשר בין הדופמין לתפקודים קוגניטיביים אינו ליניארי אלא בעל צורה של U הפוכה, כך שעודף או חוסר של דופמין יכולים להוביל לפגיעה בתפקוד[10][36].
תאי עצב יכולים ליצור כמות משמעותית של רעש פנימי[37]. הרעש הפנימי של מערכת העצבים מקושר לרמות הרקע (tone) של המוליך העצבי דופמין[27] והוא מאפשר לשפר את התפקוד של מערכת העצבים גם בסביבות שקטות שבהן לא קיים רעש חיצוני[37]. מכאן שהדופמין תורם לעיבוד אותות מיטבי של מערכת העצבים על ידי שיפור יחס אות לרעש[4][21].
רעש שנמצא בסביבה החיצונית של האדם ונקלט על ידי החושים, יכול גם הוא להכניס רעש למערכת העצבית דרך תהליכי התפיסה[35]. בהתאם לכך, נמצא שרעש חיצוני יכול לשפר את התפקוד הקוגניטיבי של אנשים עם רמות דופמין נמוכות, כמו למשל - אנשים עם הפרעת קשב, שצריכים יותר רעש עבור תפקוד קוגניטיבי מיטבי ביחס לאוכלוסייה[35].
דופמין ויצירתיות[עריכת קוד מקור | עריכה]
 ערך מורחב – יצירתיות
ערך מורחב – יצירתיות
היצירתיות מוגדרת כיכולת ההפקה של תגובות חדשות תואמות הקשר[13][38] ולכן לא כל הפקה של תוצר חדש או מקורי נחשבת לפעולה יצירתית. בהתאם לכך, חשיבה יצירתית מערבת שני תהליכים מחשבתיים שונים. התהליך הראשון הוא יצירה של דברים חדשים באמצעות חשיבה מסתעפת והשני הוא הערכה של הדברים שנוצרו על ידי חשיבה מתכנסת[39].
מבחינה נירולוגית, היצירתיות מתבססת על האפנון הדופמינרגי של המערכת הפרונטו-סטראיטלית Frontostriatal circuit, כאשר הדופמין שבקליפת המוח הקדם-מצחית מווסת את ההתמדה של תהליכי המחשבה היצירתיים והחשיבה המתכנסת, בעוד שהדופמין בסטריאטום מווסת את הגמישות של תהליכי המחשבה היצירתיים והחשיבה המסתעפת[40]. הקשר בין רמת הדופמין במערכת הפרונטו-סטריאטלית לבין היצירתיות הוא בצורה של U הפוכה[41]. כתוצאה מכך, ההשפעות של ירידה או עליה ברמות הדופמין על היצירתיות של אדם מסוים, תלויות ברמת הבסיס שלו[41].
מנגנון נוסף אשר יכול להסביר את הקשר בין דופמין ליצירתיות הוא הנטייה להתנהגות של חיפוש חידושים Novelty seeking, המקושרת לאזורים מוחיים שמכילים תאי עצב דופמינרגיים או מקושרים לתאי עצב דופמינרגיים מאזורים אחרים של המוח, כמו למשל: הסטריאטום הגחוני Ventral striatum, החומר השחור, הטגמנטום הגחוני והיפוקמפוס[38].
שינויים ברמת הדופמין ופתולוגיה[עריכת קוד מקור | עריכה]
תסמונות ומחלות רבות הסתברו כמושפעות מרמת הדופמין ומידת פעילותו. לרמת הדופמין בקליפת המוח הקדם-מצחית יש השפעה על ההתנהגות[2]. כמו כן, עלייה בכמות הדופמין במוח קשורה להגברת קשב וריכוז.
נהוג לחשוב שעלייה ברמת הדופמין באזורים מסוימים במוח גורמת לשיפור במצב הרוח. אך רמה גבוהה מדי, או פעילות יתר של דופמין מובילה אף היא לפתולוגיה: פעילות דופמינרגית של הטגמנטום הגחוני מעלה את רמת הדופמין לא רק בסטריאטום, אלא גם לאמיגדלה - שם הוא יכול לעורר פעילות הקשורה לצפייה לאיום ולא רק לצפייה לגמול[15].
כלומר, קליפת המוח הקדם-מצחית מתפקדת באופן מיטבי כאשר כמות הדופמין מיטבית[2]. עודף או חוסר של דופמין עלול לפגוע בצורה משמעותית בתפקוד שלה[36].
צורת ה- U ההפוכה המקושרת לתפקוד הדופמינרגי מובילה לכך שההשפעה של גנים המקושרים לדופמין יכולה להיות עוצמתית יותר בתקופות חיים או מצבים שבהם קיים חסך או עודף בפעילות של האותות הדופמינרגיים[30]. ישנם מספר מצבים המקושרים לחוסר איזון בתפקוד הדופמינרגי, למשל: הפרעה ביפולרית, הפרעת קשב, מחלת הפרקינסון וסכיזופרניה. כל אחד ממצבים אלו מאופיין בפגיעה דופמינרגית שונה, אשר מובילה לביטויים שונים ומצריכה טיפול שונה אצל אנשי המקצוע המתמחים בתחומים הרלוונטיים.
הפרעות במצב הרוח (הפרעות אפקטיביות)[עריכת קוד מקור | עריכה]
 ערכים מורחבים – הפרעה אפקטיבית, דיכאון קליני, מאניה, הפרעה דו-קוטבית
ערכים מורחבים – הפרעה אפקטיבית, דיכאון קליני, מאניה, הפרעה דו-קוטבית
לדופמין יש תפקיד חשוב בהפרעות מצב רוח[42][41].
מחקרים העלו קשר מובהק וחזק בין תת-פעילות של המערכת הדופמינרגית לבין תסמונת הפרעה דיכאונית מז'ורית[43], ובין רמת פעילות גבוהה מהרגיל למצב המאניה בהפרעה דו-קוטבית ("מאניה-דיפרסיה"), ובהתאם תת-פעילות של המערכת הדופמינרגית בשלב הדיכאון[44]. על סמך מחקרים אלו פותחו תרופות רבות, אגוניסטים לדופמין ומעכבי ספיגת דופמין שמעלים את פעילות המערכת הדופמינרגית כתרופה לדיכאון[45] (הן לדיכאון מז'ורי והן לשלב הדיכאון אצל חולים בהפרעה דו-קוטבית), ומייצבי רמת דופמין לשיכוך התנודה שבין מאניה לדיכאון אצל חולים בהפרעה דו-קוטבית.
הפרעת קשב[עריכת קוד מקור | עריכה]
 ערך מורחב – הפרעת קשב, ריכוז והיפראקטיביות
ערך מורחב – הפרעת קשב, ריכוז והיפראקטיביות
שלושת הנוירוטרנסמיטרים העיקריים המעורבים בהפרעת קשב הם דופמין, נוראפינפרין וסרוטונין, והאיזון ביניהם הוא גורם בעל השפעה רבה בקשב וריכוז. בהתאם לכך האטיולוגיה של הפרעת קשב מקושרת לשונות בגנים של קולטני הדופמין[17]. נראה שקשיי למידה הקשורים להפרעת קשב נובעים מ"נפילות קשב", אשר נגרמות מבעיות במטבוליזם של הדופמין[15].
פרקינסון[עריכת קוד מקור | עריכה]
 ערך מורחב – מחלת פרקינסון
ערך מורחב – מחלת פרקינסון
חוסר במוליך העצבי דופמין קשור בתנועתיות ובשרירים. בהתאם לכך, הדופמין מעורב במחלת הפרקינסון[19].
פרקינסון היא הפרעה הקשורה בשיבוש הדרגתי ומתמשך ביכולת המוטורית, אשר יכול להחמיר עד כדי מצבי סיכון חיים ומוות[42]. מחלת הפרקינסון נגרמת מהתנוונות של תאי העצב המייצרים את רוב הדופמין במוח[42]. הפתולוגיה הראשונית במחלת פרקינסון היא בחומר השחור (Substantia Nigra), גרעין שנמצא במוח האמצעי. כאשר באזור זה נהרסים הנוירונים הדופמינרגים (המפרישים דופמין) וכשנפגעים הסיבים של המסילות הנקראות Nigro-striatal Tracts, נגרם חוסר בדופמין, המוביל לקושי בשליטה על השרירים.
נראה שקשיי למידה הקשורים למחלת הפרקינסון נובעים מ"נפילות קשב", אשר נגרמות מבעיות במטבוליזם של הדופמין[15].
סכיזופרניה[עריכת קוד מקור | עריכה]
 ערך מורחב – סכיזופרניה
ערך מורחב – סכיזופרניה
הדופמין מעורב בסכיזופרניה[19][42], שהיא הפרעה נפשית כרונית מורכבת והטרוגנית בביטוייה, השייכת לקבוצת המחלות הפסיכוטיות.
בסכיזופרניה חלה ירידה מתמשכת בפעילות של קליפת המוח הקדם-מצחית, אשר מובילה להפחתה בפעילות הטונית (פעילות מתמשכת) של הדופמין. לאורך זמן, ההפחתה בפעילות הטונית של הדופמין מעלה את התגובתיות הפאזית (פעילות חזקה וקצרת טווח) באופן שאינו נורמלי[26]. בהתאם לכך, בקרב אנשים עם סכיזופרניה, ישנן רמות גבוהות מאוד של המוליך העצבי דופמין[42]. עלייה קיצונית ברמת הדופמין קשורה להזיות.
תסמונת הרגליים חסרות המנוחה[עריכת קוד מקור | עריכה]
 ערך מורחב – תסמונת הרגליים חסרות המנוחה
ערך מורחב – תסמונת הרגליים חסרות המנוחה
תסמונת הרגליים חסרות המנוחה, הוא מצב נוירולוגי הקשור בחסר ברמות דופמין. מתן של אגוניסטים לדופמין היה קשור בשיפור התסמינים של התסמונת.
היבטים רפואיים[עריכת קוד מקור | עריכה]
את הדופמין אפשר לקחת כתרופה המופצת לתאי הגוף על ידי מחזור הדם. באופן זה ניתן להשפיע על מערכת העצבים הסימפתטית, לצורך הגדלת קצב פעילות הלב ולחץ הדם.
עם זאת, מחסום דם-מוח אינו מאפשר לדופמין להגיע אל המוח ממחזור הדם. על כן, אם יש צורך להעלות את רמת הדופמין במערכת העצבים המרכזית, לא תהיה תועלת במתן זריקות או כדורים המכילים דופמין. כמו כן, באופן דומה לא תהיה השפעה גם לתזונה עשירה בדופמין[19]. על כן, במקרים אלו על הרופאים לחפש דרכים חלופיות המתבססות על אופן פעולת הדופמין במוח.
השפעת חומרים שונים על פעולת הדופמין במערכת העצבים המרכזית[עריכת קוד מקור | עריכה]
חומרים מסוימים יכולים להגביר או להחליש את הפעולה של הדופמין על התא הבתר-סינפטי בכל אחד משלבי ההעברה הסינפטית. הם מתחלקים לשני סוגים עיקריים על פי אופן ההשפעה שלהם:
- אגוניסט (AGO) - חומר הגורם לשפעול הפעולה של הדופמין על התא הבתר-סינפטי[2].
- אנטגוניסט (ANT) - חומר שמתנגד או מעכב את הפעולה של הדופמין על התא הבתר-סינפטי[2].
בנוסף, לחומרים הפעילים בתרופות יכולה להיות יותר מהשפעה אחת[2]. כאמור, הדופמין משתייך למוליכים עצביים מסוג קטכולאמין יחד עם אדרנלין ונוראדרנלין. מוליכים עצביים אלו שייכים לקבוצה הגדולה יותר המכונה מונואמינים הכוללת גם סרוטונין והיסטמין. משום שקבוצה זו של מוליכים עצביים דומה מבחינת המבנה המולקולרי שלה, יש תרופות המשפיעות בו זמנית על כל המוליכים העצביים הכלולים בה במידות שונות. כלומר, תרופות המשפיעות על פעילות הדופמין יכולות להשפיע גם על מוליכים קטכולאמינים או מונואמינים אחרים[2].
בהמשך יתוארו החומרים השונים המשפיעים על פעילות הדופמין על פי השלב הרלוונטי בתהליך ההעברה הסינפטי, אופן פעולתם והשפעתם על מוליכים עצביים אחרים מאותה הקבוצה.
חומרים המשפיעים על הכנת הדופמין באקסון[עריכת קוד מקור | עריכה]
סם הAMTP נקשר לאנזים ההופך טירוזין לאל-דופה וכך משבש את פעולתו ולפיכך נחשב לאנטגוניסט של קטכולאמינים.
התרופה רזרפין שהייתה בעבר בשימוש נגד יתר לחץ דם מונעת אגירת מונואמינים בשלפוחית סינפטית ולכן הוא אנטגוניסט של מונואמינים.
חומרים המשפיעים על פעולת הדופמין בקולטנים[עריכת קוד מקור | עריכה]
 ערך מורחב – אגוניסטים לדופמין
ערך מורחב – אגוניסטים לדופמין
קיימות מספר תרופות המשמשות כאגוניסטים לדופמין. תרופות אלו מחקות את פעילותו של דופמין בתאים הפוסט סינפטיים וגורמים לשרשרת תהליכים תוך תאית בדומה לזה שנעשה על ידי הצמדות דופמין לקולטן. התרופה אפומורפין היא דוגמה לאגוניסטים אלו ומשמשת בטיפול במחלת פרקינסון קשה.
חומרים המשפיעים על פינוי הדופמין מהסינפסה[עריכת קוד מקור | עריכה]

ישנם מספר חומרים אגוניסטיים המעכבים את הספיגה החוזרת של הדופמין מהסינפסה. שלושת החומרים המוכרים ביותר הם אמפטמין, קוקאין ומתילפנידאט[2].
- אמפטמין - גורם פליטה של נוראדרנלין ודופמין ביחד על ידי שינוי כיוון הפעולה של הנשאים שלהם. משום שהוא גורם לנשאים שלהם לפעול בכיוון הפוך מהרגיל, הם לא מסוגלים לפנות את הדופמין מהסינפסה[2].
- קוקאין - חומר החוסם את הספיגה החוזרת של הדופמין (ושל נוראדרנלין). בנוסף, הוא חוסם גם תעלות נתרן תלויות מתח. בגלל התכונה האחרונה הוא שימש פעם כתרופה לאלחוש מקומי, למשל בצורת טיפות עבור ניתוחי עיניים[2] וכן בהתערבויות של רפואת האף והשיניים. הוחלף לרוב בנגזרות פחות פסיכואקטיביות. בכלל הקוקאין ידוע כסם פסיכואקטיבי מקבוצת הממריצים-מעוררים (פסיכוסטימולנטים)[46]. הוא בעל פוטנציאל ממכר חזק. בהרעלת קוקאין ניתן לצפות מצב מרומם או אפקט שטוח, עוררות יתר, רגזון, אי שקט, דופק מהיר, שינויים בלחץ דם, לפעמים תופעות פסיכוטיות כמו מחשבות פאראנואידיות, הזיות שמיעה, ראייה או מגע. אלו האחרונות קשורות לעלייה ברמת הדופמין. תסמונת הנסיגה שבאה אחרי צריכת הסם מתאפיינת בעיקר בתשישות ודיכאון ובשלב מסוים חיפוש חוזר אחרי הסם[47].
- מתילפנידאט (MPH) - תרופה זו מוכרת יותר בשם המסחרי ריטלין והיא משמשת לטיפול בהפרעת קשב, ריכוז והיפראקטיביות[17][48] ונרקולפסיה. מתילפנידאט חוסם את הספיגה החוזרת של הדופמין[2] (ושל נוראדרנלין). כתוצאה מכך הוא מעלה את הרמות הסינפטיות של דופמין וקטכולאמינים אחרים[8].
קישורים חיצוניים[עריכת קוד מקור | עריכה]
- Dopamine in action- סרטון הסבר על פעולת הדופמין במוח (באנגלית)

- Dopamine and the frontal lobes דופמין והאונה הקדמית (באנגלית)

- Your brain is more than a bag of chemicals – על המורכבות של הפעילות הדופמינרגית במוח. הרצאה של David Anderson מאתר TED, באנגלית עם כתוביות בעברית

- Dopamine Functions על התפקוד של דופמין במוח האנושי
 סמדר רייספלד, מה הקשר בין פרקינסון לאמונה דתית, באתר הארץ, 16 בדצמבר 2014
סמדר רייספלד, מה הקשר בין פרקינסון לאמונה דתית, באתר הארץ, 16 בדצמבר 2014- דופמין, באתר אנציקלופדיה בריטניקה (באנגלית)
 דופמין, דף שער בספרייה הלאומית
דופמין, דף שער בספרייה הלאומית
ראו גם[עריכת קוד מקור | עריכה]
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 מוניץ, ח' (עורך). (2016). פרקים נבחרים בפסיכיאטריה. מהדורה שישית. תל אביב: דיונון.
- ^ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Neil R. Carlson, (2013). Physiology of Behavior. Boston: Pearson.
- ^ 1 2 3 4 Mark R. Rosenzweig, Arnold L. Leiman, S. Marc Breedlove (1999). Biological psychology: an introduction to behavioral, cognitive, and clinical neuroscience. 2nd ed. Sunderland, Massachusetts: Sinauer Associates.
- ^ 1 2 3 4 5 6 Kroener, S., Chandler, L., Phillips, P. M., & Seamans, J. K. (2009). Dopamine Modulates Persistent Synaptic Activity and Enhances the Signal-to-Noise Ratio in the Prefrontal Cortex. Plos ONE, 4(8), 1-14.
- ^ 1 2 3 Madden, Gregory J. (Ed); Bickel, Warren K. (Ed), (2010). Impulsivity: The behavioral and neurological science of discounting. Washington, DC, US: American Psychological Association, xvi, 453 pp.
- ^ 1 2 3 Ott, T., & Nieder, A. (2019). Dopamine and cognitive control in prefrontal cortex. Trends in cognitive sciences.
- ^ Thiele, A., & Bellgrove, M. A. (2018). Neuromodulation of attention. Neuron, 97(4), 769-785.
- ^ 1 2 3 4 5 Ranganath, A., & Jacob, S. N. (2016). Doping the mind: dopaminergic modulation of prefrontal cortical cognition. The Neuroscientist, 22(6), 593-603.
- ^ 1 2 Floresco, S. B., & Magyar, O. (2006). Mesocortical dopamine modulation of executive functions: Beyond working memory.Psychopharmacology, 188(4), 567-85.
- ^ 1 2 Cools, R., & D'Esposito, M. (2011). Inverted-U–Shaped Dopamine actions on human working memory and cognitive control. Biological psychiatry, 69(12), e113-e125.
- ^ 1 2 3 יעל עדיני, אהוד נורי, אבי קרני ומעיין ורטמן, (2012). נירופדגוגיה: לא על המוטיבציה (האינדוידואלית) לבדה: מנגנוני למידה גמול ומוטיבציה במוח ובכיתה. מתוך אתר מס"ע.
- ^ 1 2 de Manzano, Ö., Cervenka, S., Jucaite, A., Hellenäs, O., Farde, L., & Ullén, F. (2012). Individual differences in the proneness to have flow experiences are linked to dopamine D2-receptor availability in the dorsal striatum. NeuroImage 67, 1-6.
- ^ 1 2 3 4 5 Mayseless, N., Uzefovsky, F., Shalev, I., Ebstein, R. P., & Shamay-Tsoory, S. G. (2013). The association between creativity and 7R polymorphism in the dopamine receptor D4 gene (DRD4). Frontiers in human neuroscience, 7.
- ^ 1 2 3 Zabelina, D. L., Colzato, L., Beeman, M., & Hommel, B. (2016). Dopamine and the creative mind: Individual differences in creativity are predicted by interactions between dopamine genes DAT and COMT. PloS one, 11(1).
- ^ 1 2 3 4 Calkins, Susan D. (Ed); Bell, Martha Ann (Ed), (2010). Child development at the intersection of emotion and cognition. Human brain development. Washington, DC, US: American Psychological Association.
- ^ 1 2 3 4 5 6 Berger, Andrea, (2011). Self-regulation: Brain, cognition, and development. Human brain development series., (pp. 61-90). Washington, DC, US: American Psychological Association
- ^ 1 2 3 4 5 6 Tripp, G., & Wickens, J. R. (2009). Neurobiology of ADHD. Neuropharmacology,57(7), 579-589.
- ^ Association of the dopamine transporter gene and ADHD symptoms in a Canadian population-based sample of same-age twins
- ^ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 רמי רחמימוב (2004). מהפכת המוח: תקשורת, מחלות נפש וסמים. רעננה: מכון ון ליר בירושלים הקיבוץ המאוחד.
- ^ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 By Vaidya, Chandan J.; Gordon, Evan M. ROLE OF DOPAMINE IN THE PATHOPHYSIOLOGY OF ATTENTION'DEFICIT/HYPERACTIVITY DISORDER Kar, Bhoomika Rastogi (Ed), (2013). Cognition and brain development: Converging evidence from various methodologies. APA human brain development series., (pp. 105-125). Washington, DC, US: American Psychological Association, xiii, 328 pp.
- ^ 1 2 Bertolino, A., Di Giorgio, A., Blasi, G., Sambataro, F., Caforio, G., Sinibaldi, L., ... & Dallapiccola, B. (2008). Epistasis between dopamine regulating genes identifies a nonlinear response of the human hippocampus during memory tasks. Biological psychiatry, 64(3), 226-234.
- ^ 1 2 3 4 Söderqvist, S., Nutley, S. B., Peyrard-Janvid, M., Matsson, H., Humphreys, K., Kere, J., & Klingberg, T. (2012). Dopamine, working memory, and training induced plasticity: Implications for developmental research. Developmental psychology, 48(3), 836.
- ^ 1 2 3 4 Neve, K. A., Seamans, J. K., & Trantham-Davidson, H. (2004). Dopamine receptor signaling. Journal of receptors and signal transduction, 24(3), 165-205.
- ^ Wang, G. J., Volkow, N. D., Logan, J., Pappas, N. R., Wong, C. T., Zhu, W., ... & Fowler, J. S. (2001). Brain dopamine and obesity. The Lancet, 357(9253), 354-357.
- ^ 1 2 3 4 5 6 Fiorillo, C. D., Tobler, P. N., & Schultz, W. (2003). Discrete coding of reward probability and uncertainty by dopamine neurons. Science, 299(5614), 1898-1902.
- ^ 1 2 3 4 5 6 Grace, A. A. (1991). Phasic versus tonic dopamine release and the modulation of dopamine system responsivity: a hypothesis for the etiology of schizophrenia.Neuroscience, 41(1), 1-24.
- ^ 1 2 3 4 5 6 Söderlund, G.,B.W., Sikström, S., Loftesnes, J. M., & Sonuga-Barke, E. (2010). The effects of background white noise on memory performance in inattentive school children. Behavioral and Brain Functions, 6, 55.
- ^ 1 2 3 4 Matthews, N., Vance, A., Cummins, T. D., Wagner, J., Connolly, A., Yamada, J., ... & Bellgrove, M. A. (2012). The COMT Val158 allele is associated with impaired delayed-match-to-sample performance in ADHD. Behavioral and brain functions, 8(1), 25.
- ^ 1 2 3 Schacht, J. P. (2016). COMT val158met moderation of dopaminergic drug effects on cognitive function: a critical review. The pharmacogenomics journal, 16(5), 430-438.
- ^ 1 2 3 4 Li, S. C. (2012). Neuromodulation of behavioral and cognitive development across the life span. Developmental psychology, 48(3), 810.
- ^ 1 2 Bromberg-Martin, E. S., Matsumoto, M., & Hikosaka, O. (2010). Dopamine in motivational control: rewarding, aversive, and alerting. Neuron, 68(5), 815-834.
- ^ 1 2 Schultz, W. (2006). Behavioral theories and the neurophysiology of reward.Annu. Rev. Psychol., 57, 87-115.
- ^ 1 2 3 4 Molenaar, Peter C. M. (Ed); Newell, Karl M. (Ed), (2010). Individual pathways of change: Statistical models for analyzing learning and development., (pp. 23-35). Washington, DC, US: American Psychological Association, xv, 227 pp.
- ^ Ward, L. M., Doesburg, S. M., Kitajo, K., MacLean, S. E., & Roggeveen, A. B. (2006). Neural synchrony in stochastic resonance, attention, and consciousness. Canadian Journal of Experimental Psychology/Revue canadienne de psychologie expérimentale, 60(4), 319.
- ^ 1 2 3 Söderlund, G., Sikström, S., & Smart, A. (2007). Listen to the noise: noise is beneficial for cognitive performance in ADHD. Journal of Child Psychology and Psychiatry, 48(8), 840-847.
- ^ 1 2 Arnsten, A. F. (2011). Catecholamine influences on dorsolateral prefrontal cortical networks. Biological psychiatry, 69(12), e89-e99.
- ^ 1 2 Wiesenfeld, K., & Moss, F. (1995). Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature, 373(6509), 33-36.
- ^ 1 2 Faust‐Socher, A., Kenett, Y. N., Cohen, O. S., Hassin‐Baer, S., & Inzelberg, R. (2014). Enhanced creative thinking under dopaminergic therapy in Parkinson disease. Annals of neurology, 75(6), 935-942.
- ^ Cropley, A. (2006). In Praise of Convergent Thinking. Creativity Research Journal, 18(3), 391-404.
- ^ Zhang, W., Sjoerds, Z., & Hommel, B. (2020). Metacontrol of human creativity: The neurocognitive mechanisms of convergent and divergent thinking. NeuroImage, 116572.
- ^ 1 2 3 Boot, N., Baas, M., van Gaal, S., Cools, R., & De Dreu, C. K. (2017). Creative cognition and dopaminergic modulation of fronto-striatal networks: Integrative review and research agenda. Neuroscience & Biobehavioral Reviews, 78, 13-23.
- ^ 1 2 3 4 5 גריג ר. ג. וזימברדו פ.ג. (2010). מבוא לפסיכולוגיה. הוצאת האוניברסיטה הפתוחה.
- ^ תפקידו של דופמין בפיזיופתולוגיה של דיכאון
- ^ תסמונת ויסות לקוי של דופמין
- ^ תפקידה של המערכת הדופמינרגית בדיכאון
- ^ American Psychiatric Association Diagnostic and Statistical Manual of Mental Disorders 5th Edition,ch.Substance-Related and Addictive Disorders Washington DC 2013 עמוד 482
- ^ DSM-5 עמודים 567-569
- ^ Volkow, N. D., Wang, G. J., Fowler, J. S., Telang, F., Maynard, L., Logan, J., . . . Swanson, J. M. (2004). Evidence that methylphenidate enhances the saliency of a mathematical task by increasing dopamine in the human brain. American Journal of Psychiatry, 161, 1173-1180.
| פנתילאמינים | |
|---|---|
|
הבהרה: המידע בוויקיפדיה נועד להעשרה בלבד ואינו מהווה ייעוץ רפואי.
